神经电生理微电极阵列检测系统研制
林楠森 宋轶琳 刘春秀 蔡新霞*
①(中国科学院电子学研究所传感技术国家重点实验室 北京 100190)
②(中国科学院研究生院 北京 100190)
1 引言
人体的神经系统是由数以亿计的神经元组成的复杂网络,神经系统中信息的编码与处理在很大程度上是通过大量神经元构成的群体协同活动完成的,因此对神经元群体开展全面、准确、实时、同步的检测,能够获得更为全面、有效的数据,为进一步揭示神经信号传递、编码与解码的本质提供可靠的帮助[1]。传统的神经电生理信号检测手段可分为3类:(1)膜片钳记录、(2)胞内记录、(3)胞外记录。检测电极大都是以金属微丝和玻璃微电极为主,存在检测通道数少,操作繁琐等缺点。随着电子技术和微机械加工技术的发展,微电极阵列(Micro-Eelectrode Array, MEA)作为一种对传统方法的加强,实现了对神经网络的高空间分辨率的检测,并且大大简化了实验步骤,同时可以检测几十甚至上百个通道的电生理信号。目前在心脏研究、突出可塑性研究、神经再生研究、高通量药物筛选等研究领域发挥越来越重要的作用[2−4]。
虽然微电极阵列(MEA)技术具有以上的诸多优点,但相较于传统的检测手段,微电极阵列所检测到信号幅度偏低、信噪比不高,这和电极与待测神经元接触不够紧密有关。例如在脑组织切片的实验中,切片表面会有一定厚度的死细胞层,阻碍了待测细胞和电极的接触,导致检测到的信号幅度往往比传统方法小2-3个数量级[5,6]。
本文针对神经微电极阵列信号检测的特点,设计了多通道神经电生理信号检测系统,可实现多通道微电极信号的同步检测,结合实验室自制平面微电极阵列进行大鼠海马区脑切片的电生理实验,检测到幅度范围在几十μV的自发神经动作电位。
2 实验方法
2.1 系统设计
检测系统由硬件和软件两部分组成。其中硬件结构框图如图1所示,包括微电极阵列接口模块、多通道信号放大模块、数据采集模块,可以实现多通道的神经电生理信号同步检测,并将数据通过USB接口传往计算机进行数据的实时处理。

图1 神经微电极阵列检测系统硬件结构框图
软件编写从可靠性和灵活性考虑,本文采用Windows XP操作系统和Visual C++作为编程开发平台。为保证多通道大数据量的实时处理,采用了多线程技术,可分为数据的采集、处理和显示、存储3个线程,线程之间的数据交换利用同步事件进行控制。利用多级缓存队列等技术保证系统具有高效的数据处理能力。软件具备信号采集、实时显示、存储、FIR滤波、在线锋电位甄别、回放等功能[7,8]。
2.2 微电极阵列接口模块
微电极阵列是采用MEMS工艺加工的器件,尺寸十分微小,难以直接和检测系统相连,图2所示为用于组织切片或神经细胞检测的平面微电极阵列,中心检测区域的电极尺寸为30 μm。

图2 平面微电极阵列
因此本文通过电极接口模块实现微电极和检测系统的相连。接口模块实物如图3所示,通过焊接在印刷电路板上的弹性探针和微电极阵列的引线相接触,4个角上的螺丝起固定和调节松紧的作用,电路板上同时焊接有标准的接插件,从而可直接和检测电路相连。为屏蔽外界的电磁干扰,微弱信号走线的周围都由地线包围。

图3 微电极阵列接口模块
2.3 多通道信号放大模块
神经胞外记录的信号幅度一般为几十至几百μV,频率范围在10-2000 Hz,而生物体自身或外界的噪声信号往往会将有用信号淹没。因而信号检测电路必须有较高的增益、较低的输入噪声、合适的频带范围以及较强的抗干扰能力,同时由于微电极的阻抗一般达到MΩ级,检测电路的输入阻抗至少要达到GΩ级才能保证信号的完整提取[9]。针对以上信号的检测特点,本文设计的电生理信号的检测电路由前置放大器、带通滤波、后级放大组成。
为保证系统对噪声干扰的抑制作用,采用仪表放大器AD620作为前置放大电路,可以获得较低的输入噪声、较高的输入阻抗以及共模抑制比。传统的一些前置放大器采取交流耦合的方式以消除直流的极化电压(几十到几百 mV),防止放大电路的饱和。但阻容元件的引入会降低共模抑制比,还会使系统的通频带发生偏移,而且由于运放的偏置电流会对电容进行充电,导致在微电极上出现直流电压,进而会使电极发生电解反应,缩短电极的使用寿命。因此本文采取直流耦合的方式检测,为防止直流极化电压导致放大器饱和,AD620的增益为10,其后接截止频率为10 Hz的高通滤波器滤除直流极化电压的干扰。神经电信号大致可分为两类:一类是变化较为缓慢的场电位,这类信号的频率主要集中在300 Hz以下,另一类为快速变化的动作电位,频率在 300-1000 Hz。所以本文的系统选频范围为10-3000 Hz,能够同时记录到场电位和动作电位,再通过软件的数字滤波功能将这两类电位分离开。对于来自工频的干扰,传统的电生理检测电路加入50 Hz陷波器以滤除工频干扰,但神经电生理信号的一部分信息也同样会被滤除,而且工频的谐波成分同样还存在,因此本文主要是通过提高系统的共模抑制比 (Common Mode Rejection Ratio, CMRR)和接地屏蔽措施来排除外界电磁干扰的影响,对于工频干扰特别严重的情况还可以通过系统软件的数字滤波功能来滤除。
2.4 数据采集模块
由于神经电生理信号的频率主要分布在 2000 Hz以下的频段内,为了对原始信号较好地复原,系统的采样率应不低于10 kHz。本系统的数据采集卡选用北京阿尔泰科技发展有限公司的 USB2080型数据采集卡,具有400 kHz, 14 bit的数据采集能力。
2.5 动物实验取材及电生理信号记录
实验动物采用2-3周大的SD大鼠(Sprague-Dawley)。为保证脑组织的活性,在未注射麻醉的情况下对大鼠采取快速斩首法,用眼科剪和眼科镊将脑部迅速取出,放入0oC的人工脑脊液中进行快速冷冻,并通以95% O2和5% CO2的配比氧。其中人工脑脊液(Artificial CerebroSpinal Fluid, ACSF)的成分为NaCl 124 mmol/L, KC14 mmol/L,MgSO4·7H2O 2 mmol/L, Ca.Cl22 mmol/L,NaHCO326 mmol/L, NaH2PO4· 2H2O 1.25 mmol/L, Glucose 10 mmol/L, pH值为7.2。1 min后取出,用切片机将海马区切成厚度为300 μm左右的脑片,放入37oC的人工脑脊液中(通以配比氧)孵育1 h左右。
将经过孵育的脑片移至实验室自制的平面微电极阵列表面。在显微镜下对其进行定位,用移液枪和滤纸将多余液体吸尽,保证脑片和微电极阵列之间能够紧密贴合,用尼龙网或脑片夹压在脑片上防止灌流时漂移。上述准备工作完成后对脑片进行灌流,用本检测系统接上电极进行检测。
3 结果
3.1 系统参数测试
实验过程中基线的宽度很大一部分是由电子元器件的噪声组成,如电路中阻容元件的热噪声;半导体器件的散弹噪声、1/f噪声、爆裂噪声;电源的纹波噪声。基线过宽势必会造成有用信号难以分辨,降低信噪比,因此系统的输入噪声一定要远小于待测信号的幅度。同时系统的放大增益、带宽范围、共模抑制比等参数对于微弱信号检测也非常重要。为了对系统的性能进行评估,对包括以上各主要参数进行了测试,图4表示的是系统输入短路时的等效输入噪声,其幅度Vpp=7-8 μV,Vpp为峰-峰电压。

图4 系统的等效输入噪声
为了测试系统的增益,利用Vpp=2 mV的100 Hz正弦波作为信号源,通过检测系统的输出即可得到系统的增益。如图5(a)所示,系统的输出幅度为Vpp=2 V,即系统的增益为60 dB。改变正弦波的频率,便可得到系统在各频率点上的增益,即带宽范围。如图5(b)所示,系统的带宽为10-3000 Hz,其中在大于低通截止频率时,信号的衰减率为-80 dB;在小于高通截止频率时,信号的衰减率为-60 dB。
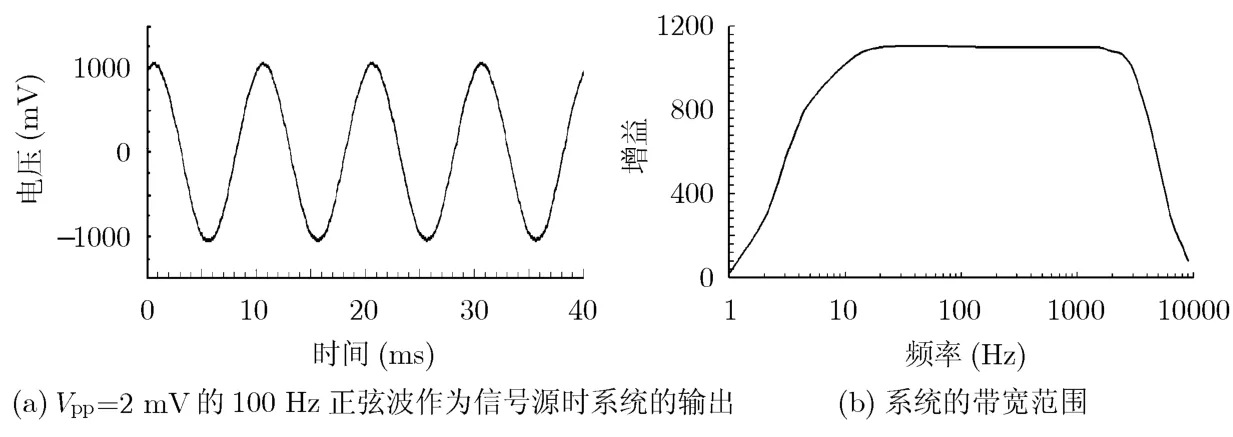
图5 系统的增益和带宽
为了验证系统的微弱信号检测能力,在其通带范围内选择100 Hz, 300 Hz, 500 Hz, 700 Hz, 900 Hz的Vpp=2 mV正弦波作为输入,通过判断检测信号的信噪比判断系统的性能。图6所示为系统输出信号的频谱图,由图可知对各模拟信号源所检测到的信号信噪比都在20 dB以上。因此系统的检测下限可以达到微伏级,能够满足神经电生理信号的检测需要。

图6 系统输出信号的频谱图
此外还对检测系统的其它主要的参数指标进行了测试,具体见表1。

表1 检测系统各项参数
3.2 神经电生理信号检测
利用平面微电极阵列对急性海马脑切片进行检测,往往会遇到组织与电极的贴合不紧密以及电极不能刺穿表面死细胞层的阻隔等问题,检测到的神经胞外信号一般小于100 μV。
图7为利用实验室自制微电极阵列和本检测系统所记录到的神经电生理活动信息,其中图7(a)显示神经元的阵发排放型放电活动,其特点是暴发期间隔很长,但在放电期波形较为集中。图7(b)显示的是神经元的紧张发放型放电活动,其特点是放电极为迅速,放电频率也很高。通过阈值法将图7(b)中的动作电位提取出来并叠加在一起可得到如图7(c)所示的动作电位波形图,从图中可以明显的看出神经元放电的去极化和复极化过程。动作电位的幅度在30 μV左右,周期为2-3 ms,符合胞外记录的信号特点。由于系统的输入噪声仅为Vrms=2 μV,同时具有较高的共模干扰抑制比和较好的电磁屏蔽设计,所以可很好地分辨出细胞放电信号和噪声基线。

图7 系统所检测到的神经电生理信号
4 结束语
在基于微电极阵列的神经电生理信号检测中,信号的幅度十分微弱,易于被生物体自身的噪声或外界电磁干扰所淹没。本文针对上述检测难点,采用微弱信号放大技术、电磁屏蔽技术、数字信号处理技术等方法,在系统硬件和软件设计上保证微弱信号的高信噪比检测。系统的输入噪声Vrms<2 μV,增益为60 dB,共模抑制比大于90 dB,频率带宽范围为10-3000 Hz。通过对系统参数的测试和SD大鼠海马脑区切片的检测实验,表明本文所设计的多通道神经电生理信号检测系统各项参数能够满足微弱神经信号的提取和检测。该仪器在神经科学基础研究、神经性疾病研究及药物筛选方面具有潜在的应用前景。
致谢 感谢北京大学神经科学研究所在动物实验方面所提供的帮助。
[1] Xu Chen-yang, Lemon W, Liu Chang,et al.. Design and fabrication of a high-density metal microelectrode array for neural recording[J].Sensors and Actuators A:Physical, 2002,96(1): 78-85.
[2] Martinoia S, Bonzano L, Chiappalone M,et al.. In vitro cortical neuronal networks as a new high-sensitive system for biosensing applications[J].Biosensors and Bioelectronics,2005, 20(10): 2071-2078.
[3] Xiang Guang-xin, Pan Liang-bin,et al.. Microelectrode array-based system for neuropharmacological applications with cortical neurons cultured in vitro[J].Biosensors and Bioelectronics, 2007, 22(11): 2478-2484.
[4] Johnstone A F M, Gross G W,et al.. Microelectrode arrays: a physiologically based neurotoxicity testing platform for the 21st century[J].NeuroToxicology, 2010, 31(4): 331-350.
[5] Van Bergen A, Papanikolaou T,et al.. Long-term stimulation of mouse hippocampal slice culture on microelectrode array[J].Brain Research Protocols, 2003, 11(2): 123-133.
[6] Kroker K S, Rosenbrock H, Rast G,et al.. A multi-slice recording system for stable late phase hippocampal long-term potentiation experiments[J].Journal of Neuroscience Methods, 2010, 194(2): 394-401.
[7] Bokil H, Andrews P,et al.. Chronux: a platform for analyzing neural signals[J].Journal of Neuroscience Methods, 2010,192(1): 146-151.
[8] Cui Jie, Xu Lei, Bressler S L,et al.. BSMART: a Matlab/ C toolbox for analysis of multichannel neural time series[J].Neural Networks, 2008, 21(8): 1094-1104.
[9] Pancrazio J J, Gray S A,et al.. A portable microelectrode array recording system incorporating cultured neuronal networks for neurotoxin detection[J].Biosensors and Bioelectronics, 2003, 18(11): 1339-1347.
[10] 杨润生, 潘盛武, 方颖, 等. 离体大鼠海马神经元自发放电活动一般特征的研究[J]. 生物医学工程研究, 2009, 28(1): 25-27.Yang Run-sheng, Pan Sheng-wu, Fang Ying,et al.. The general electric activity characters of the rat hippocampus ex-vivo pyramidal cells[J].Journal of Biomedical Engineering Research, 2009, 28(1): 25-27.

