林下参根区土壤微生物群落结构的研究
张亚玉,孙 海,宋晓霞,汪景宽
(1.沈阳农业大学 土地与环境学院,沈阳110161;2.中国农业科学院 特产研究所,吉林 吉林132109)
林下参是将人参种子撒播到林地,任其自然生长,若干年后进行采挖的仿野生人参,发展林下参是目前人参产业的主要生产模式,但在林下参发展过程中,由于选地不当,造成林下参的存苗率低,根形变劣的现象普遍,给广大参户带来巨大的经济损失,也制约了林下参产业的发展。前人对于林下参的生态环境进行了较详细的描述,对林下参适宜生长的林种[1-2]、光照[3]、水分及土壤类型等进行了调查研究;钟伟丽等[4]、郑毅男[5]对林下参种子油、总皂苷含量及单体皂苷进行了测试研究,孙海[6]报道了林下参根区土壤的无机养分状况,为林下参产业的发展提供了有利指导,但对于林下参土壤微生物的相应研究尚未见报道,土壤微生物群落被认为是土壤生态系统的预警及敏感指标,指示土壤质量变化,决定着土壤的生态功能。本文利用磷脂脂肪酸法(PLFA)对5,10,15,20,25年生林下参根区土壤的微生物结构特征及变化趋势进行了分析研究,期望为林下参产业的健康发展和农田栽参的改土提供些许参考。
1 材料与方法
1.1 材料
林下参根区土壤采自人参之乡的吉林省抚松县露水河镇吴杰野山参护育基地,该区位于东经127°46′,北纬42°48′,属山区湿润气候,海拔520m,土壤属暗棕壤,选择同一坡度、同一坡位、同一坡向生长的大致年限在5,10,15,20,25年生林下参,将芦头以上的土壤剥去,采集参根周边土壤(4~10cm),边挖参边取土,5,10,15年取3株混合,20,25年取2株混合,同时采集未生长人参的土壤作为对照。将土壤装入封口塑料袋中,带回实验室,冰箱保存。
1.2 方法
采用改进的White[7]方法提取磷脂脂肪酸,基本步骤为:(1)称4g新鲜土样于玻璃离心管中,加入4 ml柠檬酸缓冲液,5ml氯仿,10ml甲醇,25℃避光震荡4h,离心15min。(2)转移上清液到25ml试管中,加1.6ml柠檬酸缓冲液,2ml氯仿,4ml甲醇进行第2次提取,震荡2h,离心15min。(3)上清液合并,加7ml柠檬酸缓冲液,7ml氯仿,震荡5min,避光保存18h。(4)经18h分离后,吸走上层液,下层液转移到新试管中,氮气吹干。(5)用柱层析硅胶0.8g(在120℃下烘干2h)填充玻璃管柱(直径6 mm),10ml氯仿洗柱后,用5ml氯仿溶解样品并注入硅胶柱中。加10ml氯仿和10ml丙酮依次洗脱,去除中性脂和糖脂。最后用10ml甲醇洗脱磷脂脂肪酸于10ml离心管中,在氮气流下吹干样品。(6)向干样品中加入1ml甲醇:甲苯(1∶1)混合液,溶解脂类,再加1ml 0.2mol/L KOH甲醇溶液,37℃水浴15min后,冷却至室温,依次加入2ml去离子水,0.3ml 1mol/L醋酸溶液,2ml正己烷,震荡1min,离心10min,转移上层有机相到10ml样品瓶中。下层相再加2ml正己烷,重复上一步骤,合并两次提取的正己烷相,氮气流下吹干,于-20℃下保存。(7)上机前加入0.05ml甲酯化的C19:0内标,氮气流下吹干,用0.15ml正己烷定溶转移至GC内插管中待测。用气质联机检测得到PLFA谱图。
由安捷伦GC-MS(6890N-5973N)进行检测。色谱柱为hp5-MS(30m×250um×0.25um)石英毛细管柱。GC-MS分析条件:升温程序:进样后在70℃保持0.5min,之后以20℃/min的速率升至190℃,保持1min,以5℃/min的速率上升到200℃,停留2min,以10℃/min的速率上升到280℃,保留8min。进样口温度为250℃,载气为 He(0.9ml/min),分流比为10∶1,离子源温度230℃,四极杆150℃,质谱全扫描范围30~600m/z。
脂肪酸定量用峰面积和内标曲线法。内标为甲酯化的 C19:0,外标为 SupelcoTM37Component FAME Mix和Bacterial Acid Methl Esters Mix。PLFA含量用nmol/g表示。
脂肪酸链长以碳原子总数计算,从羧基开始,冒号后数字代表双键数目,ω后数字代表双键的位置(从羧基端算起),c表示顺势双键,t表示反式双键,i表示顺势支链,a表示反势支链,br表示不确定支链位置,Me表示甲基位置,cy表示环丙基。

表1 磷脂脂肪酸的代表生物
2 结果与分析
2.1 林下参根区土壤微生物PLFA图谱特征
共测得林下参根区土壤中脂肪酸种类28种,根区土壤与非根区土壤微生物所含脂肪酸种类基本相同。鉴定的PLFAs,C链长度从14~24,包括饱和、不饱和、甲基化分支和环化脂肪谱。
在5年生林下参根区土壤的PLFAs中,i15:0,a15:0,15:0,i16:0,16:1ω9c,16:1ω9t,16:0,br17:0,i17:0,10Me17:0,cy17:0,18:2,18:1ω9c,18:1ω9t等14种PLFAs丰度较高,是5年林下参根区土壤微生物的主要成分。根区中 15:0,16:1ω9c,16:1ω9t,16:0摩尔浓度与对照相比有减少的趋势,而代表放线菌种类的10Me17:0的摩尔浓度则由6.88nmol/g增加到12.142nmol/g。
i15:0,a15:0,i16:0,16:1ω9c,16:1ω9t,16:0,br17:0,i17:0,18:2,18:1ω9c,18:1ω9t等11种 PLFAs是10年林下参根区土壤微生物的主要成分。其中a15:0,16:1ω9c,16:1ω9t,16:0,18:2,18:1ω9c,18:1ω9t摩尔浓度与对照相比有减少的趋势,而i15:0,i16:0,br17:0,i17:0的摩尔浓度与对照相比则有增加。
14:0,i15:0,a15:0,i16:0,16:1ω9c,16:1ω9t,16:0,br17:0,i17:0,10Me17:0,cy17:0,18:2,18:1ω9c,18:1ω9t等14种PLFAs在15年生根区土壤中丰度较高,是其微生物的主要成分。在占有优势组分的14中磷脂脂肪酸的摩尔浓度与对照相比除15:0,16:1ω9t有减少的趋势,其它均有增加的趋势。
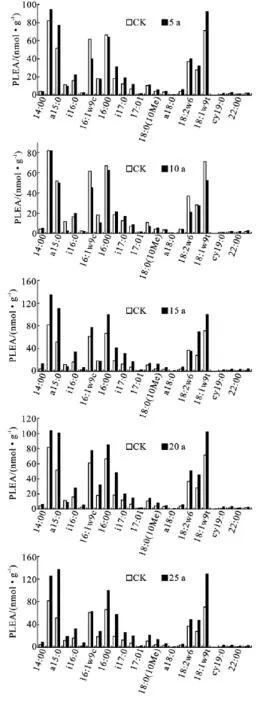
图1 林下参土壤磷脂脂肪酸图谱(a为生长年限)
在20年生林下护育山参根区土壤的PLFAs中,i15:0,a15:0,i16:0,16:1ω9c,16:1ω9t,16:0,br17:0,i17:0,10Me17:0,cy17:0,18:2,18:1ω9c,18:1ω9t等13种PLFAs丰度较高,是20年林下山参根区土壤微生物的主要成分;与对照相比均有增加的趋势。
在25年生林下参根区土壤的PLFAs中,i15:0,a15:0,15:0,i16:0,16:1ω9c,16:1ω9t,16:0,br17:0,i17:0,10Me17:0,cy17:0,10Me18:0,18:2,18:1ω9c,18:1ω9t等15种PLFAs丰度较高,是25年林下参根区土壤微生物的主要成分。与20年生林下护育山参相似,在占有优势组分的15年中磷脂脂肪酸的摩尔浓度与对照相比均有增加的趋势。25年生与20年生相比根区土壤中优势微生物种群增加了代表细菌的15:0和放线菌的10Me18:0,其它主要种类则未发生变化,没有增加新型代表真菌的组成部分,可以推断,在林下护育山参生长过程中,为了不断适应生存环境,在20年以后林下护育山参根区土壤微生物组成基本上保持相对平衡。
2.2 林下参不同年生根区土壤PLFA的变化特征
从表2中可以明显看出林下参根区土壤微生物磷脂脂肪酸在量上差异较大,其中i15:0,a15:0,18:1ω9t,16:0,16:1ω9c,18:1ω9c,br17:0,18:2ω6,i16:0,16:1ω9t等10种PLFAs在林下参根区土壤中比例占有优势地位,在不同年生微生物组成上比较一致,并随着人参的生长发生一定的变化,与对照根区土壤微生物组成相比,5年生林下参微生物变化不明显,而10年和15年生山参根区土壤微生物数量和种类的变化较为剧烈,20年与25年生趋于稳定,略有变化,但变化的结果是有益微生物群落比例增加,使人参根区微生物群落特征朝着有利于人参生长的方向发展。
2.3 林下参根区土壤微生物群落主成分分析
对不同年生林下参土壤磷脂脂肪酸进行主成分分析 (Principal component analysis,PCA),第 一(PCA1)、第二(PCA2)主成分累计贡献率为93.76%,其中第一主成分贡献率为84.9%。其中脂肪酸i15:0,a15:0,16:0,br17:0,18:2ω6和18:1ω9c在第一主成分中贡献率较高,贡献率分别为0.366,0.601,0.295,0.255,0.229,0.440。
从主成分分析图3中可以看出,对照与5年生和10年生林下护育山参第一、第二主成分相近,说明土壤微生物群落结构相近,15年和20年、25年生林下参土壤第一主成分距离相近、第二主成分相聚较远,说明不同年生土壤中脂肪酸类型在i15:0,a15:0,16:0,br17:0,18:2ω6,18:1ω9c相近,但是也存在脂肪酸的差异,也就是第二主成分中的脂肪酸16:1ω9c的变化,研究表明:16:1ω9c脂肪酸的变化与土壤的pH值的变化呈极显著正相关,进一步说明了20年后林下参根区土壤的微生物结构与小年生间发生了一定的改变,由于人参的生长其根系的代谢作用,向根区分泌一定量的酸性有机物影响着根区土壤的pH值和有效养分状况,也直接影响微生物的群落结构特征。
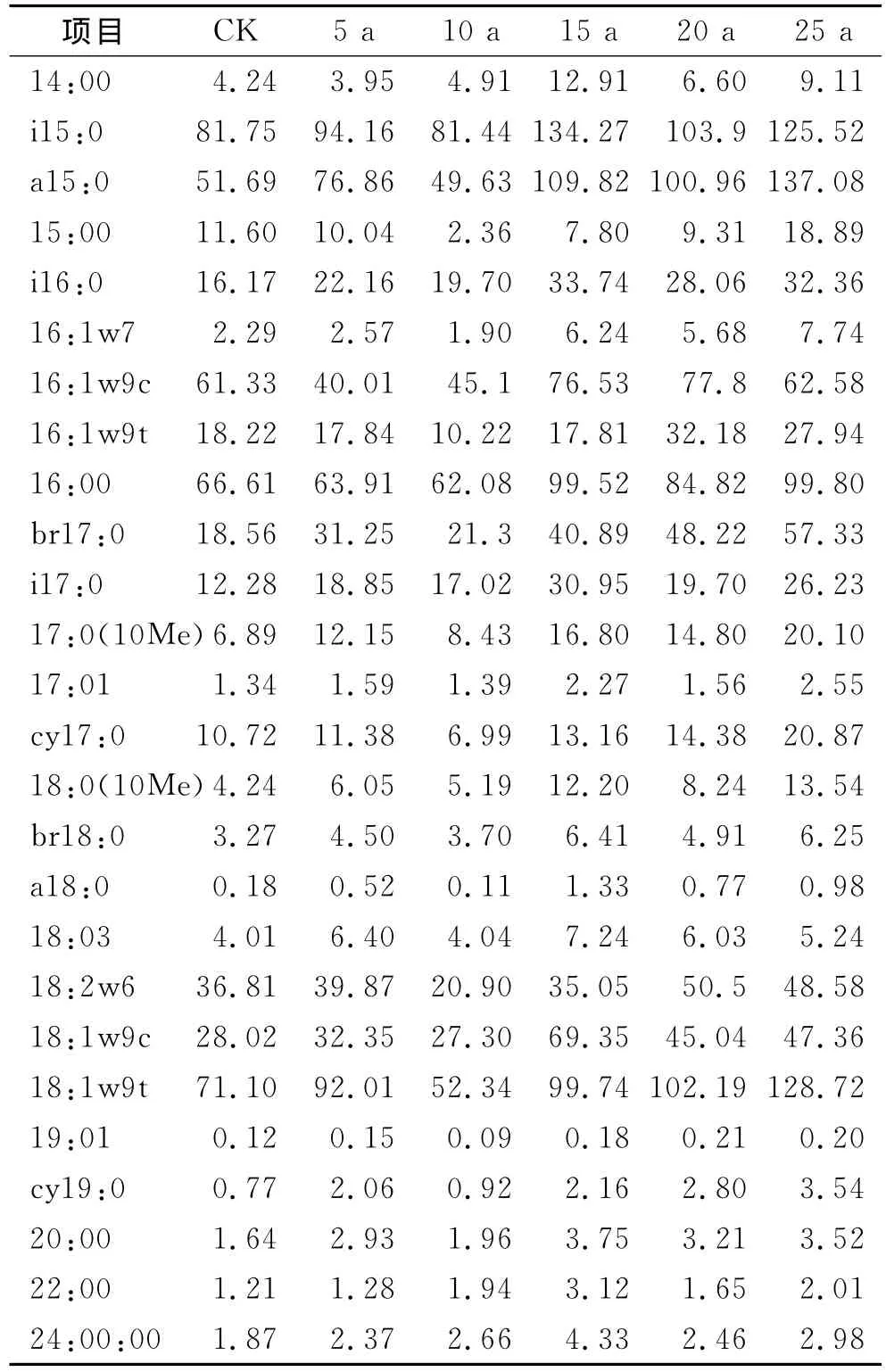
表2 不同年生林下参土壤磷脂脂肪酸变化
2.4 林下参根区土壤微生物生物量的变化特征研究
从对不同年生林下参根区土壤微生物量的分析结果可以看出,微生物总量有增加的趋势,但在大约10生林下参根区土壤的微生物总量却在减少,与对照及不同年生相比数量明显减少,而15年生以后微生物总量在不断增加,明显高于未栽参的土壤微生物群落组成,在生产实际中林下参在8~10年间掉苗现象比较严重,是否是人参与其生长环境的自然协调的关键时期,有待进一步研究。
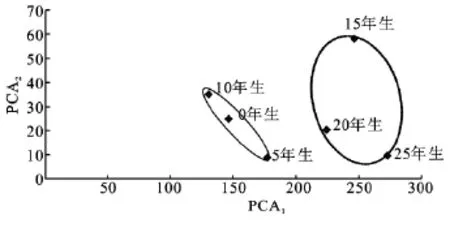
图2 不同年生林下护育山参土壤微生物群落结构主成分分析
不同年生林下参根区土壤放线菌量的变化特征与微生物总量基本一致,只是一直处于增加的趋势,即使是在微生物总量严重降低的10年生左右的林下参根区土壤,与对照相比其变化虽不显著,但趋势是增加的,而非降低。大约15年以后,放线菌的量比对照增加了2倍甚至3倍,20年和25年生放线菌占微生物总量的比率为2.965%和3.63%,明显高于对照的2.13%。
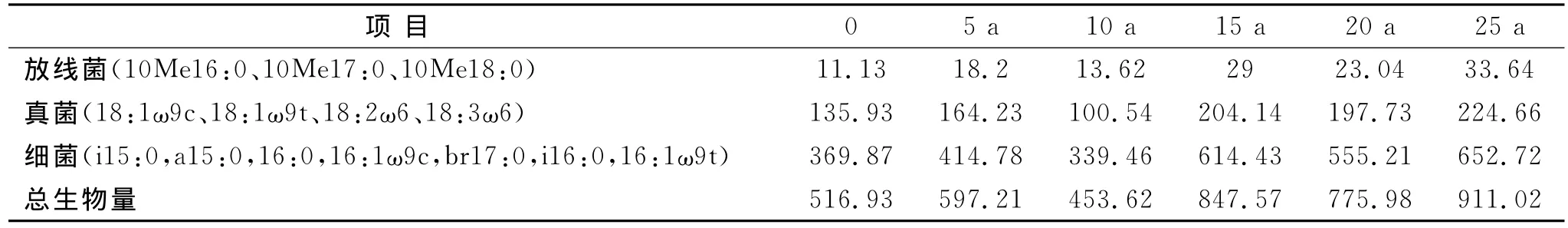
表3 林下参土壤微生物量
不同年生林下参根区土壤细菌的变化特征与微生物总量完全相同,15年生以后细菌量也在增加,但增加的幅度在1.5倍以上低于2倍,远低于放线菌的增加幅度。不同年生林下参根区土壤真菌的变化趋势亦与微生物总量的变化趋势一致,除大约10年生的根区土壤真菌有降低,其余均有增加,但增加的幅度小于1.5倍;20和25年生真菌占微生物总量的比率分别是25.41%和24.58%与对照的26.16%相比有减少的趋势,可见在林下参生长过程中,微生物的群落结构发生了显著的变化,趋于复杂,趋于稳定,更有益于林下参健康生长。
3 讨论
(1)不同年生林下参微生物的多样性研究结果表明,在林下参生长过程中,根区土壤微生物的种类基本相同,但量上具有一定差异,随着林下参的生长,由于根系的代谢作用对根区土壤的酸碱度、养分状况会有一定的影响作用,导致微生物的组成在量上发生变化,15年以下的林下参根区微生物的磷脂脂肪酸种类变化较为不定,对林下参的生长影响较大,生产上也存在10年左右保苗率不稳定的现象,可能与其根区土壤微生物的结构具有一定的联系,随着林下参的生长,根区土壤微生物的总量不断增加,群落趋于复杂,微生物的结构趋于稳定,有利于林下参的健康生长。
(2)从对林下参根区土壤的细菌、放线菌及真菌变化情况的分析发现,20年及25年林下参根区土壤的微生物的群落结构特征变化是放线菌占微生物总量的比率为2.965%和3.63%,明显高于对照的2.13%;真菌占微生物总量的比率分别是25.41%和24.58%,低于对照的26.16%。由于在人参生长过程中多数病害的发生是由于真菌的感染导致的[10],真菌的增加是老参地土壤性状变劣的主要原因[11-12],而放线菌是人参生长的有益菌对改善人参土壤微环境和提高人参的产量、质量和抗病性均具有一定的改善作用。可见林下参土壤微生物的结构变化是朝着有益于人参健康生长的方向发展。
(3)Bardgett[13]等认为土壤中磷脂脂肪酸的组成可以表示土壤微生物群落的生物量和结构。不同菌群的磷脂脂肪酸图谱不同,可以作为微生物群落中不同群体的标记物,微生物的生物量可以通过脂肪酸的含量来估算。人参土壤微生物的研究目前还没有利用土壤中磷脂脂肪酸的组成进行描述研究,本文利用PFLA法研究了林下参根区土壤微生物多样性,克服了以往在人参土壤微生物的研究上采用的传统培养法的诸多不足,提供了较为准确的土壤微生物结构状况。是对林下参研究系统的完善,也是对野山参研究的补充,更能为农田栽参科学改土提供指导,具有较大的生产意义。
[1] 刘琪景,王贺新.野生人参自然分布的典型原始阔叶红松林群落及其特征研究[J].植物研究,1994,14(3):292-298.
[2] 于海业,张蕾,周丽娜,等.林下人参叶片光合日变化的初步研究[J].吉林农业大学学报,2007,29(3):237-240.
[3] 吴德成,牟兆军,柏松林,等.林下与效应带种植人参环境因子的动态变化[J].植物研究,1995,15(1)118-123.
[4] 钟伟丽,李平亚.林下参总皂苷含量的分析[J].特产研究,2007(2):67-69.
[5] 郑毅男.林下参人参皂苷分析[J].吉林农业大学学报,2008,30(4):486-491.
[6] 孙海,张亚玉,宋晓霞,等.林下参根区土壤养分状况研究 [J].安徽农业科学,2010,38(1):289-297.
[7] White D C,Stair J O,Ringelberg D B.Quantitative comparisons of in situ microbial biodiversity by signature biomarker analysis[J].Journal of Industry Microbiology,1996,17:185-196.
[8] Zelles L,Bai Q Y,Beck T.Signature fatty acids in phospholipids and lipopolysaccharides as indicators of microbial biomass and community structure in agricultural soils[J].Soil Biology&Biochemistry,1992,24(4):317-323.
[9] SalomonováS,LamacǒváJ,Rulík M,et al.Determination of phospholipid fatty acids in sediments[J].Acta Universitatis Palackianae Olomucensis Facultas Rerum Naturalium:Chemica,2003,42:39-49.
[10] 白容霖,刘学敏,刘伟成.吉林省人参根腐病病原真菌种类的研究[J].植物病理学报,1999,29(3):285-285.
[11] 李世昌,刘梅娟,卢凤勇,等.栽参对土壤微生物生态及土壤酶活性的影响[J].生态学报,1983,3(1):29-34.
[12] 张镇媛,陈珊,夏红梅,等.不同土壤栽参后对土壤分解微生物生态和有机质的分解作用[J].东北师大学报:自然科学版,1993,29(2):95-99.
[13] Bardgett R D,Lovell R D,Hobbs P J,et al.Sesaonal changes in soilmicrobial communities along a fertility gradientof temperate grasslands[J].Soil Biology and Biochemistry,1999,31:1021-1030.

