芹菜斑枯病研究概述
朱 鑫 高国训 王 萱
(天津市农业高新技术示范园区管理中心,天津 300384)
芹菜斑枯病(Septoria apiicola)又叫叶枯病,俗称火龙病,国外大多叫做晚疫病(Celery late blight),是威胁芹菜生产的一种重要病害,不仅对田间生长的芹菜产生不良影响,而且在贮运期间也能造成严重危害。
芹菜斑枯病最早于1890年发现于意大利(Sherf & MacNab,1986),到1921年,这种病害已经蔓延到北美和欧洲的许多地区(Krout,1921;Lacy & Cortright,1992)。到目前为止,世界各个地区的芹菜生产都受到过芹菜斑枯病的严重危害,造成的损失高达50 %~90 %(Sherf &MacNab,1986;Minchinton,2008)。在我国,几乎所有的芹菜产区都发生过严重的斑枯病(赵奎华,2009),云南省呈贡县调查发现,当地芹菜斑枯病发病率一般为 20 %~30 %,有时可达80 %以上,严重时全部受害(王海燕,2006)。
为了有效控制芹菜斑枯病的发生与危害,国内外学者先后从该病害的病原菌特性、发病症状、发病规律、防治措施、抗病性鉴定、遗传规律和抗病育种等方面进行了研究,本文对这些研究做一概述,旨在为今后工作提供参考和借鉴。
1 病原菌
1890年,Briosi和Cavara在芹菜上最早发现该病时,将其病原菌命名为Septoria petroselini var.apii,Chester于1891年将其改名为Septoria apii,1915年俄罗斯的Dorogin发表文章认为,芹菜斑枯病的病原菌有两种,一种是主要存在于欧洲的Septoria apii,可引起大斑型斑枯病,另一种是存在于美国的 Septoria apii-graveolentis,可引起小斑型斑枯病。这一说法曾经得到部分学者的支持(Berger,1970)。但Gabrielson和Grogan(1964)、Sheridan(1968a)的研究表明,上述两种病原菌实际上是同一种病原菌,只是发生了一些细微的变化,他们建议采用 Septoria apiicola作为芹菜斑枯病菌的学名,目前这一命名已经得到广泛认可,国际真菌学会(IMA)正在采用此命名。
芹菜斑枯病病原菌为半知菌亚门壳针孢属芹菜生壳针孢菌。分生孢子器近球形,生于寄主种子或侵染组织表皮下,大小为(87.0~155.4)μm×(25.0~56.0)μm,黄褐色至黑色,遇水潮湿后可从孔口逸出逾5400个分生孢子。分生孢子线形,无色透明,直或弯曲,顶端稍钝,尾部圆锥形或长锥形。典型的孢子具有 3个以上隔膜,而年幼的孢子不具这种隔膜,大小为(10.0~72.0)μm×(0.9~3.0)μm(Sherf & MacNab,1986;Hausbeck et al.,2002)。分生孢子萌发时,隔膜增多或断裂成若干段,每段均产生芽管(陈雪 等,2007)。
2 为害症状与侵染循环
芹菜斑枯病主要发生在叶片上,也可为害叶柄和茎。发病初期,叶片黄绿色,出现油渍状小斑点,直径一般小于5 mm,边缘明显。这些病斑不久就变成褐色,组织逐渐坏死,斑面上散生一些小黑点,这些小黑点就是从表皮突显出的分生孢子器,也是鉴定和识别芹菜斑枯病的重要标志(Gabrielson & Grogan,1964)。病斑外缘有时呈黄褐色,形状多为不规则形,叶柄及茎部的病斑则多为近菱形至近椭圆形,表面稍凹陷,灰褐色,病斑内部颜色较外缘浅,其上散生小黑点(Koike et al.,2006)。
田间观察发现,往往是植株外围的、位置靠下的大龄叶片最早出现病斑,之后再向上部的幼嫩叶片扩展,如果病情得不到控制,叶片上的病斑就会增多、变大,并相互合拢,导致整张叶片变褐、坏死(Koike et al.,2006),甚至整株死亡(Sherf & MacNab,1986)。
芹菜斑枯病主要是通过种子传播的(Berger,1970;Koike et al.,2006)。英国的一项调查显示:93 %以上的芹菜种子都携带斑枯病病菌,其中大部分病菌会在8个月内死亡,但仍有少数病菌可以存活15个月(Sherf & MacNab,1986),最长的可以达到2 a(Maude,1996)。有人注意到,当年新繁制的芹菜种子往往携带较多病菌,而存放几年后种子上具有生活力的病菌数量就会显著减少;但如果将种子存放在干燥、低温条件下,那么病菌存活的时间可延长到2~3 a(Koike et al.,2006)。除了种子,感病植株的残枝败叶也是芹菜斑枯病的主要传播途径之一,植株带病残体上的斑枯病病菌存活时间根据所处的具体环境条件而有所不同,埋入土壤中的病残体上的病菌分生孢子在4个月内具有生活力(Sheridan,1966),Maude和Shuring(1970)报道可维持9个月,最长不超过21个月。还有报道,当土壤中的病残体处于干燥状态,病菌生活力可维持 18个月,如果病残体组织完全降解消失,病菌生活力只能维持 6个月(Gabrielson,1962)。植株病残体降解快慢与气候条件有关,如果气候比较温暖,那么降解就快,其携带的病菌存活的时间也较短(Sherf & MacNab,1986)。
芹菜斑枯病病菌主要通过风雨、喷灌、农事操作、动物以及农具等传播。病菌在低温、潮湿的环境条件下产生分生孢子和分生孢子器,萌发后的孢子直接进入气孔和穿透叶片的上、下表皮造成侵染。带病种子发芽时,种皮上的分生孢子器经常粘附在展开的子叶上,在湿度适宜的条件下,大约14 d子叶上就会出现新的分生孢子器,随后孢子将进一步扩散到新叶和嫩茎上,幼苗即表现出病症。寄主发病后产生分生孢子器,释放分生孢子,进行重复再侵染(Sherf &MacNab,1986)。
分生孢子萌发与温度和湿度密切相关。有试验表明,芹菜感病后,在5~25 ℃温度范围内,病斑数量随着温度的升高而增加,25 ℃以后开始下降;同时,病斑数量随着湿度持续时间的延长而增加(Mathieu & Kushalappa,1993)。Sheridan(1968b)也发现,在室内试验中,芹菜斑枯病病菌孢子萌发至少需要保持 12 h的 100 %相对湿度,在 20.0~22.5 ℃条件下最易萌发。Sheridan(1968c)进一步进行田间试验表明,芹菜叶片被病菌侵染需要相对湿度94.5 %以上、保持36 h以上,当温度超过30 ℃时,病情会得到一定遏制。Lacy(1994)试验发现,芹菜叶片接种斑枯病病菌后保持21 ℃、36~48 h温润状态,那么最早8 d叶片就可出现病斑,21 d后每片小叶上最多出现14个病斑,而25 ℃下最多只能出现2.5个病斑。
3 综合防治技术
3.1 化学防治技术
目前,最常用的防治芹菜斑枯病的措施是喷施杀菌剂。喷施杀菌剂一般要在病斑出现之前或者在病斑刚刚出现的时候进行,这样得到的防治效果最好,如果等到发病严重时再喷,不仅病情难以控制,而且损失也无法挽回(Mudita & Kushalappa,1993)。
3.1.1 化学药剂 防治芹菜斑枯病使用最多的杀菌剂是百菌清或百菌清与其他杀菌剂的混合物(Mudita & Kushalappa,1993)。近几年,开始推广应用有效成分为嗜球果伞素类(strobilurin)的杀菌剂(Bounds & Hausbeck,2007a,2008),主要包括嘧菌酯、肟菌酯或他们的混合物。在美国密歇根州,当地种植者为了增强百菌清的防治效果,向百菌清药液中加入具有良好内吸性和治愈性的嘧菌酯(Hausbeck,2002;Bounds & Hausbeck,2004),美国环保局认为其对人体和环境的污染比其他杀菌剂更小(Bartlett et al.,2002)。
3.1.2 喷药时间 根据以往的经验,杀菌剂一般在芹菜定植后7~21 d内喷施第1次,之后间隔7~10 d再喷1次,就可有效控制斑枯病的发生,但这样做往往会导致杀菌剂施用过量。为了保证理想的防治效果,同时能够显著减少杀菌剂用量,人们不断进行试验与摸索,希望找到一种更加高效的杀菌剂施用方式。在这个过程中,有人曾设想将首次喷药时间推迟到定植21 d以后,以减少喷药次数,由于这种方式完全不考虑气候条件变化,因而防病效果并不稳定(Lacy,1973)。还有人主张等到田间芹菜达到一定发病率时再喷施杀菌剂,这样做的后果就是会造成相应的产量损失(Mudita & Kushalappa,1993)。
Lacy(1994)试验发现,芹菜叶片表面保持12 h湿润是植株感病的临界值,当湿润状态超过12 h,就应该喷施杀菌剂,据此,他连续3 a以12 h湿润为防控标准进行喷药防治斑枯病的试验,结果每年都可以减少2次喷药。Bounds和Hausbeck(2004,2007a,2007b)在密歇根州的试验报告也表明,这样做能减少1~2次喷药,如果在定植后28 d开始喷药,甚至能减少3~5次。
Mudita和 Kushalappa(1993)注意到,芹菜斑枯病的发生除了与叶片表面保持湿润的时间有关外,还与温度密切相关。TomCast病情预警系统之所以能够大范围地成功应用于芹菜斑枯病防治,正是基于此。TomCast病情预警系统是由FAST预警系统演变而来的(Madden et al.,1978),最初只是应用于番茄早疫病的预防,后来逐渐扩展到番茄晚疫病和炭疽病、胡萝卜斑点病和黑斑病、芹菜早疫病和斑枯病(Bounds & Hausbeck,2008)等病害的预防。
TomCast病情预警系统是先调查田间采集叶片湿润持续时间和此期间的平均温度,再根据表1列出的经验值查出病害严重度数值(DSV,disease severity values),计算出DSV积累值,当DSV积累值达到一定的阈值时,就提醒人们应该喷洒杀菌剂进行预防了。
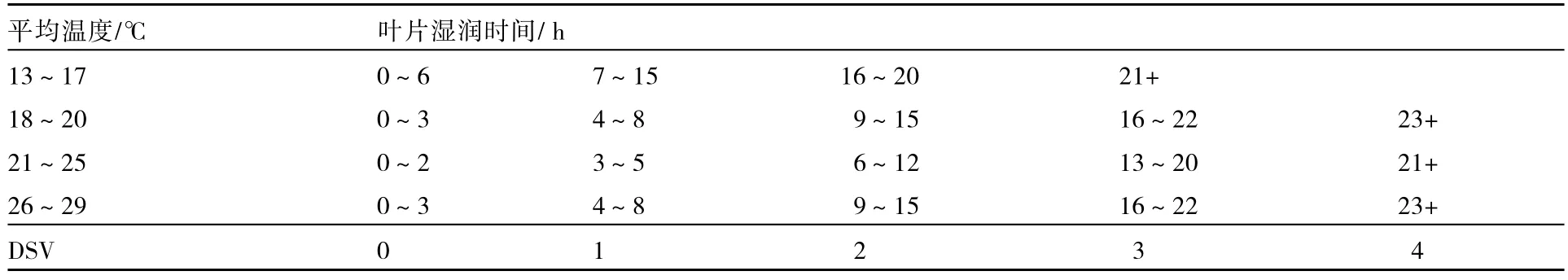
表1 TomCast病情预警系统DSV与环境条件对应表(Madden et al.,1978)
最初将TomCast病情预警系统用于芹菜斑枯病防治预警时,开始喷药的DSV阈值定的偏高,后来根据实际应用效果逐渐降低。如在加利福尼亚州,DSV阈值就由先前的 30降到 20,喷药减少1次;而在密歇根州,DSV阈值需进一步降到10,产量才不至于减少(Bounds et al.,2006;Bounds,2007a,2007b)。Minchinton(2008)研究发现这个系统更适合在芹菜生长前期使用,而不是在植株郁闭后。冬茬芹菜生长前期将DSV阈值定为10或15,能减少喷药6~8次。目前,美国Campbell’s soup公司所有芹菜生产都在使用TomCast病情预警系统来确定防治斑枯病的喷药次数,每年可以减少喷药 9~12次(Minchinton,2008)。在荷兰,应用 TomCast病情预警系统改进百菌清的喷施时间也已经取得成功(Minchinton,2008)。
3.2 其他防治技术
芹菜斑枯病主要通过种子传播,因此播种前进行种子处理是防治斑枯病的一项有效措施,实际生产中的具体处理方法:① 在48 ℃热水中浸泡30 min,在浸泡过程中不断进行搅动,使水温均匀,浸泡完后立刻放在冷水中冷却,随后晾干备用(Maude,1970);② 30 ℃下用0.2 %福美双溶液浸泡24 h(Sherf & MacNab,1986);③ 使用贮存期超过2 a的种子(Sherf & MacNab,1986);④ 在机械化育苗过程中,对非圆形的种子进行丸粒化处理。但是,经过处理的种子与未经处理的种子相比,保存2~3 a后发芽率会降低(Krout,1921)。
另外,轮作(Maude,1970)、清除病叶(Bounds & Hausbeck,2008)、苗期预防、平衡施肥(曹力强,2008;赵胜文 等,2008)、使用抗病品种如UC036SF(Quiros,2004)等措施也是防治芹菜斑枯病的有效方法。
4 抗病性鉴定
准确评价一个植物材料或品种的抗病性需要有一个科学的评价方法。以前对芹菜斑枯病为害程度的估计都是主观的,只用描写性的语言来表示。Ryan和Kavanagh(1971)用杀菌剂对斑枯病的控制率来表示。随着科技的进步,植物抗病性的评价方法已经从过去的概括的状态描述转向了精确的数量描述。现在大多数研究者都在田间或实验室用可见的、数量化的方法来评价一个品种或材料的抗病性(Edwards et al.,1997)。还有部分研究者从分子标记入手来分辨寄主是否有抗性(Winter & Karl,1995)。
4.1 孢子悬浮液的配制
从田间取芹菜感病植株叶片,用NaClO消毒后放入蒸馏水中浸泡10~15 min,提取孢子,过滤之后放入琼脂培养基中进行孢子培养,保持培养箱温度20 ℃、18 h光周期12 d,过滤后得到的孢子悬浮液用血球板计数器进行计数,稀释到2×104个·mL-1(Mudita & Kushalappa,1991)。Ochoa和Quiros(1989)则认为将病叶用蒸馏水浸提1 h,过滤后将孢子浓度调整到1×106个·mL-1比较好。也有报道将分离的病原菌接种在芹菜汁和 PDB混合培养基(Mathieu & Kushalappa,1993)、PLY 培养基(Edwards et al.,1997)、PDA 培养基(Gabrielson & Grogan,1964)或者CDAMS-V1培养基上(赵奎华,2009)。还有部分研究者认为将培养好的孢子浓度调整到1×105个·mL-1也可以达到接种的目的(Ben-Yephet et al.,1992;Edwards et al.,1997)。如果是小规模试验,Lacy(1994)认为可以不经过孢子提纯,直接用血球板计数器把孢子浓度调整到1×106个·mL-1。
4.2 接种方法
将分离好的芹菜斑枯病病原孢子溶液放入喷雾器中,在芹菜植株上部进行均匀喷雾,接种期一般为 3~6片真叶期(Ochoa & Quiros,1989;Mathieu & Kushalappa,1993;Mudita & Kushalappa,1993;Lacy,1994;Edwards et al.,1997)。接种后的植株在温度为20~24 ℃的培养室中保持叶片湿润 72 h(Mathieu & Kushalappa,1993;Mudita & Kushalappa,1993;Edwards et al.,1997),以促使发病。如果试验条件有限,还可以覆盖塑料袋8 d,以保持湿度(Ben-Yephet et al.,1992);或者在21 ℃下进行黑暗培养,并保持叶片连续湿润24 h或者间断性湿—干—湿12 h—12 h—12 h(Lacy,1994)。一般接种10 d后就有病症表现,21 d后就可以进行抗病性鉴定(Ochoa &Quiros,1989)。如果是对离体的芹菜叶片或植株进行接种,可以放置在铺有滤纸的培养皿中,其他发病条件与未离体植株一样(Edwards et al.,1997)。
Bounds和 Hausbeck(2007b)研究发现,如果要直接在田间进行抗病性鉴定,可以使用间接接种的方法。把提取的芹菜斑枯病病原孢子溶液喷洒在诱发行植株上,让病原菌通过自然的喷溅进行传播,接种后隔10~15 min喷1次水,以保持叶片湿润,持续12 h以上,所有的诱发行都要接种2次,时间分别在定植后的42 d和49 d或者39 d和51 d。这种方法受外界环境条件的干扰比较大,但是能准确反应田间的发病情况。
4.3 抗病性评价
刚开始对芹菜斑枯病进行分级的时候,都比较简单、粗略。Mudita和 Kushalappa(1993)仅仅把芹菜斑枯病发病率定为0、2 %、4 %、8 %和16 % 5个原始等级。Mathieu和Kushalappa(1993)也只是把病害程度分为4个等级:几乎不感染、少量感染、中度感染和严重感染。Lacy(1994)也只是通过计算叶片上的病斑数来确定植株抗性。Ochoa和Quiros(1989)通过计算叶片被侵染的百分率,把病情指数定为 5级。但随着试验的深入,芹菜植株上出现了一些其他病症,所以他们把病情指数分级标准进行了修改,加入了黄斑、坏死和分生孢子器数量,分级标准为:0级,无病害;1级,极少数分散的黄斑;2级,极少数分散的黄斑并伴随初始的坏死;3级,中等程度的分散黄斑,低于 25 %的坏死,表明分生孢子器的生长;4级,25 %~100 %的坏死斑,大量分生孢子器生长(Ochoa & Quiros,1989)。Edwards等(1997)把芹菜斑枯病病害指数分为 4级,在出现病斑和分生孢子器的基础上,还把失绿作为一个分级的标准;同时用3种方法来评估侵染的发展:① 病菌侵染百分率。在未离体叶片中计算每 20株植株中任意 1片叶片的斑点所占的百分率和被侵染植株的百分率,而离体叶片的计算方法是每10株植株中任意2片叶片的斑点数和被侵染叶片的百分率。② 病斑总数。在未离体叶片中计算每20株植株中每片叶片的病斑总数和病斑类型,而离体叶片的计算方法是每10株植株中任意2片叶片的病斑总数、类型和规模。③ 分生孢子数量。未离体叶片和离体叶片都是从每 10株被侵染的植株中任意选取2片叶片,每片叶片任意选取10个叶斑,用立体显微镜计算上面的分生孢子数。在鉴定一个品种或者材料的抗病性时,如果病害指数为 0,说明是免疫的,这只在野生芹菜和欧芹中发现;如果病害指数为 1,说明是高抗斑枯病,目前只在野生芹菜的杂交后代中发现;如果病害指数为 2,说明是一般抗斑枯病,在野生芹菜的杂交后代中有发现,并且还存在一个商品种Giant Red;如果病害指数为3,说明是高感斑枯病,大部分商品种都是高感品种。
5 抗病性遗传与育种
5.1 抗病品种研究现状
据 Thomas(1921)报道,叶色较绿的芹菜品种对斑枯病的抗性明显高于叶色偏淡的自白(self-blanching)品种;Donovan等(1986)也报道绿色品种较抗斑枯病,主要表现为叶片上病斑出现时间比较晚,而且病斑上的分生孢子器也较少。但更多的研究者发现,以往的芹菜品种对斑枯病的抗性水平普遍不高(Sheridan,1968a,1968b),Ochoa和Quiros(1989)曾对144个芹菜品种的抗病性进行了鉴定,希望能从中筛选出抗斑枯病品种,但结果却没有发现一个品种具有突出的抗性。Edwards等(1997)以叶片病斑表现作为量化指标对不同类型的芹菜品种进行抗病性评估,结果显示参试的所有商品种对斑枯病均为敏感或较敏感,且品种的抗性与叶绿素含量无关。
5.2 抗源材料筛选
为了寻找有效的斑枯病抗源材料,人们把视野扩大到与芹菜亲缘关系较近的野生芹菜类型和其他栽培种。Gabrielson(1952)最早发现野生芹菜Apium.sellowianum和Apium.nodiflorum对斑枯病具有抗性,而另一野生芹菜 Apium.australe则易感病。具有抗性的野生芹菜还有Apium.panul、Apium.chilense、Apium.prostratum和 Apium.leptophyllum,其中 A.nodiflorum和 A.leptophyllum的抗性水平较高,而 A.prostratum和 A.annuum则较低(Quiros,1987,1988;Ochoa & Quiros,1989)。此外,多项研究表明芹菜的近源种皱叶香芹(Petroselinum hortense)对斑枯病具有很高的抗性(Madjarova & Bubarova,1978;Honma & Lacey,1980;Ochoa & Quiros,1989);Edwards等(1997)还发现平叶香芹(Petroselinum crispum)和lovage(Ligusticum scoticum)同样具有极高的抗性。不过,上述抗性材料并不都能作为抗源用于进一步育种工作,主要原因是有的材料不能与芹菜实现杂交,如A.leptophyllum(Ochoa & Quiros,1986)。
5.3 抗病性遗传规律
根据杂交后代的抗病性表现,人们对芹菜抗斑枯病的遗传规律进行了推测分析,但得出的结论并不一致(Ochoa & Quiros,1989)。Bohme(1960)利用两个抗性不同的根芹材料进行杂交试验,得出的结论是芹菜斑枯病抗性是隐性遗传,而且是多基因控制的。Ochoa和Quiros(1989)根据两个芹菜×皱叶香芹的杂交试验结果得出相同的结论。不过,美国加州大学Quiros领导的研究小组利用抗病野生材料 A.panul和 A.chilense与普通芹菜品种进行杂交,经过多年的观察分析认为,芹菜斑枯病抗性是不完全显性遗传,至少有2个基因参与控制(Quiros,1998)。由此可见,芹菜斑枯病抗性遗传方式是多样化的,与抗源材料的遗传基础密切相关。
5.4 抗病品种选育
由于传统芹菜品种对斑枯病的抗性水平普遍不高,而且品种间差异不大,很难通过杂交获得具有较高抗性的新品种。利用具有高抗病性的野生芹菜作为抗源,与农艺性状优良的普通芹菜品种进行远缘杂交,再从F1自交或回交群体中选择抗性个体,并通过世代优选将其稳定下来,即可育成农艺性状优良的抗病品种。美国开展这样的研究工作已有很长时间了,但前期可能是由于所选抗源材料的杂交亲和力差和隐性遗传的原因,进展不是非常顺利,直到2001年,Quiros才首次在加州芹菜研究咨询委员会年度报告中提出,他们已经通过远缘杂交获得了 2个抗性品系99A242和99A244,2004又宣布获得了1个兼抗黄化病的芹菜抗性品系 UC036SF(Quiros,2001,2004)。
此外,Evenor等(1994)通过体细胞培养技术得到多个无性变异系,并经过多轮共培养和细胞再生过程获得抗性明显的植株,而且得到自交后代。不过到目前为止,还没有任何一个抗斑枯病品种在大规模芹菜生产中得到推广应用。
6 展望
芹菜斑枯病是威胁芹菜生产的一种重要病害,在全世界范围内都有发生,严重影响了芹菜的产量和品质,引起了各国研究者的关注。目前对芹菜斑枯病已经有了一定的了解,在发病规律、病原菌世代、抗病性鉴定等方面进行了深入的研究。但是也应该看到存在的问题,特别是我国对此的研究还处于初始阶段,应该密切关注国际上芹菜斑枯病研究动态,加强与国外相关研究机构的合作,通过转基因等生物技术方法从抗性材料中提取抗病基因,并导入成熟的商品种中,选育出抗病品种;其次是抗病性遗传规律的进一步研究,解决杂交亲和力差和隐性遗传的问题;三是建立针对性强、操作简便的抗病性评价体系,并通过该体系来评价一个品种或材料的抗性。
曹力强.2008.芹菜斑枯病的防治.北方园艺,(6):205.
陈雪,李宝聚,傅俊范,石延霞,赵彦杰.2007.芹菜斑枯病和叶斑病的识别与防治.中国蔬菜,(9):53-54.
王海燕.2006.保护地西芹斑枯病的发生与防治.长江蔬菜,(2):27.
赵奎华.2009.芹菜斑枯病菌生物学特性研究.菌物研究,7(3-4):169-179.
赵胜文,赵学宁,张爱民,张伟,刘传盈,甘怀忠.2008.芹菜斑枯病综合防治措施.现代园艺,(11):47.
Bartlett D W,Clough J M,Godwin J R,Hall A A,Hamer M,Parr-Dobrzanski B.2002.The strobilurin fungicides.Pest Manage Sci,58:649-662.
Ben-Yephe Y,Pressman E,Evenor D,Rappaport L.1992.Quantitative method of inoculation of celery plants with Septoria apiicola.Phytoparasitica,20:25-30.
Berger R D.1970.Epiphytolagy of celery late blight.Fla State Hortie Sac Proc,83:208-212.
Bohme H.1960.The causes of the different resistances of two different celeriac varieties to leaf spot(Septoria apii-graveolentis Dorogin).Phytopathologische Zeitschrift,37:195-213.
Bounds R S,Hausbeck M K,Podolsky R H.2006.Comparing disease for ecasters for timing fungicide sprays to control foliar blight on carrot.Plant Dis,90:264-268.
Bounds R S,Hausbeck M K.2004.Evaluation of a biopesticide and fungicides for managing late blight of celery.Fungic Nematicide Tests,59:80.
Bounds R S,Hausbeck M K.2007a.Comparing disease predictors and fungicide programs for late blight management in celery.Plant Dis,91:532-538.
Bounds R S,Hausbeck M K.2007b.Integrating disease thresholds with TomCast for carrot foliar blight management.Plant Dis,91:798-804.
Bounds R S,Hausbeck M K.2008.Evaluation of disease thresholds and predictors for managing late blight in celery.Plant Dis,92:438-444.
Chester F D.1891.Notes on three new or noteworthy diseases of plants.Bulletin of the Torrey Botanical Club,18(12):371-374.
Donovan A,Collin H A,Isaac S.1986.Selection for resistance to late blight in celery//Morris P,Scragg A H,Stafford A,Fowler M W.eds.Secondary Metabolosm in Plant Cell Cultures.Cambridge:Cambridge University Press:244-249.
Dorogin.1915.Septoria apii-graveolentis.Mater Mikol Fitopat Ross,1(4):72.
Edwards S J,Collin H A,Isaac S.1997.The response of different celery genotypes to infection by Septoria apiicola.Plant Pathology,46(2):264-270.
Evenor D,Pressman E,Ben-Yephet Y.1994.Somaclonal variation in celery and selection by coculturing toward resistance to Septoria apiicola.Plant Cell Tissue and Organ Culture,39:203-210.
Gabrielson R L,Grogan R G.1964.The celery late blight organism Septoria apiicola.Phytopathology,54:1251-1257.
Gabrielson R L.1952.Etiology of the Septoria blight,disease of celery and taxonomy of the causal organism〔D〕.Davis:University of California.
Gabrielson R L.1962.Survival of the celery late blight organism.Phytopathology,52:361.
Hausbeck M K,Cortright B D,Linderman S D.2002.Control of foliar blights of celery using standard fungicide programs and a diseaseforecaster.Fungic Nematicide Tests,57:23.
Hausbeck M K.2002.Late blight of celery//Davis R M,Raid R N.eds.Compendium of umbelliferous crop diseases.USA:American Phytopathological Society Press:21-22.
Honma S,Lacey M L.1980.Hybridisation between pascal celery and parsley.Euphytica,29:801-805.
Koike S T,Gladders P,Paulus A O.2006.Vegetable diseases:a color handbook.London:Manson Publishing Ltd:90-91.
Krout W S.1921.Treatment of celery seed for the control of Septoria blight.Jour Agr Res.,21:369-372.
Lacy M L,Cortright B D.1992.Chemical control of Septoria leaf(late)blight of celery.Fungic Nematicide Tests,47:90.
Lacy M L.1973.Control of Septoria leafspot of celery with systemic and nonsystemic fungicides.Plant Dis Rep,57:425-428.
Lacy M L.1994.Influence of wetness periods on infection of celery by Septoria apiicola and use in timing sprays for control.Plant Disease,78(10):975-979.
Madden L,Pannypacker S P,NacNab A A.1978.FAST,a forecast system for alternaria solani on tomato.Phytopathology,68:1354-1358.
Madjarova D J,Bubarova M G.1978.New forms obtained by hybridization of Aium graveolens × Petroselinum hortense.Acta Horticulturae,73:65-72.
Mathieu D,Kushalappa A C.1993.Effects of temperature and leaf wetness duration on the infection of celery by Septoria apiicola.Phytopathology,83(10):1036-1040.
Maude R B,Shuring C G.1970.The persistence of Septoria apiicola on diseased celery debris in soil.Plant Pathology,19:177-179.
Maude R B.1970.The control of Septoria on celery seed.Ann Appl Biol,65:249-254.
Maude R B.1996.Longevity of seedborne organisms//Maude R B.Seedborne diseases and their control.〔S.L.〕:CAB International:32-43.
Minchinton E.2008.Validation of a disease forecasting model to manage late blight in celery.http://www.vgavic.org.au/pdf/r&d VG06047 Septoria Celery Model Validation extract.pdf.
Mudita,Kushalappa.1991.Effect of media and temperature on sporulation of Septoria apiicola,and of inoculum density on septoria blight severity in celery.Phytoprotection,72:97-103.
Mudita,Kushalappa.1993.Ineffectiveness of the first fungicide application at different initial disease incidence levels to manage Septoria apiicola blight in celery.Plant Disease,77(11):1081-1084.
Ochoa O,Quiros C F.1986.Interspecific hybridization in apium:novel source of variability for clery.Ort Sci,21:791.
Ochoa O,Quiros C F.1989.Apium wild species:novel sources for resistance to late blight in celery.Plant Breeding,102:317-321.
Quiros.1987.Celery genetics and breeding for disease resistance.Annual Report of the California Celery Research Advisory Board for 1986-1987:1-5.
Quiros C F.1988.Breeding celery for disease resistance and improved quality.Annual Report of the California Celery Research Advisory Board for 1987-1988:19-22.
Quiros C F.1998.Celery genetics and breeding for disease resistance.Annual Report of the California Celery Research Advisory Board for 1997-1998:13-18.
Quiros C F.2001.Celery genetics and breeding for disease resistance.Annual Report of the California Celery Research Advisory Board for 2000-2001:1-5.
Quiros C F.2004.Celery genetics and breeding for disease resistance.Annual Report of the California Celery Research Advisory Board for 2003-2004:1-6.
Ryan E W,Kavanagh T.1971.Comparison of fungicides for control of leaf spot(Septoria apiicola)of celery.Annals of Applied Biology,67:121-129.
Sherf A F,MacNab A A.1986.Celery//Vegetable diseases and their control.New York:John Wiley & Sons:157-201.
Sheridan J E.1966.Celery leaf spot:sources of inoculum.Ann Appl Biol,57:75-81.
Sheridan J E.1968a.The causal organism of celery leaf spot,Septoria apiicola.Trans actions British Mycological Society,51(2):207-213.
Sheridan J E.1968b.Conditions for germination of pycnidiospores of Sepdaria apiicola Speg.New Zealand Journal of Botany,6:315-322.
Sheridan J E.1968c.Conditions for infection of celery by Seproria apiicola.Plant Dis Rep,52:142-145.
Thomas H E.1921.The relation of health of the host and other factors to infection of Apium graveolens by Septoria apiicola.Bulletin of the Torrey Botanical Club,48(1):1-29.
Winter P,Karl G.1995.Molecular marker technologies for plant improvement.World Journal of Microbiology & Biotechnology,11:438-448.

