补加前体DL-蛋氨酸对S-腺苷-L-蛋氨酸发酵的影响
沈天丰,王 普
(1.浙江工业大学药学院,浙江 杭州 310032;2.浙江普洛家园药业有限公司,浙江 东阳 322118)
S-腺苷-L-蛋氨酸(S-adenosyl-L-methionine,简称SAM)是一种广泛存在于活体细胞内的生物小分子,可由ATP:蛋氨酸腺苷转移酶(MAT)催化等分子的L-蛋氨酸和ATP合成得到[1].SAM是甲硫键型高能化合物,是生物体内一种重要的生理活性物质和中间代谢物质,具有转甲基、转氨丙基和转硫等多种生理生化功能.细胞内SAM浓度的微小改变,便会对细胞的生长、分化和功能产生重大影响.
SAM在生物学上具有多种生理作用,主要用于抗抑郁[2-3]、肝病治疗[4]、关节炎和偏头痛治疗[2],此外还具有食品营养强化剂等功能.SAM功能的多元性和无副作用,决定了其应用的广泛性和长期使用性.1999年美国FDA正式批准上市后,SAM迅速成为畅销的营养保健品之一,年销售额超过十亿美元.它在国际市场和国内市场的需求不断增长.近年来,国外的SAM临床应用已转向对肝脏疾患的治疗.据报道,SAM 不仅利于各种急、慢性肝病的治疗,而且对实验性动物早期肝癌也具有预防作用,有望成为肝病治疗的理想药物.我国是肝病大国,肝病患者众多,目前国内销售的SAM粉针剂(思美泰?)是主要的护肝产品之一,长期依赖进口,价格昂贵,临床使用受到很大的限制.因此,对SAM 的生产工艺研究是国内当前急需解决的问题.
SAM可由化学合成、体外酶促合成或微生物发酵三种途径制得.发酵法是通过在培养基中加入前体L-蛋氨酸来合成,是目前工业规模生产SAM的主要方法[1].酿酒酵母为最常用的发酵菌种,具有较高的过量积累SAM的能力.刘慧等用啤酒废酵母联产SAM和谷胱甘肽(GSH),含量分别为45 g/g(DCW)和 18 g/g(DCW),生物量为 35 g/L[5].王远山等从土壤中筛选得到酵母发酵菌株,通过对培养基和发酵条件的优化,SAM产量从861 mg/L[6]提高到1946 mg/L[7].刘沛溢等采用发酵过程中流加L-蛋氨酸,SAM积累量最高达4.98 g/L[9].王杰硼等报道了利用酿酒酵母在5 L发酵罐中加入50 g前体L-蛋氨酸,发酵65.7 h,SAM 产量达到17.1 g/L[10].在发酵法生产SAM过程中,通常采用L-蛋氨酸为前体进行发酵转化,蛋氨酸的转化率仅15%左右.目前市场上L-蛋氨酸价格为168元/kg,L-蛋氨酸的高价格和低转化率,使L-蛋氨酸原料成为发酵法生产SAM的主要成本,限制了微生物发酵法规模化制备SAM的实际应用.为此,笔者在10 L发酵罐中考察了补加不同类型的蛋氨酸前体对微生物发酵积累SAM 的影响,发现以DL-蛋氨酸替代L-蛋氨酸作为前体时,SAM积累量可提高至5.28 g/L,并且可大幅度降低发酵成本,为工业化生产SAM提供了新思路.
1 材料与方法
1.1 菌 种
酿酒酵母SAM-J5E-4,由浙江普洛家园药业有限公司提供.
1.2 培养基
斜面培养基:麦芽汁 10 g/L,酵母膏 3 g/L,蛋白胨5 g/L,葡萄糖10 g/L,琼脂20 g/L.
种子培养基:组成同斜面培养基,采用自来水配制.
发酵培养基:葡萄糖10 g/L,酵母膏 3 g/L,(NH4)2SO45 g/L,K2HPO410 g/L,硫酸锰 0.1 g/L,硫酸锌0.1g/L,MgCl20.2 g/L,CaCl20.1 g/L,柠檬酸钠1 g/L.
流加料液组成:含葡萄糖和酵母抽提物,m(葡萄糖)∶m(酵母提取物)=20∶1,两者分开灭菌,使用前混合.
1.3 培养条件及转化条件
斜面培养:28℃培养2~3 d,4℃冰箱保存.
种子培养:从新鲜斜面接种一环于100 mL种子培养基中,置旋转式摇床,28℃,180 r/min培养24 h.
发酵罐流加培养及转化条件:以3%~5%的接种量接种到10 L发酵罐中,控制温度为28℃,通气量为1.0 L/(L·min),搅拌转速开始设定为300 r/min,待溶氧降低时逐渐增加,转速最高达到700 r/min.发酵培养约8 h,培养基中葡萄糖消耗完毕时,开始流加葡萄糖和酵母抽提物直至发酵结束.当发酵液细胞干重>80 g/L时,开始流加蛋氨酸前体,进行SAM的合成转化,转化过程大约持续21 h.
1.4 分析方法
细胞干重(Dry Cell Weight,DCW)测定:取一定体积的发酵液,经4 000 r/min离心10 min后收集菌体,用去离子水洗涤2次后,105℃烘2 h称重,计算出细胞的质量浓度.
葡萄糖浓度的测定:用酶膜法(生物传感分析仪SBA-40C,山东省农科院).
SAM的定量分析:取5 mL发酵液于4 000 r/min离心10 min,收集菌体,蒸馏水洗涤后离心,收集的菌体再用1.5 M的高氯酸定容至总体积10 mL,室温破碎1.5 h,4 000 r/min离心10 min,收集上清液,经适当稀释后采用HPLC定量分析.HPLC条件 :Agillent C18柱(250 mm ×4.6 mm,5 μ m);流动相:0.01 mol/L的甲酸铵,用甲酸调pH值至3.0;流速为1.0 mL/min;检测波长:256 nm;柱温:25 ℃;进样量:10 μL.以标准品(自制的SAM 对甲苯磺酸硫酸双盐)峰面积与浓度关系绘制标准曲线,将256 nm处的样品峰面积代入标准曲线换算得到SAM含量.
1.5 发酵罐培养
10 L全自动发酵罐(镇江东方)中装4 L料液,接种量体积分数为10%,前8 h控制搅拌转速为300 r/min,通气量为6 L/min,如果溶氧<20%,则调整搅拌转速和通气量,直至搅拌转速为700 r/min,通气量为15 L/min,温度控制在28℃,自动补加氨水控制pH值在5左右,外接乙醇在线测定仪(华东理工大学,上海).当发酵培养基中葡萄糖质量浓度低于1 g/L时,开始流加葡萄糖和酵母抽提物.当发酵液DCW>80 g/L时,开始流加蛋氨酸前体,进行SAM的合成转化,蛋氨酸流加时间持续5 h,转化过程大约持续21 h,发酵液降温至15℃以下,结束发酵.实验过程中定时取样,所有结果均为3个样的平均值.
2 结果与讨论
2.1 不补加前体蛋氨酸的发酵结果
图1,2为不补加前体蛋氨酸时SAM的发酵过程曲线.由于SAM的合成是一个高能耗的过程,每生成一分子的SAM需要消耗36分子ATP,仅靠葡萄糖消耗产生的ATP能量无法实现高密度积累SAM.结果表明,在未补加前体蛋氨酸的条件下,SAM的积累量增长很慢,最高为0.38 g/L,生物量最高为128 g/L,在发酵结束前,容易积累较高浓度的乙醇.
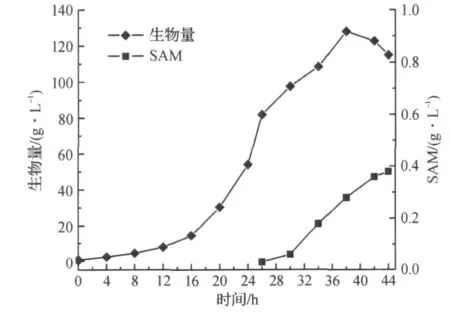
图1 未补加前体蛋氨酸的细胞生长和SAM发酵结果Fig.1 Cell growth and SAM production without feeding methionine
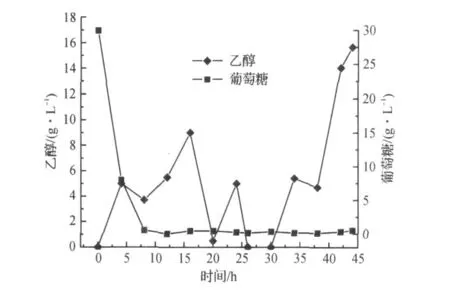
图2 未补加前体蛋氨酸的发酵过程中葡萄糖和乙醇质量浓度变化曲线Fig.2 Glucose and ethanol concentration curves without feeding methionine
2.2 补加前体L-蛋氨酸的发酵结果
在生物量达到80 g/L时,开始流加L-蛋氨酸前体,流加速率为2 g/(L·h),共流加 5 h,所得发酵结果见图3,4.
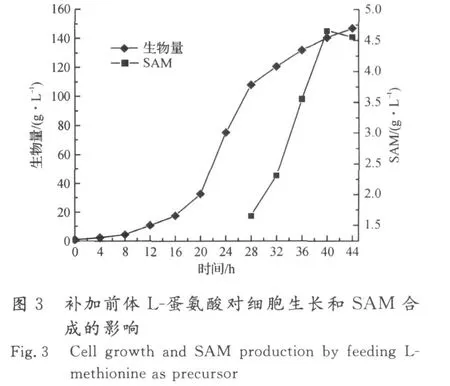
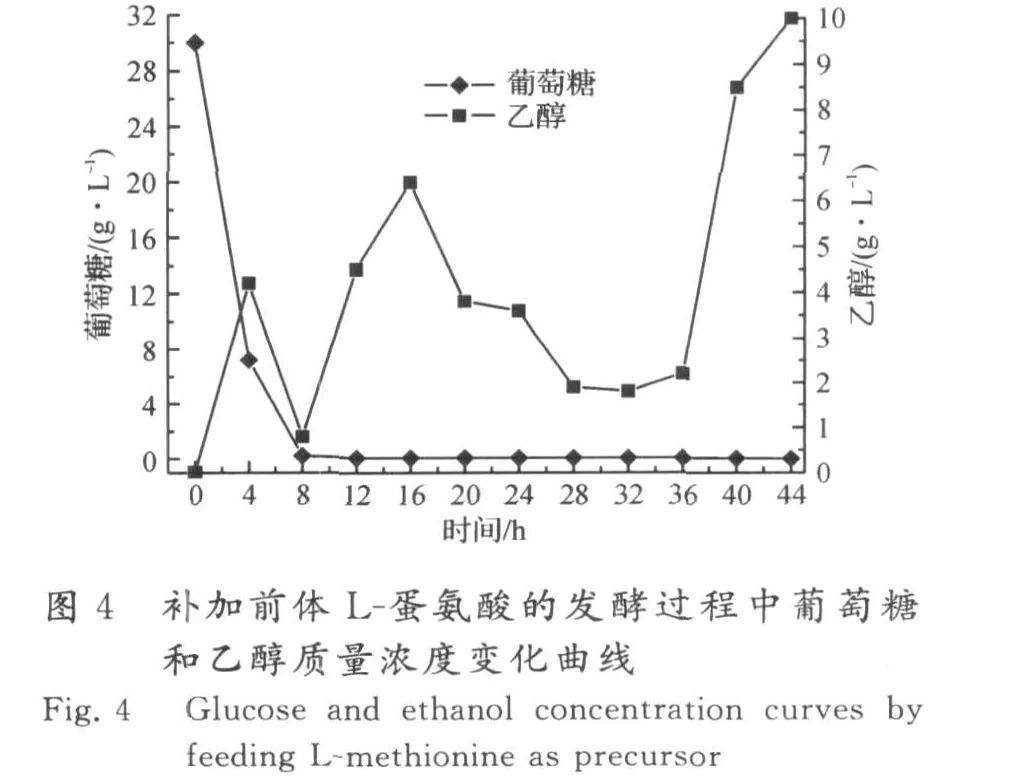
由于合成一分子的SAM,需要消耗一分子的蛋氨酸和一分子的AT P,加入前体蛋氨酸,可减少合成蛋氨酸所需的能量,利于SAM 的高密度积累.在补加前体L-蛋氨酸后,SAM快速积累,在开始流加16 h后,SAM 积累量达到最高值,为4.66 g/L,蛋氨酸转化率为17.45%.在生物量达到80 g/L后流加L-蛋氨酸,可使生物量继续增加,最高达到147 g/L,说明采用流加方式补加L-蛋氨酸,并没有对酵母细胞的生长产生明显的抑制作用.
2.3 补加前体D-蛋氨酸的发酵结果
图5,6为在生物量达到80 g/L时,流加D-蛋氨酸前体的发酵结果,流加速率为2 g/(L·h),共流加5 h.酿酒酵母的SAM合成酶不能直接利用D-蛋氨酸.D-蛋氨酸被酵母细胞吸收后,在胞内消旋酶的作用下,部分D-蛋氨酸可被转化成L-蛋氨酸,为SAM 合成提供前体.发酵结果表明,流加前体D-蛋氨酸,SAM 的积累量最高为1.53 g/L,仅为流加L-蛋氨酸前体时SAM积累量的1/3,蛋氨酸转化率为5.73%.而生物量最高达到124 g/L,表明通过流加方式补加D-蛋氨酸对酵母细胞生长的抑制作用并不明显.
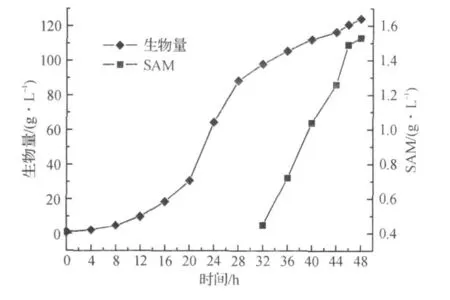
图5 补加前体D-蛋氨酸对细胞生长和SAM合成的影响Fig.5 Cell growth and SAM production by feeding D-methionine as precursor
2.4 补加前体DL-蛋氨酸的发酵结果
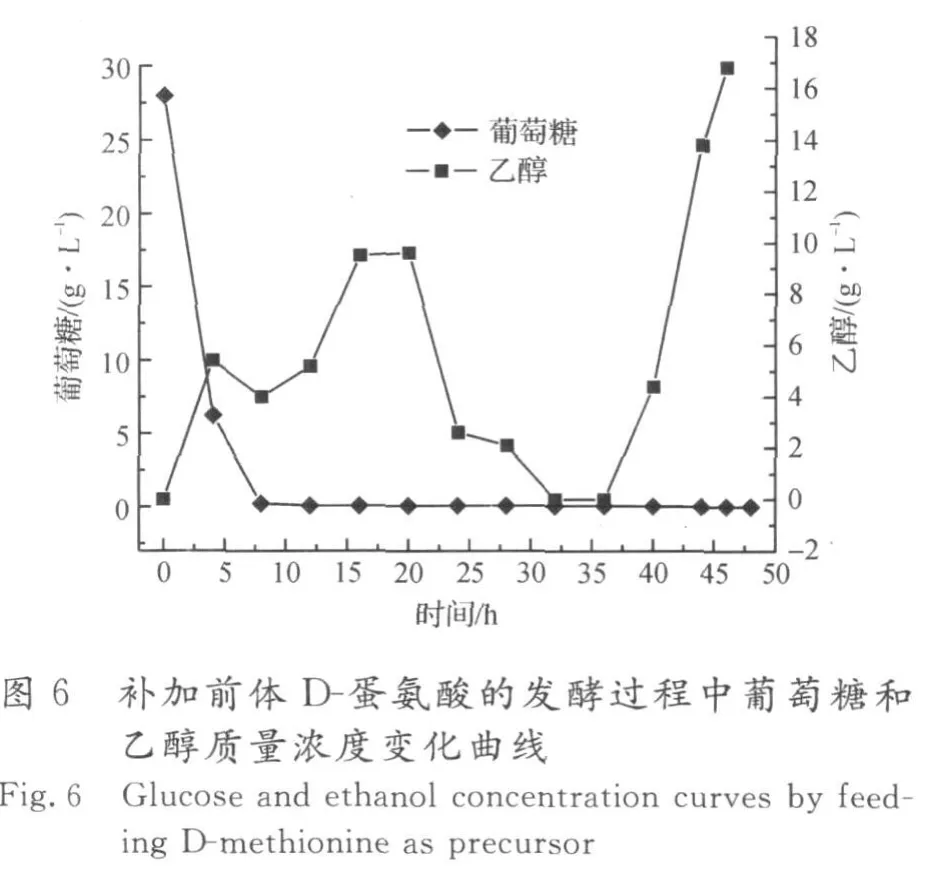
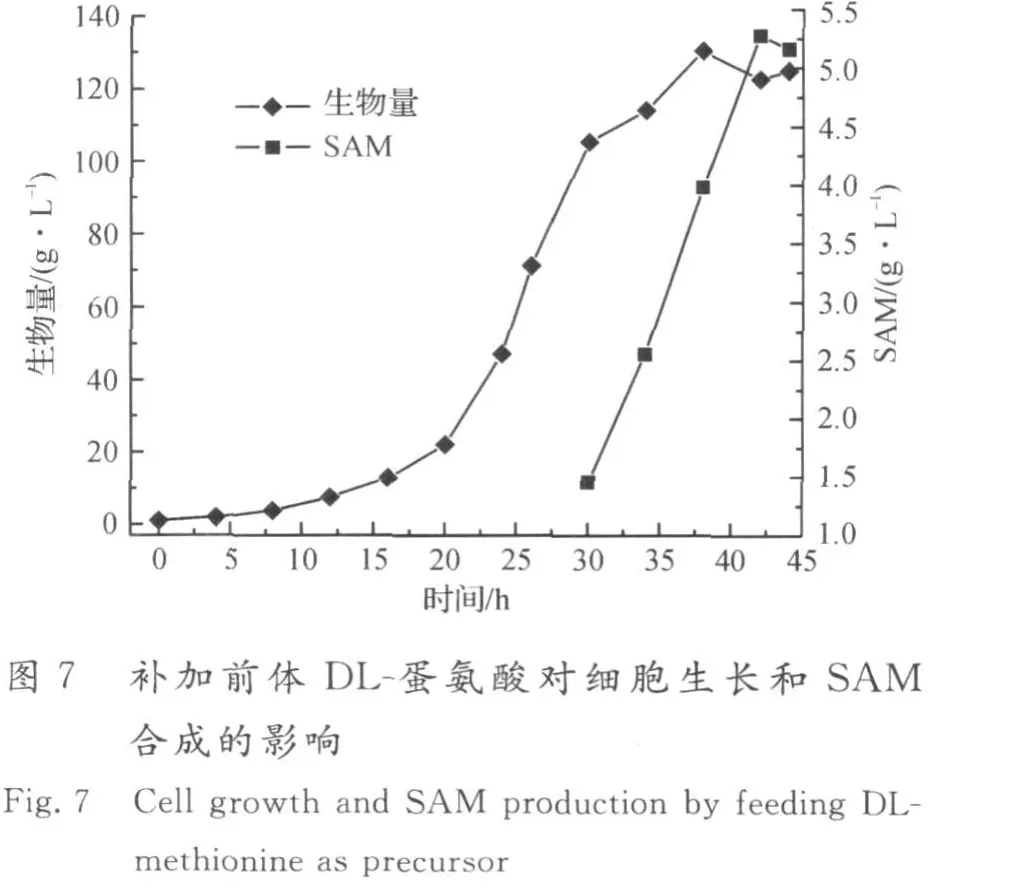
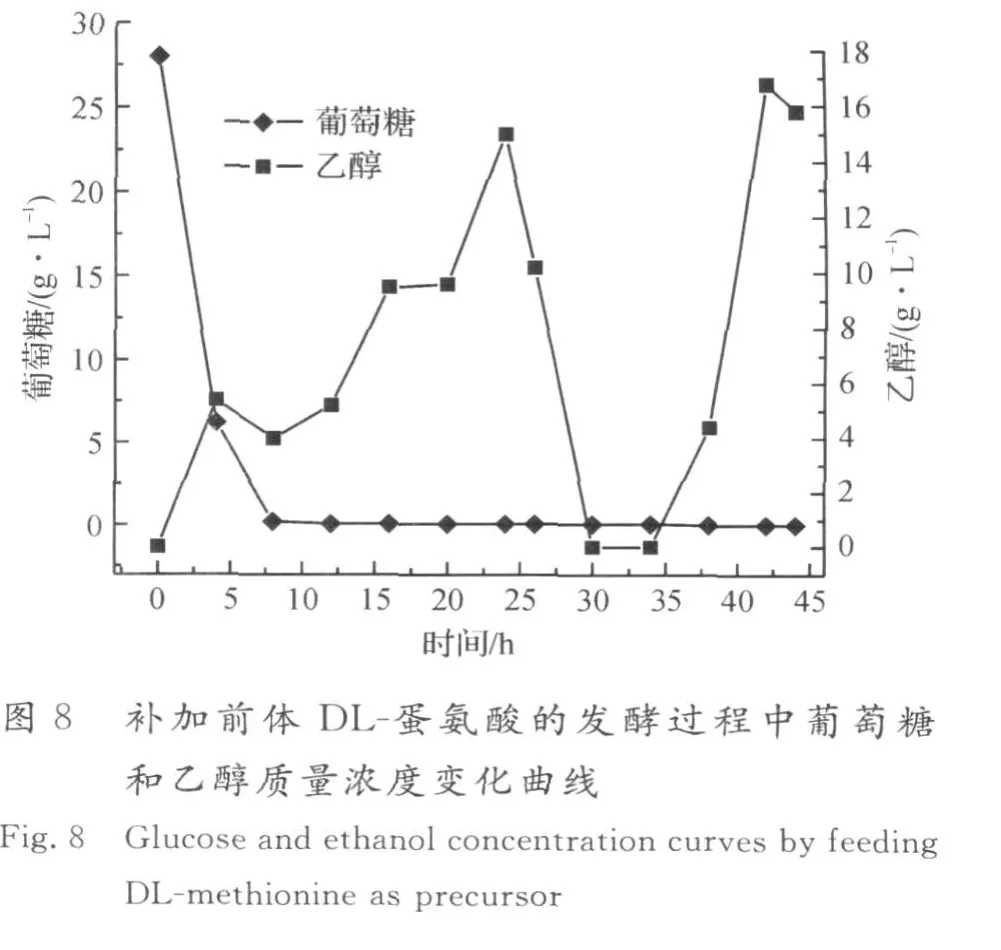
图7,8为在生物量达到80 g/L时流加DL-蛋氨酸前体的发酵结果,补加速率为4 g/(L·h),共流加5 h.在补加2倍量的DL-蛋氨酸前体条件下,酿酒酵母先利用L-蛋氨酸前体合成SAM,同时D-蛋氨酸在酵母细胞内消旋酶的作用下转化为L-蛋氨酸,有效补充了合成SAM的前体,从而更利于SAM的积累,SAM的积累量最高为5.28 g/L,蛋氨酸的转化率为9.88%.在该前体流加策略下,生物量最高达131 g/L,表明流加2倍量的DL-蛋氨酸对酵母细胞的生长无影响.
3 结 论
笔者分别以L-蛋氨酸、D-蛋氨酸和DL-蛋氨酸作为发酵前体,考察了补加不同类型的蛋氨酸前体对细胞生长和SAM积累的影响.当发酵过程中以2 g/(L·h)的速率流加D-蛋氨酸前体时,SAM 的积累量为1.53 g/L,生物量达124 g/L;以相同速率流加前体L-蛋氨酸时,SAM的积累量达4.68 g/L,生物量为146 g/L.相比较而言,采用4 g/(L·h)的速率流加DL-蛋氨酸前体时,SAM的积累量最高,可达5.28 g/L,生物量为128 g/L,发酵结果比较理想.此外,目前市场上DL-蛋氨酸价格约为 L-蛋氨酸价格的1/4左右,因而,以DL-蛋氨酸作为发酵前体生产SAM,不仅可提高SAM 发酵水平,同时使发酵成本大幅度降低,具有很好的实际应用前景.
[1] SCHLENK F,ZYDEK C R,EHNINGER D J,et al.The production of S-adenosyl-L-methionine and S-adenosyl-L-ethionine by yeast[J].Enzymologia,1965,29(3):283-298.
[2] L U S C.Review article:S-adenosylmethionine[J].Inter J Biochem cell Bio,2000,32:391-395.
[3] CHARLES S L.Role of S-adenosy l-L-methionine in the treatment of liver diseases[J].J Hepatology,1999,30(6):1155-1159.
[4] GOBBI J,JANIRI L,CIANCONI P,et al.Antidepressant activity of S-adenosyl-L-methionine(SAMe):effects on neural responses excitato ry amino acids[J].Biological Psy chiatry,1997,42(1):68.
[5] 刘惠,林建平,吴坚平,等.酿酒酵母生物转化蛋氨酸生产S-腺苷-L-蛋氨酸[J].化学反应工程与工艺,2002,18(4):310-314.
[6] 王远山,陈小龙,胡忠策,等.产腺苷蛋氨酸微生物菌种的筛选[C]//第十届全国生物化工学术会议论文集.杭州:中国化工学会,2002:174-176.
[7] 陈小龙,王远山,郑裕国,等.腺苷蛋氨酸发酵条件及发酵培养基的优化[J].中国生物工程杂志,2004,24(11):65-69.
[8] 刘沛溢,董函竹,谭天伟,等.补加前体L-蛋氨酸对高密度发酵生产S-腺苷-L-蛋氨酸的影响[J].生物工程学报,2006,22(2):268-272.
[9] 王杰鹏,韩晋军,李晓楠,等.S-腺苷-L-蛋氨酸高密度发酵工艺优化[J].生物工程学报,2009,25(4):533-536.

