毛竹光合生理对气候变化的短期响应模拟
张利阳, 温国胜,2, 张汝民,2, 王电杰, 张 俊
(1.浙江农林大学 林业与生物技术学院,浙江 临安 311300;2.浙江农林大学 浙江省森林生态系统碳循环与固碳减排重点实验室,浙江 临安 311300)
以二氧化碳为主的温室气体排放增加导致全球变暖已成为一个不争的事实[1]。大气中二氧化碳浓度的不断增加,不仅直接影响植物光合作用过程和生长发育,而且通过温室效应引起全球气候变化对植物产生间接影响[2]。因此,研究在全球气候变化下植物的响应,尤其是对二氧化碳的响应已成为当前植物生理生态学的研究热点[3-5]。据报道,短期二氧化碳浓度升高在一定程度上能够促进植物的光合作用,减少水分蒸腾,提高水分利用效率[3,6],而植物长期适应高浓度二氧化碳之后,光合作用恢复到原来水平甚至更低[2]。大气二氧化碳浓度升高不仅直接影响植物的光合作用过程和生长发育,并且通过温室效应引起全球气候变化,如温度升高和气候干燥等[6],间接影响植物生长。植物的光合速率对温度的响应研究表明,光合速率随温度的变化一般为单峰曲线,符合二次函数[7]。植物对大气相对湿度响应的研究还少见报道。毛竹Phyllostachys pubescens是中国分布面积最大,范围最广,开发利用程度最高,对竹产区地方经济、竹农收入影响最为深远的集经济、生态、社会效益于一体的竹种之一[8]。以建群种构成的森林是中国亚热带地区独具特色的主要植被类型之一,在森林固碳中发挥着重要作用[9]。本研究模拟在二氧化碳摩尔分数、温度、大气湿度突然变化条件下,测定毛竹的光合生理特性变化与光响应特征的短期响应,为全球气候变化背景下毛竹的适应性和固碳增汇提供一定的科学依据。
1 材料与方法
1.1 试验地概况
试验地位于浙江省杭州市西郊青山湖畔岳山。青山湖气候温暖湿润,光照充足,雨水丰沛,四季分明,属中亚热带季风气候。一年四季中春秋季短,夏冬季长,季节特征明显。年平均气温为15.9℃,极端最高气温41.2℃,最低气温达-13.1℃,全年降水量1427.0mm。
2009年11月13-15日在试验地里选取3年生生长状况良好的毛竹,株高10 m左右,搭建试验观测塔进行测定。
1.2 试验方法
1.2.1 毛竹净光合速率对大气二氧化碳摩尔分数的响应 通过Li-6400光合测定仪的二氧化碳控制系统,设定光合有效辐射为800μmol·m-2·s-1,根据当天的外界环境温度,将样本室温度控制在22℃,二氧化碳摩尔分数的梯度设置为:50,100,300,600,1000,1500μmol·mol-1,适应10 min后进行连续测定。
1.2.2 不同条件下毛竹的光响应 ①通过Li-6400光合测定仪的内置光源控制系统,设定光照强度梯度为: 1500, 1000, 600, 300, 100, 50, 30, 10, 0μmol·m-2·s-1, 进行光响应曲线测定。 ②样本室温度控制在22℃,二氧化碳摩尔分数为400,800μmol·mol-1的条件下,测定二氧化碳摩尔分倍增下毛竹的光响应曲线;③二氧化碳摩尔分数为400μmol·mol-1,样本室温度控制在17,20,23℃的条件下(外界气温为20℃左右),测定不同温度梯度下毛竹的光响应曲线;④样本室温度控制在22℃,二氧化碳摩尔分数为400μmol·mol-1,水分吸收管在 “去除”和 “通过”的状态下,测定大气湿度在64.04%和0.40%下毛竹的光响应曲线。
1.3 数据分析
利用SPSS 13.0软件,绘制出Pn—Ci曲线并用指数方程[10]进行拟合。拟合方程为:

当Pn=0时,Ci的值为二氧化碳补偿点,曲线初期的斜率为羧化速率。
绘制出Pn—PAR曲线并用非直角双曲线模型[11]进行拟合,拟合方程为:
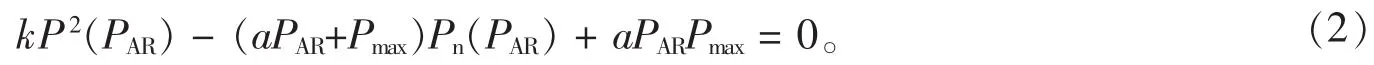
当 θ≠ 0 时, 解式(2), 并注意 Pn(PAR)=P(PAR) -Rd,得:

式(1~3)中 Pn为净光合速率(μmol·m-2·s-1), Pnmax为光饱和时的最大净光合作用速率(μmol·m-2·s-1), CE为羧化效率, Ci为胞间二氧化碳摩尔分数(μmol·mol-1), PAR为光合有效辐射(μmol·m-2·s-1), Rd为暗呼吸(μmol·m-2·s-1), a 为初始量子效率, k 为曲线凸度。
其他参数的计算均取自光照强度为600μmol·m-2·s-1时的值计算所得。公式如下:羧化效率CE=Pn/Ci, 光能利用率 LUE=Pn/PAR, 水分利用率 WUE=Pn/Tr, 光呼吸作用[12]Rp=CELCP。
2 结果与分析
2.1 毛竹光合作用对二氧化碳短期升高的响应模拟
2.1.1 毛竹净光合速率对二氧化碳摩尔分数的响应 由图1可以看出:毛竹叶片净光合速率(Pn)对二氧化碳摩尔分数的响应基本呈指数变化,近似符合米氏方程,拟合结果如图1。同其他C3植物一样[3,6],大气中二氧化碳摩尔分数(Ca)的增加,叶片胞间二氧化碳摩尔分数(Ci)升高,Pn升高。且随Ci逐渐增大, Pn升高幅度逐渐减小, 最大净光合速率(Pmax)为 12.95μmol·m-2·s-1, 二氧化碳补偿点为 119.23μmol·m-2·s-1,二氧化碳饱和点约为1200μmol·m-2·s-1。可见,由于大气与植物二氧化碳的源—汇关系,二氧化碳摩尔分数的短期增高对毛竹的Pn有促进作用,且在短期内,随着二氧化碳摩尔分数的继续增加,毛竹的净光合作用受到一定的抑制效应,但抑制程度较弱。随着二氧化碳摩尔分数的增高,毛竹的气孔导度(Gs)也表现出其他植物[13]那样的波动规律,但其数值和波动幅度均很小,约为0.0193~0.0312 mol·m-2·s-1。蒸腾速率(Tr)也随Gs的变化而产生波动,变化范围也较小,对高二氧化碳摩尔分数的敏感性不强。
2.1.2 在二氧化碳摩尔分数倍增下毛竹光合水分生理指标的响应
二氧化碳摩尔分数为400μmol·mol-1时光响应拟合曲线为:

在二氧化碳摩尔分数倍增的情况下(图2和表1),毛竹的最大净光合速率(Pmax)有较大幅度的增高,为原来的2.3倍。而暗呼吸作用(Rd)和光呼吸作用(Rp)均有很大幅度的降低,且两者降低的幅度几乎相同。同其他研究结果相同[3],毛竹的光饱和点(LSP)随着二氧化碳摩尔分数的升高而增大,但光补偿点(LCP)却有所减小。二氧化碳摩尔分数倍增下的毛竹光合量子效率(AQY)和最大净光合速率的增幅变化趋势相同,但相比最大净光合速率的增幅要小得多。光能利用效率(LUE)增加的幅度却远远大于最大净光合速率。毛竹的气孔导度(Gs)也有所增加,但相对增加并不明显。毛竹的蒸腾速率(Tr)在二氧化碳摩尔分数倍增后有一定程度的减弱。所以,在二氧化碳摩尔分数倍增后,由于毛竹的净光合速率提高,蒸腾速率下降,水分利用率(WUE)较正常大气二氧化碳摩尔分数下的有较大幅度的增加。
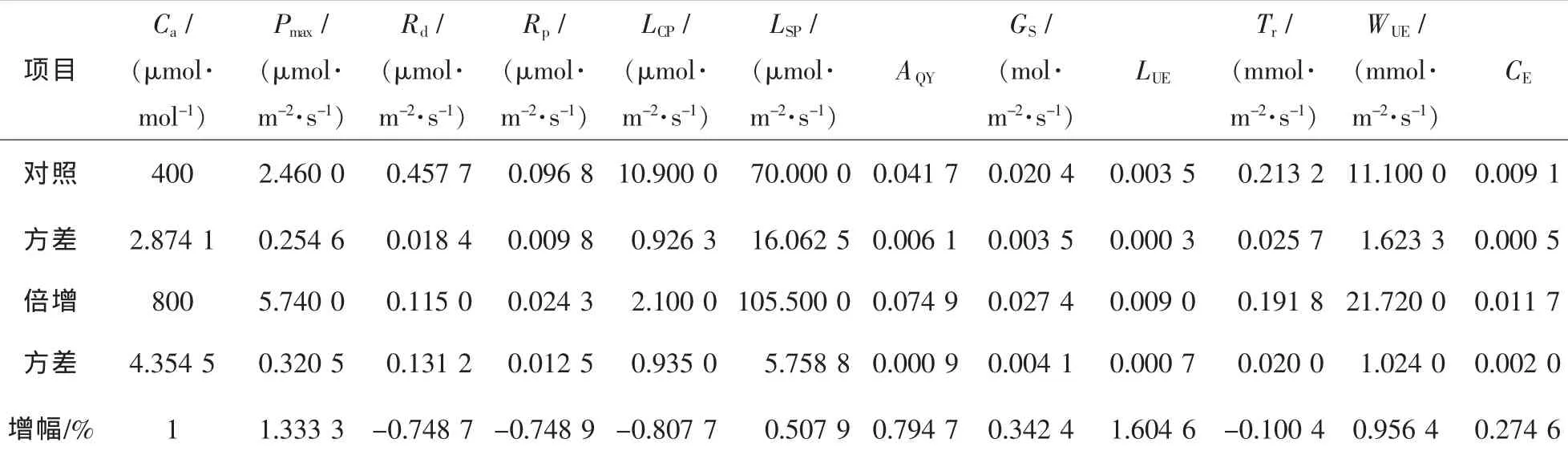
表1 二氧化碳摩尔分数倍增下的光合水分生理指标比较Table1 Photosynthetic characteristic parameters for light response curve to the increase of CO2concentration
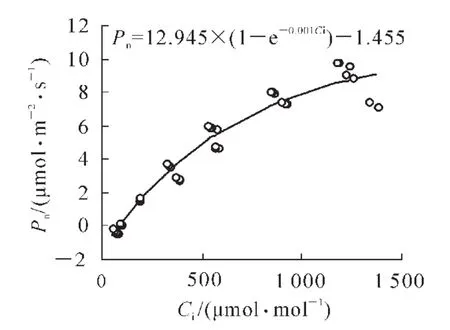
图1 叶片净光合速率对二氧化碳摩尔分数升高的响应Figure1 Photo synthetic responses to the increase of CO2concen tration

图2 二氧化碳摩尔分数倍增下毛竹的光响应曲线Figure2 Photo synthetic response to light under doubled CO2concentration
2.2 毛竹光合作用对温度短期变化的响应模拟
17℃时的光响应拟合曲线为:

大部分植物的温度响应显示出以最适温度为最高点的抛物线关系[14]。随着温度的突然增加或降低3℃,毛竹的净光合速率(Pn)均显示出下降的规律(表2和图3)。温度降低时,气孔导度(Gs)增加,但Pn和蒸腾速率(Tr)减小,由于Tr降低的幅度比Pn高,所以水分利用率(WUE)增加,表观光量子效率(AQY),光能利用率(LUE),羧化效率(CE)均呈现下降趋势;温度突然升高,气孔导度(Gs)显著上升,Tr显著增大,Pn下降幅度较小,WUE减小,AQY,LUE,CE均有不同程度的增加,呼吸作用(R)也增加了近1倍。叶片胞间二氧化碳摩尔分数的变化极不稳定。温度增加或降低相同数值,但光合水分指标增加或降低的波动呈现不对称,可能是由于气孔开—闭的滞后效应机制[15]造成的。

表2 温度变化下的光合水分生理指标比较Table2 Photosynthetic characteristic parameters for light response curve to the increase of temperature
2.3 毛竹光合水分生理指标对大气湿度短期变化的响应模拟
对照的光响应拟合曲线为:

在大气湿度突然从64.04%降低到0.40%的情况下(图4和表3),毛竹的最大净光合速率(Pmax)增加了0.40倍。毛竹的羧化效率(CE)与Pmax同步增加,但光合量子效率(AQY)的变化差异不明显。而暗呼吸作用(Rd)和光呼吸作用(Rp)却有不同幅度的降低,其中Rd降低的幅度较小。毛竹的光饱和点(LSP)降低了,但光补偿点(LCP)却有所增加。光能利用效率(LUE)增加的幅度大于Pmax。这些变化主要是由于毛竹的气孔导度(Gs)的突然增加造成的,增加幅度约为2.4倍。随着Gs的增加,毛竹的蒸腾速率(Tr)呈现更大幅度的增加,为7倍之多。
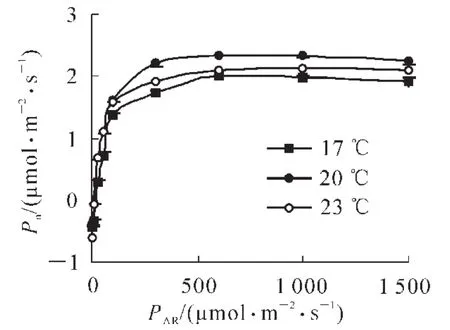
图3 不同温度下毛竹的光响应曲线Figure3 Photosynthetic responses to light under different temperatures

图4 不同大气湿度下毛竹的光响应曲线Figure4 Photosynthetic responses to light under different air humidity
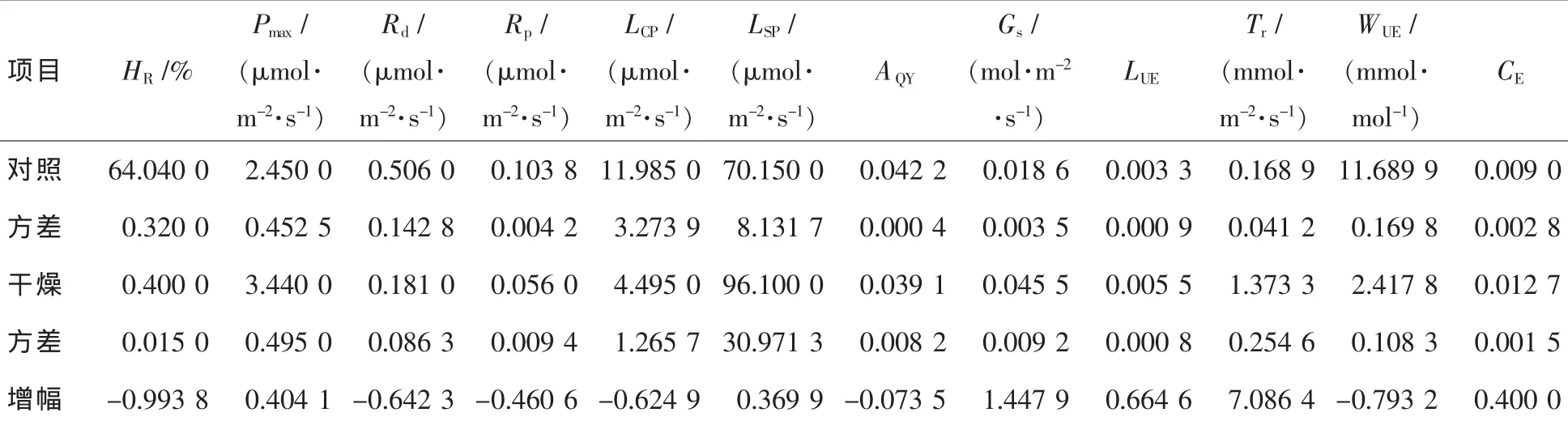
表3 湿度变化下的光合水分生理指标比较Table3 Photosynthetic characteristic parameters for light response curve to the decrease of relative humidity
3 讨论
同其他植物的许多研究结果相同[3,5-6],毛竹叶片净光合速率对二氧化碳摩尔分数的响应符合米氏方程。随着二氧化碳摩尔分数的升高,净光合速率不断增加,这不仅是由于反应物增加导致净光合速率增加,同时二氧化碳摩尔分数的倍增还刺激气孔导度增加34%(表1),使二氧化碳进入气孔中的量更大;而且,由于二氧化碳摩尔分数的升高,还对水溢出和氧气进入产生气孔阻力,从而引起蒸腾速率和呼吸速率降低,水分利用率和光能利用率增加;二氧化碳摩尔分数不再是限制因子使光饱和点也增大。然而,当二氧化碳摩尔分数到达一定数值时,光合作用不再上升甚至出现下降,其产生机制一般认为是2个方面因素,一是认为长期高二氧化碳摩尔分数下,叶片1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)含量及活性比降低[17];二是认为随着二氧化碳摩尔分数的增加,光合速率的提高使光合产物的合成超过运输和利用能力时,源—库关系发生变化,造成光合产物的反馈抑制[18]。毛竹净光合速率随着大气二氧化碳摩尔分数逐渐增大,但其斜率较小,即羧化速率较其他亚热带常见树种如木荷Schima superba和马尾松Pinus massoniana低[19]。羧化能力低主要是由于活化了的Rubisco的数量少,所以,在二氧化碳摩尔分数约为1200μmol·mol-1时,增加幅度略微减小,可能是受植物转移碳水化合物能力的抑制效应造成的。
随着二氧化碳摩尔分数的升高,其带来的 “温室效应”使叶面温度升高,大气相对湿度降低。据前人研究,温度突然下降引起植物净光合速率降低,是由无机磷的再生造成的,而不是由气孔调节所导致[20]。本研究中,由于毛竹的气孔导度略微增加,证实了非气孔调节导致,但我们推测还可能与酶活降低,酶促反应速率(主要是与暗反应有关的反应)受到影响也有一定的关系;温度突然上升的情况下,毛竹气孔导度增加,但光合作用却有所下降。有证据表明,热胁迫下,活化的Rubisco减少,Rubisco活化酶限制叶片光合潜力的发挥[21]。但由于气温增加3℃,23℃的温度并未造成热胁迫,而且时间短暂,因此推测可能由于二氧化碳的溶解度小于氧气,导致Rubisco的加氧反应大于羧化反应,而使净光合速率下降。处于亚热带的毛竹对温度的敏感性较差,几乎没有相应的适应机制。温度的突然升高或降低都会引起毛竹的气孔导度增加,净光合速率下降。由于毛竹叶片没有出现抗旱植物[5]所表现出的被动脱水关闭气孔调节机制,随着大气湿度的急剧下降,毛竹的气孔导度显著增加,蒸腾速率与气孔导度呈显著正相关,净光合作用暂时增加,但由于蒸腾速率的急速增加,不久会导致细胞缺水,从而影响光合作用的正常进行。
可以确定大气中二氧化碳摩尔分数升高会导致大气温度升高,而对于大气降水的模拟结果,不同的气候模式得出的结论有较大的差异,且具有明显的区域性。温度升高和大气辐射的增强必将导致土壤蒸发和植物蒸腾作用的加强,从而导致干旱化趋势的加剧。随着大气二氧化碳摩尔分数的升高,毛竹的净光合作用可能会在一定时期内上升,但若随着大气二氧化碳摩尔分数的升高,形成高温、干燥的气候,毛竹的气孔灵敏度和Rubisco的活性将可能成为毛竹光合作用甚至是正常生长的限制性因子。高温、干旱使毛竹的蒸腾速率过大,导致细胞缺水萎蔫,影响细胞正常的生理生化性质。在本研究中,光饱和点和光补偿点的变化规律性也不是特别明显,可能与拟合模型的偏差有关。
因此,对于全球变化来说,虽然二氧化碳摩尔分数的升高有利于毛竹光合作用速率的提高,但温度的增加导致了水分损耗增加。然而生活在亚热带湿润条件下的毛竹,并不具有对干旱的适应性调节机制。因此,对毛竹甚至是所有生活在亚热带地区的植物光合作用的影响可能是不利的,至少不会像曾经估计的那么显著。总之,全球变化下大气二氧化碳摩尔分数的升高伴随着温度的升高以及降水的不均衡性,会使二氧化碳摩尔分数的变化对植物光合水分生理的影响变得复杂和不确定,对整个生态系统的影响更是巨大且无法预料的。不论是直接减少由人类生产、生活所引起的二氧化碳过度排放,还是利用改善森林碳汇功能,植树造林等的间接减排方式都是势在必行的。
[1]Intergovernmental Panel on Climate Change.Climate Change 2001: The Scientific Basis [M].Cambridge: Cambridge University Press, 2001: 142-145.
[2]GUNDEISON C A, NORBY R J, WULLSCHLEGER S D.Foliar gas exchange responses of two deciduous hardwoods during 3 years of growth in elevated CO2: no loss of photosynthetic enhancement[J].Plant Cell Environ, 1993, 16 (7):797-807.
[3]MORSE S R, BAZZAZELEVATED F A.CO2and temperature alter recruitment and size hierarchies in C3and C4annuals [J].Ecology, 1994, 75: 966-975.
[4]蒋高明,韩兴国.大气CO2浓度升高对植物的直接影响——国外10余年来模拟实验研究之主要手段及基本结论[J].植物生态学报, 1997, 21 (6): 489-502.JIANG Gaoming, HAN Xingguo.Response of plant growth to elevated CO2: a review on the chief methods and basic conclusions based on experiments in the external countries in past decade [J].Chin J Plant Ecol, 1997, 21 (6): 489-502.
[5]杨金艳,杨万勤,王开运,等.木本植物对CO2浓度和温度升高的相互作用的响应[J].植物生态学报,2003,27(3): 304-310.YANG Jinyan, YANG Wanqin, WANG Kaiyun, et al.Woody plants respond to interactions between elevated CO2and increased temperature [J].Chin J Plant Ecol, 2003, 27 (3): 304-310.
[6]CURE J D, ACOCK B.Crop response to carbon dioxide doubling: a literature survey [J].Agric For Meteorol, 1996, 38:127-145.
[7]刘玉梅,王云诚,于贤昌,等.黄瓜单叶净光合速率对二氧化碳浓度、温度和光照强度响应模型 [J].应用生态学报, 2007, 18 (4): 883-887.LIU Yumei, WANG Yuncheng, YU Xianchang, et al.Mathematic models of cucumber net photosynthesis rate responding to CO2concentration, temperature, and illumination intensity [J].Chin J Appl Ecol, 2007, 18 (4): 883-887.
[8]宋艳冬,金爱武,金晓春,等.施肥对毛竹叶片光合生理的影响[J].浙江林学院学报,2010,27(3):334-339.SONG Yandong, JIN Aiwu, JIN Xiaochun, et al.Physiology of leaf photosynthesis with fertilization in Phyllostachys pubescens [J].J Zhejiang For Coll, 2010, 27 (3): 334-339.
[9]周国模,姜培坤.毛竹林的碳密度和碳贮量及其空间分布[J].林业科学,2004,40(6):20-24.ZHOU Guomo, JIANG Peikun.Density, storage and spatial distribution of carbon in Phyllostachy pubescens forest[J].Sci Silv Sin, 2004, 40 (6): 20-24.
[10]WATLING J R, PRESS M C, QUICK W P.Elevated CO2induces biochemical and ultrastructural changes in leaves of the C4cereal sorghum [J].Plant Physiol, 2000, 123: 1143-1152.
[11]CALNEL M G R, THORNLEY J H M.Temperature and CO2responses of leaf and canopy photosynthesis: aclarification using the non-rectangular hyperbola model of photosynthesis [J].Ann Bot, 1998, 82: 883-892.
[12]蔡时青,许大全.大豆叶片CO2补偿点和光呼吸的关系[J].植物生理学报,2000,26(6):545-550.CAI Shiqing,XU Daquan.Relationship between the CO2compensation point and photorespiration in soybean leaves[J].J Plant Physiol, 2000, 26 (6): 545-550.
[13]王静,冯永忠,杨改河,等.小麦光合特性对二氧化碳浓度升高的响应[J].干旱地区农业研究,2009,27 (3):179-183.WANG Jing, FENG Yongzhong, YANG Gaihe, et al.Responses of wheat photosynthetic characteristics to the increase of CO2concentration [J].Agric Res Arid Area, 2009, 27 (3): 179-183.
[14]项文化,田大伦,闫文德.白栎光合特性对二氧化碳浓度增加和温度升高的响应[J].浙江林学院学报,2004,21(3): 247-253.XIANG Wenhua, TIAN Dalun, YAN Wende.Photo synthetic responses of Quercus fabri leaves to increase in CO2concentration and temperature [J].J Zhejiang For Coll, 2004, 21 (3): 247-253.
[15]JONES H G.Plants and Microdimate [M].2nd.New York: Cambridge University Press, 1992.
[16]蒋跃林,张庆国,杨书运,等.28种园林植物对大气CO2浓度增加的生理生态反应[J].植物资源与环境学报,2006, 15 (2): 1-6.JIANG Yuelin, ZHANG Qingguo, YANG Shuyun, et al.Ecophysiological responses of 28 species of garden plants to atmospheric CO2enrichment[J].J Plant Reso Envir, 2006, 15 (2): 1-6.
[17]PEET M M, HUBER S C, PATTERSON D T.Acclimation to high CO2inmonoecious cucumber (Ⅱ)Carbon exchang rates, enzyme activities and starch and nutrient concentration [J].Plant Physiol, 1986, 80: 63-67.
[18]PEET M M, KRAMER P J.Effects of decreasing source/sink ratio in soybeans on photosynthesis, photorespiration,transpiration, and yield [J].Plant Cell Environ, 1980, 3: 201-206.
[19]王秋凤.陆地生态系统水-碳耦合循环的生理生态机制及其模拟研究[D].北京:中国科学院研究生院,2004.WANG Qiufeng.Study on the Eco-physiological Mechanisms and Modeling of the Coupling Cycle of Water and Carbon in Terrestrial Ecosystem [D].Beijing: Graduate University of Chinese Academy of Sciences, 2004.
[20]SAGE R F, REID C D.Photosyntheic response mechanisms to environmetal change in C3plants [G]//WILKINSON R E.Plant-Enviroment Interactons.New York: Marcel Dekkcel, 1994: 413-499.
[21]SHARKEY T D.Some like it hot[J].Science, 2000, 287: 435-436.

