白杨细胞质遗传的细胞学机理(Ⅱ)1)——质体和线粒体在生殖细胞和营养细胞中的分布与变化
崔彬彬 杨妮娜 孙宇涵 徐兆翮
(林木育种国家工程实验室(北京林业大学),北京,100083)
陈 萍
(保定学院)
冯 慧
(北京市园林科学研究所)
李 云
(北京林业大学)
细胞质遗传在植物中是指质体和线粒体的遗传。早在1909年Correns和Baur分别在紫茉莉(Mirabilis jalapa)和马蹄纹天竺葵(Pelargonium zonale)中就发现了质体的母系遗传和双亲遗传现象。此后,很多学者发表了大量的有关被子植物和裸子植物细胞质遗传的研究结果[1-6]。目前,国内外有关杨树细胞质遗传的报道主要以黑杨派(Section Aigeiros)、青杨派为主(Section Tacamahaca),他们只是用单一的方法对杨属进行了部分研究[7-11],对杨树尤其是白杨派(Section Leuce)细胞质遗传方式及其机理并没有很全面、系统的研究。
自2004年起,崔彬彬、李云等[12-14]对白杨派树种及其三倍体杂种细胞质遗传进行了系统的研究。以白杨派毛白杨(Poplus tomentosa)、银白杨(P.alba)、中国山杨(P.davidiana)、响叶杨(P.adenopoda)、新疆杨(P.bolleana)、毛新杨(P.tomentosa×P.bolleana)、银腺杨(P.alba×P.glandulosa)、银毛杨(P.alba×P.tomentosa)8个种及其三倍体杂种为材料,通过不同发育时期花粉细胞学观察、成熟花粉核酸酶检测、PCR-RFLP分子标记技术,围绕质体和线粒体及其DNA在花粉发育过程中的存在状况、变化规律与遗传机理进行了研究。同时,对不同亲本来源的三倍体毛白杨杂种叶绿体性状变异进行了分析,检测是否有细胞质遗传效应发生,取得一定的进展。本研究主要涉及花粉发育中质体和线粒体在生殖细胞和营养细胞的分布与变化,是白杨细胞质遗传的细胞学机理研究工作的报道之二。
近年来,由于试验手段的不断改进,细胞质遗传的检测方法由早期的正反交试验等经典遗传学方法到现代的电子显微镜技术、分子生物学等技术的综合应用[6,11,15-16]。遗传学试验和分子标记技术使人们对植物细胞质遗传方式有了广泛的认识,而细胞学方法能对不同类型细胞质遗传方式的机理做出更确切的解释,使细胞质遗传机理的研究得以迅速深入[16-19]。迄今为止,许多研究者通过细胞超微结构的电镜观察,确定质体和线粒体是否在生殖细胞和精细胞中存在,以及是否经过受精作用传递到合子中。从而对质体和线粒体传递方式及其遗传机理进行细胞学分析[5,20-21]。本研究应用电子显微镜技术,对毛白杨等花粉发育过程中质体和线粒体在生殖细胞和营养细胞的分布与变化进行了观察,旨在揭示白杨派树种细胞质遗传方式和遗传机理,阐明父系细胞器及其DNA丢失的机理,并填补该领域的研究空白。
1 材料与方法
1.1 试验材料
选取白杨派树种:毛白杨5041♂(山东冠县),毛新杨TB13♂(中国农大家属院),银腺杨2号♂(山东冠县),中国山杨8号♂(北京妙峰山);取上述材料不同发育时期的花药、花粉制作普通光镜、透射电镜观察的样品,用醋酸洋红镜检确定花药、花粉发育时期。
1.2 超薄切片的制备与透射电镜观察
为了观察不同时期生殖细胞质体和线粒体的存在状况,取单核花粉、2-细胞早期花粉、成熟期花粉按下列程序制作电镜样品。参考胡适宜[20]、Sodmergen[3]和 Liu[21]的方法,制备样品时,先用醋酸洋红染色确定花药发育时期,然后分别将不同发育时期的花药或花粉粒收集于2.5%戊二醛溶液中(0.1 mol/L二甲胂酸钠缓冲液配制,pH值7.2),室温固定4 h,用不含固定剂的相同缓冲液清洗4次,每次15 min,材料转入1%锇酸室温固定1 h后放入冰箱中4℃过夜。次日弃去固定液,固定的材料经清洗4次和系列酒精脱水后,用还氧丙烷过渡后包埋于Spurr环氧树脂中,包埋后的材料在LKB-V型切片机上用钻石刀切片,将切片用pH值7.4的TBO染色液复染,在Olympus光学显微镜下观察,确定花粉粒内细胞的轮廓,以区分生殖细胞的细胞质与营养细胞的细胞质。然后用铜网收集切片,1%醋酸双氧铀和柠檬酸铅先后染色,清洗后在 JOEL JEM -1010 透射电镜下观察和照相[3,21-22]。
2 结果与分析
2.1 质体和线粒体在生殖细胞和营养细胞中的分布与变化
2.1.1 单核花粉
小孢子单核靠边期,细胞的中央出现了一个很大的液泡,占据了细胞绝大部分的空间,只在细胞的边缘有一薄层细胞质,在液泡边缘的细胞质可以观察到质体和线粒体。凸透镜状的细胞核处于贴壁的位置,超微切片电镜观察显示,细胞质内含丰富的质体和线粒体,一般来说质体较大,呈圆形或椭圆形,基质较浓,线粒体较小,呈圆形,具有内嵴(图1a-b)。
2.1.2 2 -细胞早期花粉
小孢子有丝分裂前,细胞质中的细胞器的分布发生变化,大多移向靠大液泡的一端,质体和线粒体同样表现明显的极性化,它们大多分布在将成为营养细胞的一极(图1c)。当小孢子有丝分裂结束时,产生1个大的营养细胞和1个小的生殖细胞,早期的生殖细胞呈凸透镜形,一面与花粉壁紧贴着,向着营养细胞的另一面壁较厚,在电子显微镜下为透明状(图1d-g)。上述细胞器的极性分布导致了在分裂后形成的营养细胞含有大量的线粒体和质体,而在生殖细胞的细胞质中仅有少量的线粒体,缺少质体(图1d-e)。董源曾在普通光镜下观察到毛白杨第1次有丝分裂时多为不均等分裂,成膜体在生殖细胞和营养细胞之间形成一次弯曲的壁。因此营养细胞比生殖细胞大的多,约占整个细胞体积的3/4~4/5。生殖细胞呈凸透镜形紧靠花粉的一侧[23]。崔彬彬等曾利用DAPI荧光压片在毛新杨、银腺杨花粉发育过程中也观察到了这种不均等分裂[14]。(图1f-g)显示银腺杨贴壁期的生殖细胞表现特殊,细胞质中除了线粒体,还有1~2个质体的分布。
2.1.3 成熟期花粉
随着花粉的发育,营养细胞中液泡变小,在营养细胞中质体转变成造粉质体,含大量淀粉颗粒。这为材料的固定、树脂浸透及超薄切片造成了一定的困难,导致质体和线粒体的切片观察效果不够理想。生殖细胞贴壁后期,向着营养细胞的壁已开始变薄,核占据细胞很大的面积。细胞质中仍有一定数量的线粒体存在,缺少质体。生殖细胞和营养细胞中质体和线粒体的形态结构与分裂前的小孢子中的相似(图1h)。生殖细胞脱离花粉内壁,游离于营养细胞中央,细胞变为球形,细胞壁薄并且与营养细胞质界限不明显(图1i),此时在生殖细胞的一个切面上仍可以观察到线粒体的存在(图1j)。生殖细胞和营养细胞中质体和线粒体存在的状况与贴壁时期没有明显变化,营养细胞质中开始出现大量的脂体(图1k)。关于花粉不同发育时期,营养细胞中质体的变化,胡适宜和罗玉英[22]也曾在玉竹(Polygonatum odoratum)雄配子体发育过程中,发现营养细胞中的质体发生明显的变化:在早期的营养细胞质中,含有丰富的造粉质体;在花粉发育后期,脂体增加而造粉质体消失;接近成熟时花粉富含油滴。
董源在毛白杨花粉超微切片的横切面观察到2层同心圆结构的质体[23]。相同的现象也出现在毛白杨5041的成熟花粉中,在营养细胞的细胞质中,质体的内膜系统发达,组成同心环状结构,而线粒体染色较浅,内嵴发达(图1l-n)。
在成熟花粉中,生殖细胞和营养核均高度伸长,超微结构观察发现,生殖细胞2端的细胞质延伸,细胞呈梭形,细胞质中存在电子透明的小泡和线粒体,该线粒体染色较深,内嵴明显,同样不存在质体(图1o-p)。营养核随着细胞的延长也变为不规则及深的裂瓣,并形成许多凸起,核周围有线粒体和质体分布(图1q-r)。董源在毛白杨[23]、袁宗飞在旋花科植物[2]、牛建功在旱金莲(Tropaeolum majus)[24]中都发现了生殖细胞和营养核的不规则形状。
2.2 细胞质中质体和线粒体与荧光点关系的鉴定
在DAPI染色压片下曾经观察到白杨生殖细胞周围的细胞器荧光点有2类:一类大而较亮,一类小而较暗[14]。为了鉴定这2类荧光点是否分别代表了质体和线粒体的类核荧光,将荧光观察过的切片用Spurr环氧树脂重新包埋,制作电镜观察样品,进行超微结构的观察。对比荧光点,以及超微结构中质体和线粒体在生殖细胞中的分布位置和大小差异,可以判断大而亮的荧光点是质体荧光点,小而暗的荧光点是线粒体荧光点。
3 结论与讨论
应用电子显微镜技术,观察白杨派树种毛白杨、毛新杨、银腺杨、中国山杨花粉发育中质体和线粒体在生殖细胞、营养细胞中的分布与变化。结果表明:质体和线粒体的遗传是相互独立的,具体表现为在小孢子第1次有丝分裂时质体由于极性分布,导致早期的生殖细胞细胞质内已不含质体,为白杨派树种质体母系遗传提供了确切的细胞学证据;而线粒体在花粉发育过程中一直存在。同时,细胞学观察发现银腺杨少数质体被排除的时期相对迟缓。但是,不同发育时期的营养细胞细胞质内含有丰富的质体和线粒体。笔者结合以往的研究工作,对以上结果进行讨论。
Hagemann等[25]以4个属植物为代表提出了在被子植物中父系质体传递的4种方式,除天竺葵属型(Tilney-Bassett type)精细胞含质体并传递至合子,被确定为质体双亲遗传外,其余的番茄属型(Lycopersion type)、茄属型(Solanum type)和小麦属型(Triticum type)3种类型质体在雄性细胞的发育或受精过程中被排除,这是质体母系遗传的细胞学基础。本研究结果证明白杨派树种毛白杨、毛新杨、银腺杨和中国山杨雄性质体在小孢子有丝分裂时由于极性化分布被排除,导致刚形成的生殖细胞细胞质内不含质体,与番茄属型的特征一致,而与Russell认为美洲黑杨质体在受精时被排除,把杨树细胞质遗传归为小麦属型[10]的观点不同。在白杨派树种生殖细胞形成和发育各时期虽然均存在线粒体,以往的DNA荧光观察可以确定线粒体DNA在生殖细胞不同发育时期已降解[14],这是其母系遗传的重要机制。这一结果说明白杨的质体遗传和线粒体遗传是在相互独立机制下进行的,类似于Sodmergen[3],Liu 等[21]的研究结果。
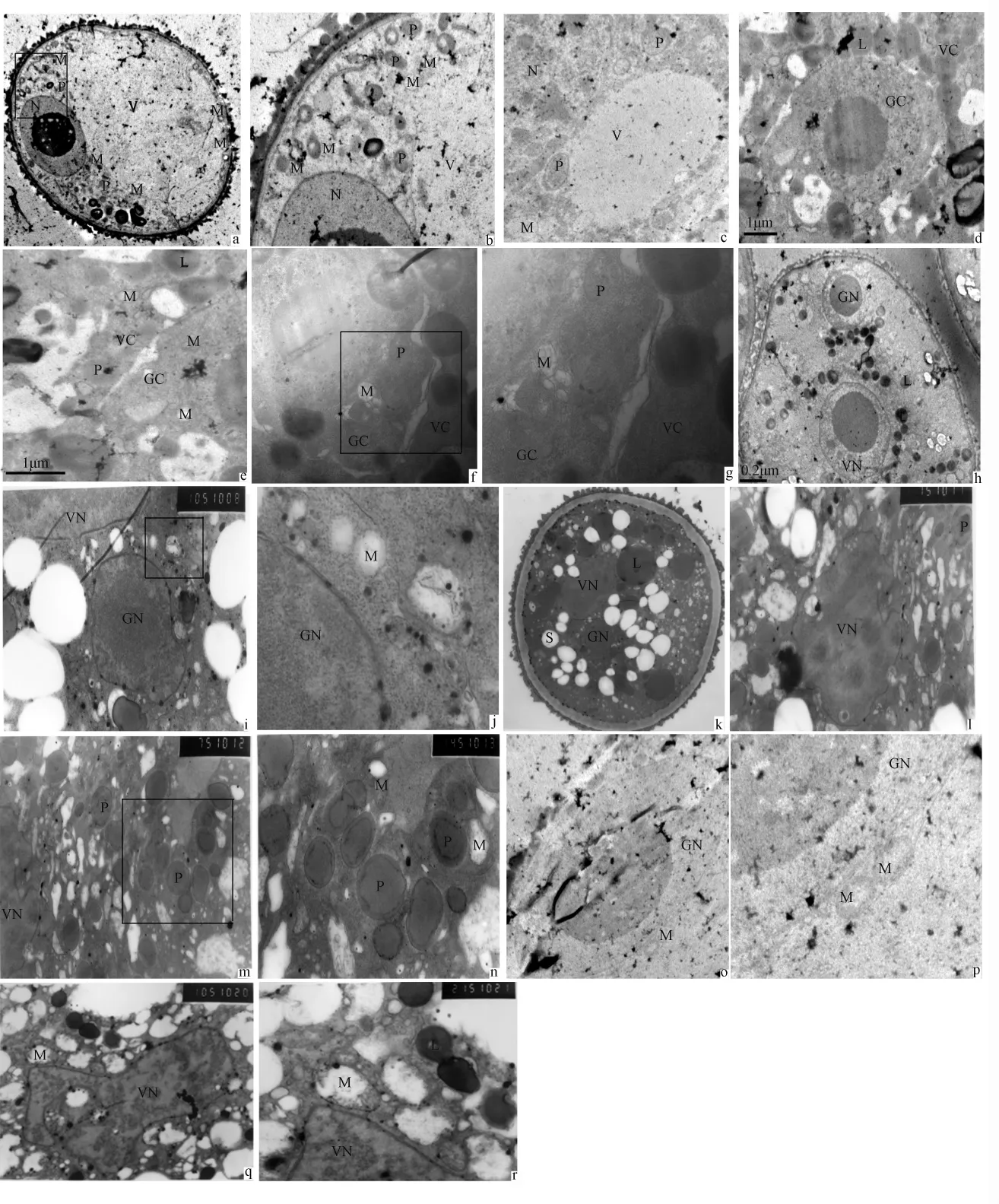
图1 超薄切片透射电镜观察
许多学者认为细胞器的极性分布可能是细胞骨架在起作用[26]。Schröder[27]在脂麻掌(Gasteria verrucosa)的研究中,推测质体和其它细胞器在胞内的运动和定位似与肌动蛋白微丝有关。Huang等[28]在白花丹(Plumbago)的生殖细胞中观察到细胞器与微管连结,认为细胞器的极性分布是微管起作用。蔡雪研究朱顶红(Hippeastrum rutilum)、高原卷丹(Lilium davidii var.Unicolor)花粉粒和花粉管中细胞骨架时发现,正常花粉小孢子不均等有丝分裂是由微管系统决定的,而秋水仙素和高温(32℃)能影响微管从而导致小孢子的对称分裂[27]。早期董源观察郑州地区和北京地区毛白杨的有性生殖过程时发现,毛白杨单核花粉有丝分裂多不均等,少为均等分裂[23]。本研究发现,白杨派树种花粉第1次有丝分裂的不均等分裂,使质体被排除在生殖细胞以外,不参与授精过程,是质体母系遗传的主要原因。秋水仙素人工诱变多倍体原理也是通过抑制纺锤体微管生成,阻止减数分裂时期染色体分离。据此,笔者打算通过进一步的研究工作,搞清几个问题:①在人工诱变多倍体过程中,秋水仙素、高温等诱变条件能否抑制微管作用,从而影响包括质体在内的细胞器的极性分布,进而引起细胞质遗传方式的改变。②在对核基因组实施加倍的同时,是否也导致了细胞质遗传物质的加倍。笔者等曾经对不同加倍方式所得三倍体毛白杨叶绿体性状变异进行了研究[13],发现大部分三倍体毛白杨与二倍体亲本在叶绿体大小上差异不大;叶绿体数目则因倍数的增加而增加,其中卵细胞染色体加倍获得的三倍体达到极显著水平;在单位体积、单个细胞叶绿体DNA含量方面,花粉染色体加倍获得的三倍体比卵细胞染色体加倍获得的三倍体表现突出,其中叶绿体大小与单位体积的个数呈负相关变化,单位体积叶绿体DNA量的增加与叶绿体大小和单位体积叶绿体数目关系不大。以上结果是否与不同加倍方式有关?叶绿体数目的增加是否由于加倍作用引起质体极性化分布异常?花粉染色体加倍导致核基因组加倍的同时,是否也导致了叶绿体基因组的加倍?这些问题今后需要进一步深入研究。
[1]胡适宜.被子植物质体遗传的细胞学研究[J].植物学报,1997,39(4):363-371.
[2]袁宗飞.旋花科几种植物与油松细胞质遗传的细胞学研究[D].北京:北京大学,1998.
[3]Sodmergen,Zhang Quan,Zhang Yingtao,et al.Reduction in amounts of mitochondrial DNA in the sperm cells as a mechanism for maternal inheritance in Hordeum vulgare[J].Planta,2002,216:235-244.
[4]张泉.被子植物细胞质遗传的细胞学研究[D].北京:北京大学,2003.
[5]Hu Yingchun,Zhang Quan,Rao Guangyuan,et al.Occurrence of plastids in the sperm cells of Caprifoliaceae:Biparental plastid inheritance in Angiosperms is unilaterally derived from maternal inheritance[J].Plant and cell physiology,2008,49(6),958 - 968.
[6]Nagata N.Mechanisms for independent cytoplasmic inheritance of mitochondria and plastids in angiosperms[J].Journal of Plant Research,2010,123(2):193 -199.
[7]Radetzky R.Analysis of mitochondrial DNA and its inheritance in Populus[J].Current Genetics,1990,18(5):429 - 434.
[8]Rajora O P,Barrett J W,Dancik B P,et al.Maternal transmission of mitochondrial DNA in interspecific hybrids of Populus[J].Current Genetics,1992,22:141 -145.
[9]Mejnartowicz M.Inheritance of chloroplast DNA in Populus[J].Theoretical and Applied Genetics,1991,82(4):477 -480.
[10]Russell S D,Rougier M,Dumas C.Organization of the early postfertilization megagametopyte of Populus deltoids:Ultrastructure and implications for male cytoplasmic transmission[J].Protoplasma,1990,155:153 -165.
[11]Zhang Quan,Liu Yang,Sodmergen.Examination of the cytoplasmic DNA in male reproductive cells to determine the potential for cytoplasmic inheritance in 295 angiosperm species[J].Plant &Cell Physiology,2003,44(9):941 -951.
[12]崔彬彬,李云,金晓洁,等.白杨叶绿体和线粒体DNA的多态性及遗传性分析[J].北京林业大学学报,2006,28(6):9 -14.
[13]崔彬彬,李云,姜金仲,等.不同亲本起源的三倍体毛白杨叶绿体性状的变异[J].东北林业大学学报,2008,36(4):4 -7.
[14]崔彬彬,李云,金晓洁,等.白杨细胞质遗传的细胞学机理(I):生殖细胞和精细胞中细胞质DNA的存在状况[J].北京林业大学学报,2010,32(5):54 -62.
[15]白焕红.茉莉花和迎春花细胞质双亲遗传潜能和白花丹生殖细胞内游离钙分布的研究[D].北京:北京大学,1998.
[16]刘兴梁,胡赞民,胡适宜.RFLP技术在植物细胞质遗传研究中的应用[J].生命科学,1994,6(2):9 -11.
[17]Corriveau J L,Coleman A W.Rapid screening method to detect potential biparental inheritance of plastid DNA and results for over 200 angiosperm species[J].Amer J Bot,1988,75(10):1443 -1458.
[18]胡适宜,杨弘远.被子植物受精生物学[M].北京:科学出版社,2002.
[19]龚海云.浅谈细胞质中的质体遗传[J].兵团教育学院学报,2007,17(2):62 -63.
[20]胡适宜,国凤利,罗玉英.天竺葵质体和线粒体双亲遗传的细胞学机理:雄性和雌性配子超微结构和DNA荧光的研究[J].植物学报,1994,36(4):245 -250.
[21]Liu Yang,Zhang Quan,Hu Yufei,et al.Heterogeneous pollen in Chlorophytum comosum,a species with a unique mode of plastid inheritance intermediate between the maternal and biparental modes[J].Plant Physiol,2004,135(1):193 -200.
[22]胡适宜,罗玉英.玉竹雄配子体的发育:着重阐明质体在生殖细胞和营养细胞中的分布和变化[J].植物学报,1997,39(1):1-6.
[23]董源.毛白杨Populus tomentosa Carr.胚胎学观察[D].北京:北京林业大学,1982.
[24]牛建功.使用荧光染料YO-PRO-1检测植物细胞质DNA及旱金莲早期雄性生殖单位结构与功能的研究[D].北京:北京大学,1999.
[25]Hagemann R,Schröder M B.The cytological basis of the plastid inheritance in angiosperms[J].Protoplasma,1989,152:57 -64.
[26]Ryo M,Hu Yingchun,Kazuhira T,et al.The model plant Medicago truncatula exhibits biparental plastid inheritance[J].Plant and cell physiology,2008,49(1):81 -91.
[27]Schröder M B.Ultrastructural studies on plastids of generative and vegetative cells in Liliaceae 3.Plastid distribution during the pollen development in Gasteria verrucosa(Mill.)Duval[J].Protoplasma,1985,124(1/2):123 -129.
[28]Huang Bingquan,Pierson E S,Russell S D,et al.Cytoskeletal organisation and modification during pollen tube arrival,gamete delivery and fertilisation in Plumbago zeylanica[J].Zygoet,1993,1(2):143-154.
[29]蔡雪.朱顶红、高原卷丹花粉粒和花粉管中的细胞骨架[D].北京:北京大学,1993.
——有效的抗弓形虫药物靶标

