重组溶葡球菌酶的体外抑菌活性研究*
苏运芳,李 义,屈延延,南志春,齐雪峰,张 涌,赵献军
(西北农林科技大学动物医学院,陕西杨陵 712100)
重组溶葡球菌酶的体外抑菌活性研究*
苏运芳,李 义,屈延延,南志春,齐雪峰,张 涌*,赵献军*
(西北农林科技大学动物医学院,陕西杨陵 712100)
采用试纸片法和肉汤稀释法测定重组溶葡球菌酶(rLspn)的抑菌圈大小、最小抑菌浓度(MIC)和最小杀菌浓度(MBC),通过与溶葡球菌酶标准品和两种抗生素相比较,评价rLspn的体外抑菌活性。试纸片法试验结果显示,rLspn有专一抑制金黄色葡萄球菌的作用,而对其他菌株无效;rLspn与标准品的抑菌活性差异不显著(P>0.05);对于耐青霉素的金黄色葡萄球菌,rLspn仍然表现出良好的抑菌活性。肉汤稀释法结果表明rLspn的抑菌活性优于对耐药金黄色葡萄球菌最有效的盐酸万古霉素,MIC为0.1 μg/mL~0.2 μg/mL 。
重组溶葡球菌酶;抑菌活性
*通讯作者
溶葡球菌酶(lysostaphin)最早是由Schindler和Schuhardt从一株模仿葡萄球菌(名为模仿葡萄球菌NRRL B-2628)的培养物中发现并分离的[1]。它是一种分子质量为27 ku的含Zn2+金属蛋白酶,为246个氨基酸组成的单链分子。溶葡球菌酶具有内切肽酶活性,能够专一水解细菌细胞壁肽聚糖gly五肽桥联第2位与第3位gly之间肽键结构。而这一结构仅大量存在于葡萄球菌属细菌中,其中又以金黄色葡萄球菌(Staphylococcus aureus)细胞壁中分布最广。杨信怡等[2]研究表明,重组溶葡球菌酶(recombinant lysostaphin,rLspn)主要对金黄色葡萄球菌具有较强的杀菌活性,对甲氧西林敏感金黄色葡萄球菌(MSSA)的抗菌效果较为突出。
溶葡球菌酶对金黄色葡萄球菌的专一溶杀作用受到了人们的重视,人们不仅利用基因组重组技术将该酶高表达于工程菌中以实现其产业化,而且运用到了抗病转基因动物的研制上。金黄色葡萄球菌作为乳腺炎主要致病菌之一,人们试图通过转基因技术来从根本上解决这一问题,首先研制出了转溶葡球菌酶基因小鼠[3],现已成功研制出转溶葡球菌酶基因奶牛[4],且表明由奶牛乳腺上皮细胞特异性分泌出rLspn能够有效抵抗奶牛乳房炎。
本试验即采用试纸片法测定rLspn对金黄色葡萄球菌、大肠埃希菌、无乳链球菌和多杀性巴氏杆菌的抑菌圈大小,采用肉汤稀释法在96孔微量培养板上测定rLspn对敏感菌的最小抑菌浓度(minimun inhibitory concentration,MIC)和最小杀菌浓度(minimal bactericidal concentration,MBC),并通过与溶葡球菌酶标准品、盐酸万古霉素和青霉素相比较,研究由牛乳腺上皮细胞表达的rLspn的抑菌活性,为转溶葡球菌酶基因奶牛临床抗感染能力提供实验依据。
1 材料与方法
1.1 材料
1.1.1 菌株 致病性金黄色葡萄球菌(Staphylococcus aureus)两株:CVCC 2258购自中国兽医药品监察所菌种保藏中心,S.aureus分离株由西北农林科技大学动物医学院免疫学实验室提供;致病性大肠埃希菌(Escherichia coli)C83903购自中国兽医药品监察所菌种保藏中心;无乳链球菌(Streptococcus agalactiae)和多杀性巴氏杆菌(Pasteurella multocida)由西北农林科技大学动物医学院兽医微生物实验室馈赠。
1.1.2 药品 rLspn由西北农林科技大学农业部动物生殖生理和胚胎工程重点开放实验室提供,是通过诱导转溶葡球菌酶基因的牛乳腺上皮细胞表达所得,为浓缩纯化的细胞上清液;溶葡球菌酶(1 200 U/mg)购于上海源叶生物科技有限公司;盐酸万古霉素和青霉素均为Solarbio公司产品。
1.1.3 培养基 MH培养基,为北京陆桥试剂有限公司产品;犊牛血清,为Gibco公司产品。
1.2 方法
1.2.1 菌株的活化 用接种环分别挑取菌种管中金黄色葡萄球菌CVCC 2258、金黄色葡萄球菌分离株、致病性大肠埃希菌C83903、无乳链球菌和多杀性巴氏杆菌少许,连续划线法接种MH平板,37℃培养18 h~24 h后,挑单个菌落接种于新的MH平板培养12 h~16 h备用。其中无乳链球菌、多杀性巴氏杆菌用含20 mL/L犊牛血清的MH培养基。
1.2.2 rLspn、溶葡球菌酶和抗生素溶液的准备根据预实验将rLspn用灭菌纯水稀释至50 μg/mL,溶葡球菌酶标准品做同样稀释;将盐酸万古霉素和青霉素用灭菌纯水分别稀释至 10 μg/mL和 2 μg/mL,4℃保存备用。
1.2.3 试纸片法检测rLspn的抑菌能力 用接种环挑取活化后的菌落,于生理盐水中制成悬液作为接种物,并校正菌液浓度至0.5麦氏比浊标准(1麦氏比浊标准相当于1.5×108cfu/mL)。用无菌棉拭子蘸取校正过的菌液,在试管壁上挤压几次,压去多余的菌液,涂布新鲜培养板表面,反复数次,每次旋转平板60度,使整个平板涂布均匀。敞盖室温干燥3 min~5 min,在15 min之内用无菌镊子将无菌滤纸片放在琼脂表面并轻压,使纸片与琼脂表面完全接触。分别滴加稀释好的rLspn液、Lspn液、盐酸万古霉素和青霉素到滤纸片上,每个纸片滴加10 μL,并设立灭菌纯水作为空白对照。37℃过夜孵育后观察和记录抑菌环大小,根据抑菌环的大小判定酶的活性。试验平行重复3次。
1.2.4 肉汤稀释法检测rLspn的抑菌能力 采用96孔微量反应板,利用MH肉汤稀释法测定rLspn的MIC和MBC。用接种环挑取活化后的菌落,于MH液体培养基中制成悬液作为接种物,并校正菌液浓度至0.5麦氏比浊标准。在96孔板的第1~11孔中将rL-spn与菌液体积比1∶9混合后依次进行倍比稀释使各孔终浓度依次为 50、25、12.5、6.25、… …,0.048 828 2 μg/mL,第12孔加入100 μL 菌悬液作为空白对照;溶葡球菌酶标准品做同样处理;盐酸万古霉素在各孔中的最终浓度分别为 10、5、2.5、1.25、… …、0.009 765 7 μg/mL;青霉素在各孔中的最终浓度分别为2、1、0.5、0.25、… …、0.001 953 2 μg/mL。试验平行重复 3次。
以孔中弥散浑浊、底部有圆形或丝网状沉淀为细菌生长指标,以肉眼可见细菌的最小浓度判定为溶葡球菌酶或抗生素的最小抑菌浓度(MIC)。从没有细菌生长的最高浓度的3个孔中各取10 μL滴加到MH琼脂平板上,每孔做3个重复,待完全吸收后,37℃培养18 h~24 h后菌落计数,计数小于5 cfu/平板的培养孔浓度即为MBC[5]。
1.2.5 数据处理 试验数据采用SPSS软件中One-Way ANOVA进行方差分析。
2 结果
2.1 试纸片法检测rLspn的抑菌能力
由表1和图1可以看出,rLspn对金黄色葡萄球菌表现为专一抑制作用,而对大肠埃希菌、无乳链球菌和巴氏杆菌均无效;金黄色葡萄球菌分离株对青霉素表现出耐药,但 rLspn对其的抑制作用仍然有效,说明rLspn对金黄色葡萄球菌耐药菌株亦表现为良好的抑制作用;从 rLspn对两株金黄色葡萄球菌的作用可以得出,rLspn的抑菌活性和溶葡球菌酶标准品差异不显著(P>0.05),但对不同的菌株抑菌活性差异极显著(P<0.01)。

表1 试纸片法测定rLspn抑菌活性结果Table 1 The result of bacteriostasis activity of the rLspn by disc agar diffusion test
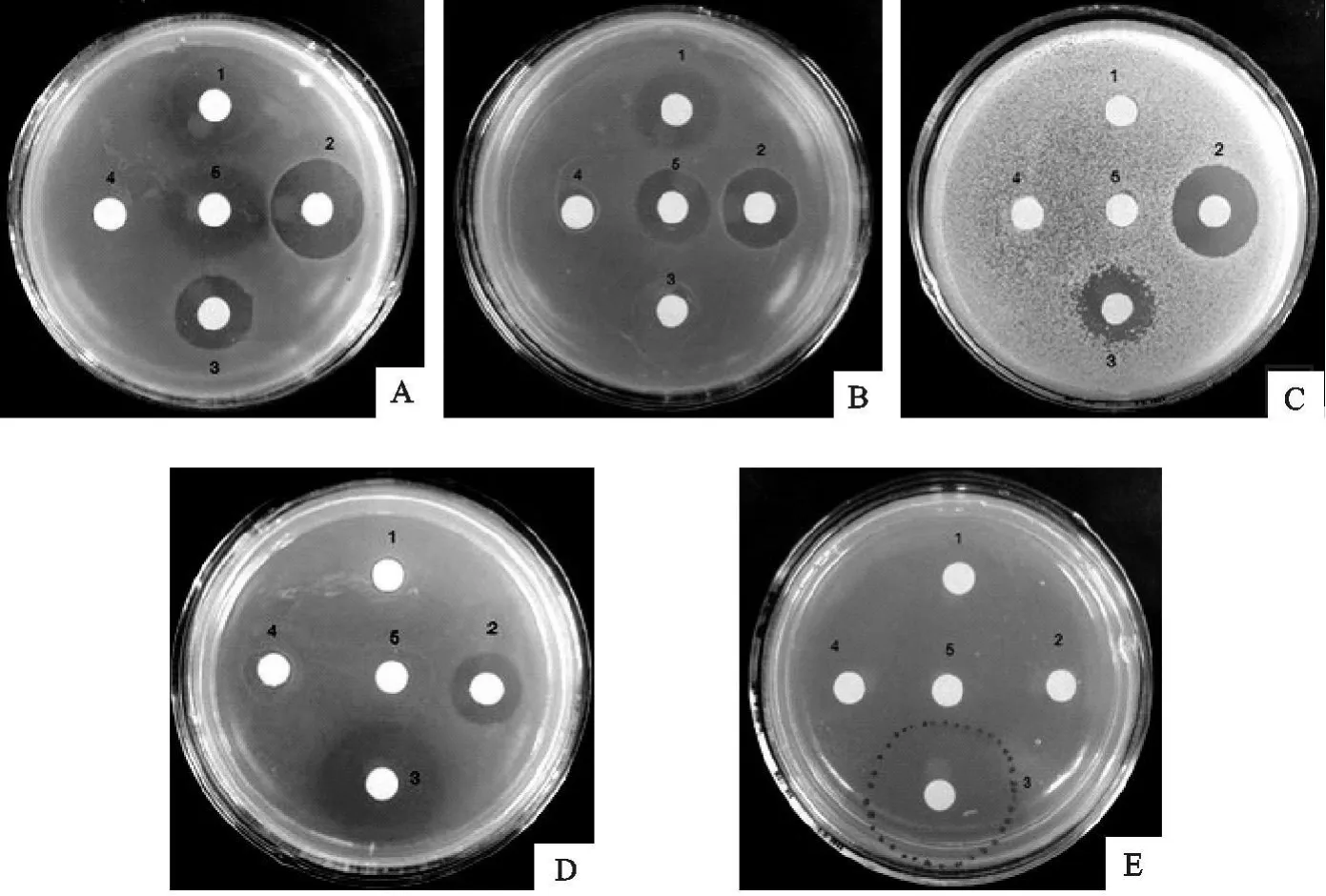
图1 试纸片法检测rLspn的抑菌活性Fig.1 T he bacteriostasis activity of rLspn by disc agar diffusion test
2.2 rLspn对金黄色葡萄球菌的MIC和MBC测定
由表2可以看出,对于同一株金黄色葡萄球菌,rLspn的抗菌活性优于盐酸万古霉素,且与溶葡球菌酶标准品对照相比,rLspn的抑菌活性更好,rL-spn 的最小抑菌浓度在 0.1 μg/mL ~ 0.2 μg/mL,这与文献报道的相一致[6]。
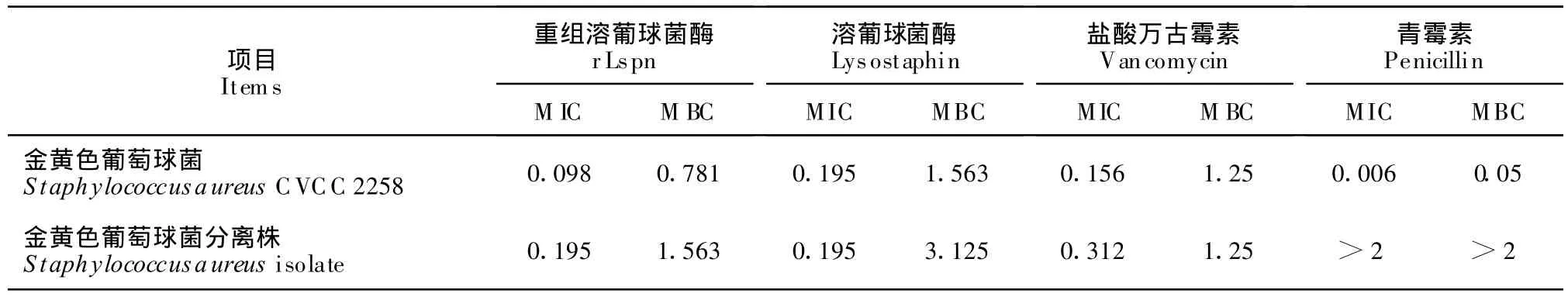
表2 rLspn的MIC和MBC测定结果Table 2 The result of MIC and MBC of the rLspn
3 讨论
随着抗生素在畜牧业生产中的广泛使用,使得耐药菌株成为威胁人畜健康的重要因素。金黄色葡萄球菌作为临床常见菌株,对抗生素的耐药问题越来越受到人们的重视,由此溶葡球菌酶专一溶杀葡萄球菌的高效性引起了人们的关注。杀菌试验显示[7],溶葡球菌酶杀菌作用迅速,且对静止和活动期葡萄球菌均有杀灭作用,这与酶的破壁活性不受细菌生长周期影响有关。相关研究表明,溶葡球菌酶的杀菌活性呈浓度依赖性[8]。吴燕等[9]通过构建大肠埃希菌表达载体,IPTG诱导表达重组溶葡球菌酶,所得rLspn对金黄色葡萄球菌的MIC为0.003 μg/mL~0.78 μg/mL。近年来,国内外对溶葡球菌酶的研究持续不断,上海高科生物工程有限公司研制的复合溶葡萄球菌酶(由溶葡萄球菌酶和溶菌酶复配而成)已形成兽药产品应用于临床治疗,现又有“重组溶葡萄球菌酶粉”即将上市,用于治疗奶牛子宫内膜炎和乳房炎。为避免耐溶葡球菌酶菌株的出现,联合其他抗菌物质的使用成为了一项课题,溶葡球菌酶与抗菌肽(茶树油[10]、噬菌体裂解酶Lysk[11]和抗菌肽ranalexin[12])的联合使用已有报道,Desbois A P等[13]最新研究表明,溶葡球菌酶与牛乳铁传递蛋白、乳酸链球菌素、黏菌素,达托霉素和多黏菌素B联合使用有协同抗菌作用。
本研究结果证明rLspn有专一抑制金黄色葡萄球菌的作用,且与溶葡球菌酶标准品和抗生素相比,rLspn无论对金黄色葡萄球菌标准株还是分离菌均有良好的抗菌活性,极低浓度(0.1 μg/mL~0.2 μg/mL)即可有效抵抗金黄色葡萄球菌。Wall R J等[4]报道仅3 μg/mL的溶葡球菌酶已能够抵抗葡萄球菌性乳房炎,因此,转基因牛乳腺上皮细胞分泌的rLspn可有效抵抗金黄色葡萄球菌的感染。随着转基因技术的发展,转rLspn基因奶牛的研制成功虽然在一定程度上能够解决奶牛乳房炎问题,但对于含有rLspn牛乳的食品安全还需要进一步的评估。此外,现今报道的溶葡球菌酶应用于临床治疗多为外用或注射给药,口服溶葡球菌酶的药代动力学研究是必要的。
[1]Schindler C A,Schuhardt V T.Lysostaphin:a new bacteriolytic agent for theStaphy lococcus[J].Proc Natl Acad Sci USA,1964,51(3):414-421.
[2]杨信怡,游雪甫,娄人慧,等.重组溶葡球菌酶的体外抗菌活性研究[J].中国新药杂志,2006,15(24):2107-2111.
[3]Kerr D E,Plaut K,Bramley A J,et al.Lysostaphin ex pression in mammary glands confers protection against staphylococcal infection in transgenic mice[J].Nat Biotechnol,2001,19:66-70.
[4]Wall R J,Powell A M,Paape M J,et al.Genetically enhanced cows resist intramammaryStaphylocaccus aureusinfection[J].Nat Biotechnol,2005,23(4):445-451.
[5]王以光.抗生素多学科研究入门[M].北京:人民卫生出版社,1998:18.
[6]杨信怡,游雪甫,蒋建东.溶葡球菌酶研究进展[J].中国生化药物杂志,2005,26(6):372-374.
[7]Walsh S,Kokai-Kun J,Shah A,et al.Extended nasal residence time of lysostaphin and an anti-staphylococcal monoclonal antibody by delivery in semisolid or polymeric carriers[J].Pharmaceutic Res,2004,21(10)∶1770-1775.
[8]杨信怡.重组溶葡球菌酶抗菌药效学及耐药机制研究[D].北京:中国协和医科大学研究生院,2005.
[9]吴 燕,伍素华,罗向东,等.重组溶葡萄球菌蛋白的原核表达、纯化及生物学活性研究[J].第三军医大学学报.2007,29(11),1060-1062.
[10]La Plante K L.In vitroactivity of lysostaphin,mupirocin,and tea tree oil against clinical methicillin resistantStaphylococcus aureus[J].Diag n Microbio Infect Dis,2007,57(4):413-418.
[11]Becker S C,Foster-Frey J,Donovan D M.The phage K lytic enzyme Ly sK and ly sostaphin act synergistically to kill M RSA[J].Fems Microbiol Lett,2008,287(2):185-191.
[12]Desbois A P,Gemmell C G,Coote P J.In vivoefficacy of the antimicrobial peptide ranalexin in combination with the endopeptidase lysostaphin against wound and sy stemic meticillinresistantStaphylococcus aureus(M RSA)infections[J].Int J Antimicrob Agents,2010,35(6):559-565.
[13]Desbois A P,Coote P J.Bactericidal synergy of lysostaphin in combination with antimicrobial peptides[J].Eur J Clin Microbiol,2011.DOI 10.1007/s10096-011-1188-z.
In vitroBacteriostasis Activity of Recombinant Lysostaphin
SU Yun-fang,LI Yi,QU Yan-yan,NAN Zhi-chun,QI Xue-feng,ZHANG Yong,ZHAO Xian-jun
(College of Veterinary Medicine,Northwest A&F University,Yangling,Shaanxi,712100,China)
The size of inhibition zone,the minimun inhibitory concentration(MIC)and the minimal bactericidal concentration(MBC)of the recombinant lysostaphin rLspn were assessed by disc agar diffusion test and broth dilution test,through comparing with lysostaphin and two kinds of antibiotics,to appraise the bacteriostasis activity of recombinant lysostaphinin vitro.Disc agar diffusion test showed that rLspn suppressedStaphylococcusspecificallx,but was invalid to other strains.T he bacteriostasis activity of rLspn and Lspn was not significant difference(P<0.05).Regarding theStaphylococcusresisting to penicillin,rLspn still showed good bacteriostasis activity.Broth dilution test indicated that the bacteriostasis activity of the rLspn was higher than that of hydrochloric acid vancomycin,which was effective to antibiotic resistenceStaphylococcus,and the MIC was 0.1 μg/mL-0.2 μg/mL.
recombinant lysostaphin;bacteriostasis activity
S852.79
A
1007-5038(2011)09-0019-04
2011-04-20
国家重大课题“抗病转基因牛新品种培育”(2008ZX08007-004)
苏运芳(1985-),女,河南兰考人,硕士研究生,主要从事临床兽医学研究。

