FHIT,Caspase-3及Survivin蛋白在结肠癌组织中的表达及其意义
常方芝,田字彬
(青岛大学医学院附属医院 消化科,山东 青岛 266000)
结肠癌是消化系统最常见的肿瘤之一,其发生发展涉及多种癌基因的激活和多种抑癌基因的失活;与细胞凋亡的抑制,细胞的恶性转化及转化细胞的各种因子的平衡调控异常密切相关[1]。目前研究显示,结肠癌是在抑癌及促癌等多种基因作用下的一种遗传性疾病,常表现为结肠癌组织中的促癌基因表达上调或抑癌基因表达的缺失[2],其中FHIT(fragile histidine triad,FHIT)基因,Caspase-3及Survivin基因是参与细胞增殖及凋亡的相关基因或蛋白,与结肠癌发生、发展密切相关,但在结肠癌发生过程中相互调控的关系尚未明确,本文对FHIT,Caspase-3及Survivin蛋白在结肠癌组织表达情况及其相关性进行探讨。
1 材料和方法
1.1 标本来源
收集青岛市海慈医疗集团病理科2006年~2007年经手术治疗的患者结肠癌组织及癌旁组织60例。患者男性26例,女34例,年龄37~79岁,平均(56±18.4)岁,标本均经病理诊断明确,具备完整病历资料,所有患者术前无放化疗治疗史,无免疫抑制药物治疗史,未合并其它器官或系统的恶性肿瘤。
1.2 主要试剂及仪器
兔抗人多克隆FHIT、Survivin、Caspase-3抗体、非免疫山羊血清购于武汉博士德生物试剂有限公司;S-P通用试剂盒、DAB超敏显色试剂盒购于北京赛迟生物有限公司;其它试剂由青岛市海慈医疗集团中心实验室提供。
1.3 染色方法
结肠癌组织及癌旁组织标本采用SP免疫组化染色三步法,石蜡包埋的病理组织切片冰盒冰冻3 min后,采用切片机2 μm厚度连续切片,常规展片、烘干,采用pH7.0的PBS缓冲液浸泡冲洗,微波修复暴露抗原,过氧化酶阻断溶液,以阻断内源性过氧化物酶的活性,采用无抗原性的非免疫山羊血清去除杂质干扰,滴加生物素标记的二抗,室温下孵育,PBS冲洗,滴加链霉菌抗生物素-过氧化酶溶液终止反应,终止反应后采用DAB显色,采用苏木素复染,自来水冲洗返蓝,常规脱水干燥、透明、中性树胶封片。
1.4 结果判断
切片观察采用400倍光镜放大,阳性细胞分析采用网格计数法,每张切片选择5个不重复的视野,依据观察到的细胞数目及染色细胞数目计算阳性结果,淡蓝色背景下细胞不着色判定为阴性结果,淡蓝色背景下细胞内棕黄色染色判定为阳性细胞,视野内阳性细胞占计数细胞总数比例<1/3为弱阳性,1/3~1/2为中等阳性,>1/2判定为强阳性。
1.5 统计学方法
采用SPSS17.0统计学软件进行数据分析,计数资料比较采用卡方检验,相关性检验采用同斯皮尔曼相关性分析,检验水准α=0.05。
2 结 果
2.1 FHIT,Caspase-3及Survivin蛋白在结肠癌组织及癌旁正常组织的表达
FHIT蛋白主要表达在癌旁结肠黏膜和结肠癌组织细胞膜及细胞质中,阳性表达者可见淡蓝色背景下颗粒样棕黄色颗粒,表达强度以中等阳性及弱阳性为主,癌旁组织表达阳性率高于结肠癌组织(图1、表1);Caspase-3蛋白主要表达在癌旁结肠黏膜和结肠癌组织细胞质及细胞核胞浆中,表达阳性者可见浅蓝色背景下棕黄色颗粒样染色,表达强度以中等阳性为主,癌旁组织表达阳性率高于结肠癌组织(图2、表1);Survivin蛋白主要表达在癌旁结肠黏膜和结肠癌组织细胞质及细胞核胞浆中,阳性表达者浅蓝色背景下可见棕黄色颗粒样或团块样染色,癌旁组织表达阳性率低于结肠癌组织(图3、表1)。
2.2 FHIT与Caspase-3蛋白在结肠癌组织表达的相关性
结肠癌组织60例中,FHIT与Caspase-3蛋白同时阳性表达者14例(23.3%),同时阴性表达者39例(65.0%),相关性检验结果显示,结肠癌组织中FHIT与Caspase-3蛋白表达呈正相关关系(r=0.410,P=0.006)。
2.3 FHIT与Survivin蛋白在结肠癌组织表达的相关性
结肠癌组织60例中,FHIT与Survivin蛋白同时阳性表达者12例(20.0%),同时阴性表达者4例(6.7%),相关性检验结果显示,结肠癌组织FHIT与Survivin蛋白表达呈负相关关系(r=-0.454,P=0.004)。
3 讨 论
近年来,结肠癌的发病率呈现上升趋势[3],结肠癌的发生同机体的抑癌因素及促癌因素失衡密切相关。研究显示,在结肠癌组织,具有抑癌作用的细胞因子或蛋白质常表达缺失,而具有促癌作用的相关细胞因子出现高表达现象,其共同调控结肠组织的异常增生、癌变[4]。
FHIT基因是三联体组氨酸家族成员,FHIT蛋白是FHIT基因基因编码的生物活性蛋白,FHIT蛋白具有多种生物活性,并且参与体内细胞信号传导,对细胞增殖具有抑制作用,能够促进细胞的凋亡。在FHIT蛋白表达水平降低时,其能通过上调ATP类似物ApaA的表达减少水解发挥促进细胞增殖作用,抑制细胞的凋亡。同时FHIT蛋白水平下降能够影响细胞内mRNA的稳定性,使mRNA容易发生突变及分解,其可能是导致结肠组织癌变的机制之一[5,6]。本研究中发现,与癌旁正常的大肠黏膜上皮相比,FHIT蛋白在大肠癌组织中不表达或仅少量表达,与文献报告相似,说明它在大肠癌的进展过程中发挥重要作用,也有研究报道FHIT蛋白的表达缺失或减少与大肠癌的转移和预后呈正相关[7],说明对结肠癌组织的FHIT蛋白的检测对预后具有预测价值。近年来的研究显示,FHIT基因位点能够作为结肠癌基因治疗的靶点[8],对结肠癌组织FHIT蛋白的检测能够为个体的结肠癌基因治疗的可能性提供参考依据。

图1 FHIT蛋白在结肠癌及癌旁组织中的表达(×400)
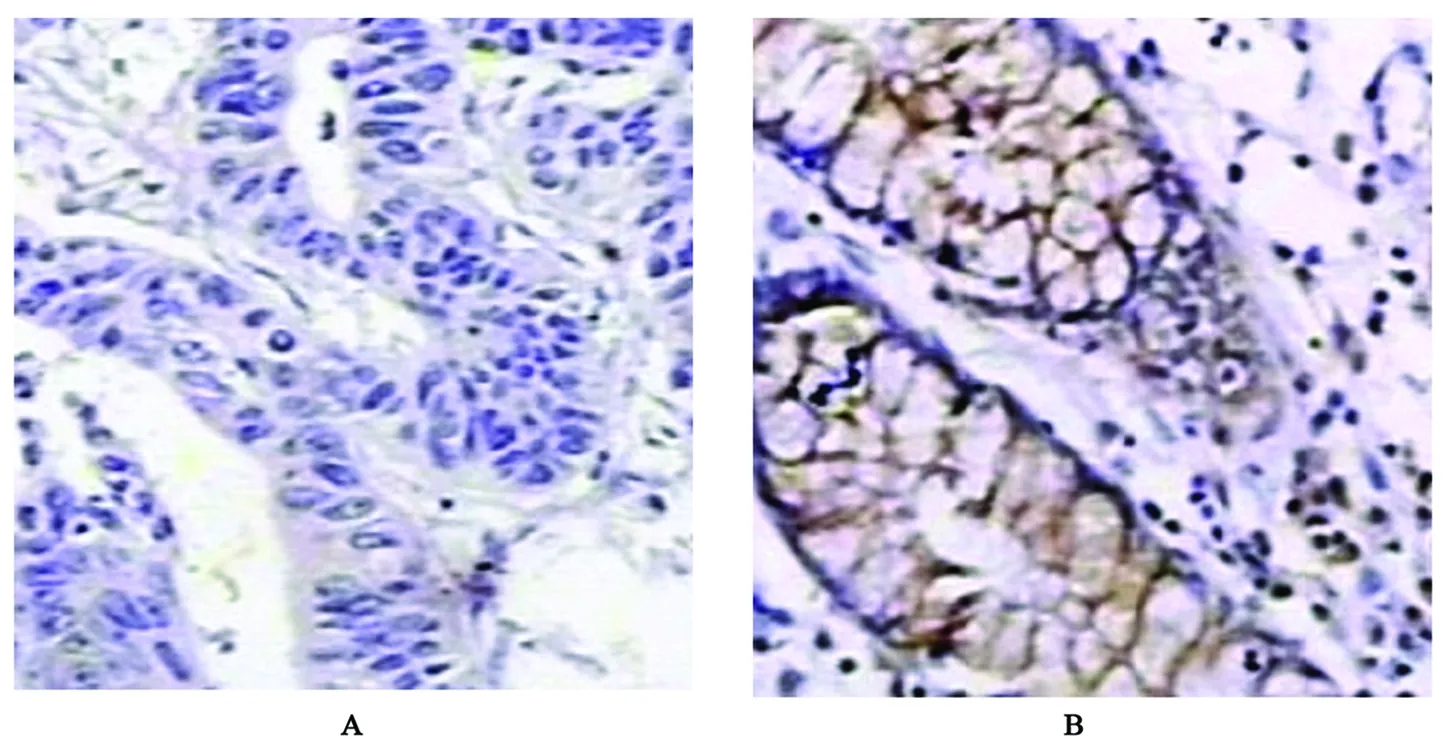
图2 Caspase-3在结肠癌及癌旁组织中的表达(×400)

图3 Survivin蛋白在结肠癌及癌旁组织中的表达(×400)

表1 FHIT,Caspase-3及Survivin蛋白在结肠癌及癌旁组织中的表达
Caspase-3蛋白是半胱氨酸蛋白酶家族成员,又称细胞凋亡因子,在细胞凋亡的过程中起着关键性作用。其能够通过对细胞凋亡的特异蛋白质剪切诱导细胞凋亡,同时能够通过细胞外途径接受细胞外环境中TNF、Fas等细胞凋亡信号的激活,引起细胞凋亡级联反应[9],同时又能通过细胞内途径接受线粒体细胞色素C的诱导激活细胞凋亡信号[10],诱导正常细胞及肿瘤细胞的凋亡,是机体控制细胞异常增殖,诱导细胞凋亡的主要机制之一。研究显示,Caspase-3蛋白的低表达,细胞凋亡机制失控是结肠癌的发病机制之一。在对结肠癌组织Caspase-3蛋白表达与生物学特性的研究中发现[11],Caspase-3蛋白的表达缺失同结肠癌的分化程度有关,提示Caspase-3表达缺失同结肠癌的恶性生物学行为密切相关。体外细胞培养的研究发现,化疗药物奥沙利铂能够通过激活Caspase-3蛋白的表达发挥对肿瘤细胞生长的抑制[12],提示对Caspase-3蛋白编码基因位点的干预可能成为肿瘤基因治疗的新途径。
Survivin蛋白又称为细胞增殖因子,是凋亡蛋白抑制因子家族的成员之一,能通过与前凋亡蛋白Smac/DIABLO结合,拮抗其促凋亡活性[13],其能通过与细胞周期中的多个酶系作用,作用于细胞周期,抑制细胞凋亡,促进细胞的增殖,是迄今发现最强的凋亡抑制因子,可以调节细胞周期,还与血管生成有关,它几乎在人类肿瘤中都有不同水平的表达。Survivin的过度表达是组织细胞异常增生的机制之一,Survivin蛋白在正常及恶变的组织表达存在较大的差异,在结肠癌组织,Survivin蛋白表达特异性地升高,而在癌旁正常的黏膜组织表达率极低或不表达[14],提示Survivin蛋白与大肠癌的发生、增殖密切相关。有研究显示,结肠癌组织中Survivin蛋白的表达水平同结肠癌的生物学行为有关,在Survivin蛋白高表达的结肠癌组织,往往预示着其高度的恶性生物学行为[15]。Yamamoto T等[16]研究发现,应用天然的反义Survivin(EPR1)作用于人类结肠癌细胞株,不仅可下调Survivin蛋白的表达,减少细胞的增殖,而且增强凋亡作用,增加对抗癌药物的敏感性。Rodel F等[17]通过研究Survivin基因在三种不同放射敏感性的直肠癌细胞株(SW480、HCT-15、SW48)以及54例直肠癌患者的表达,发现Survivin基因的表达与放射诱导的凋亡之间存在负相关,证明Survivin在直肠癌中是一个重要的凋亡抑制基因,这种差异表达使它有可能成为肿瘤诊断和预后的新标记及治疗的新靶点。
研究发现在抑制细胞凋亡的过程中,Survivin基因通过阻断线粒体细胞色素C释放,直接抑制下游凋亡效应因子Caspase-3和Caspase-7起作用[18],经过与纺锤体纤维的结合,间接抑制caspase对纺锤体的水解作用,有利于保护有丝分裂细胞的完整性,抑制细胞凋亡。本实验中对具有抑癌作用的FHIT及Caspase-3蛋白检测发现,在结肠癌组织,FHIT及Caspase-3蛋白表达阳性率降低,在大部分结肠癌组织FHIT和Caspase-3蛋白的表达缺失,而对细胞增殖具有促进作用的Survivin在结肠癌组织存在过度表达现象,提示FHIT,Caspase-3及Survivin蛋白的表达缺失或上调参与结肠组织的癌变。同时相关性检验结果显示,FHIT同Caspase-3和Survivin表达之间存在相关关系,说明在结肠癌的发病过程中,FHIT、Caspase-3蛋白低表达或表达缺失引起的细胞凋亡抑制及Survivin蛋白上调引起的细胞增殖活性升高共同发生影响,而非单一因素引起的细胞异常增殖或细胞永生化。有研究显示Survivin能够通过抑制Caspase-3表达发挥抗凋亡作用,在既往的研究结果中也证实,在恶性肿瘤组织中其与Caspase-3表达存在负相关关系[19]。FHIT基因能够通过激活Caspases-8及Caspases-9引起Caspases酶介导的凋亡级联反应[20]。说明FHIT,Caspase-3及Survivin蛋白之间在结肠癌发生的过程中可能存在相互调控的关系,共同介导结肠癌的发生过程,而对于结肠癌的基因靶向或生物学治疗,也需要在多个基因位点或多个水平层次上进行。在结肠癌的临床治疗过程中,FHIT,Caspase-3及Survivin蛋白的联合检测,可能为其干预措施提供依据。
参考文献:
[1] 张弦,孙兴旺.抗凋亡因子Survivin与结肠癌关系的研究进展[J].实用癌症杂志,2006,21(6):651-653.
[2] 葛永利,阎晓红.Survivin基因与大肠癌的关系[J].内蒙古医学杂志,2008,40(1):66-67.
[3] 沈默,曲宸绪,游伟程,等.北京市城区结肠癌发病率分布滞后预测模型研究[J].首都医科大学学报,2008,29(4):501-504.
[4] 李日恒.FHIT和Caspase-3在结直肠癌组织中的表达及意义[J].临床合理用药,2009,2(17):1-2.
[5] Hao XP,Willis JE,Pretlow TG,et al.Loss of fragile histidine triad expression in colorectal carcinomas and premalignant lesions[J].Cancer Res,2000,60(1):18-21.
[6] 谢友利,柯尊富,朱润庆,等.FHIT基因在大肠癌中的表达及其意义[J].数理医药学杂志,2004,17(2):116-117.
[7] Mady HH,Melhem MF.FHIT protein expression and its relation to apoptosis,tumor histologic grade and prognosis in colorectal adenocarcinoma:an immunohistochemical and image analysis study[J].Clin Exp Metastasis,2002,19(4):351-358.
[8] 余桂戎,张瑞,孟艳玲,等.抑癌基因Fhit重组腺病毒的构建表达及其在结肠癌细胞中的生物学功能[J].中国生物工程杂志,2010,30(1):7-11.
[9] Henning RS,Juliane M,Hwain S,et al.Pro-Caspase-3 is a major hysiologic target of Caspase-8[J].J Biol Chem,1998,273(42):27084-27090.
[10] Anichini A,Mortarini R,Sensi M,et al.APAF-1 signaling in human melanoma[J].Cancer Lett,2006,238(2):168-179.
[11] Larmonier CB,Amould L,Larmonier N,et al.Kinetics of tumor cell apoptosis and immune cell activation during the regression of tumors induced by lipid A in a rat model of colon cancer[J].Int J Mol Med,2004,13(3):355-361.
[12] 杨平,曹杰,王辉.奥沙利铂诱导结肠癌细胞株SW480凋亡过程中caspase-8的活化[J].广东医学,2007,28(3):345-348.
[13] Song Z,Liu S,He H,et al.A single amino acid change (Asp 53->Ala53) converts Survivin from anti-apoptotic to proapoptotic[J].Mol Biol Cell,2004,15(3):1287-1289.
[14] Liang Q L,Wang BR,Li GH.DcR3 and survivin are highly expressed in colorectal carcinoma and closely correlated to its clinicopathologic parameters[J].J Zhejiang Univ Sci B,2009,10(9):675-682.
[15] Qi XL,Wang FL,Bo AH,et al.Expressions of MGMT and Survivin in colorectal carcinoma [J].Chin J Cancer Res,2008,20(2):139-143.
[16] Yamamot T,Manome Y,Nakamura M,et al.Downregulation of Survivin expression by induction of the effector cell protease receptor 1 reduces tumor growth potential and results in an increased sensitivity to anticancer agents human colon cancer[J].Eur J Cancer,2002,38(17):2316-2324.
[17] Rodel F,Hoffman J,Haas J,et al.Expression of Survivin in rectal cancer inversely correlated to apoptosis in vivo and may predict tumor response to neoadjuvant radiochemotherapy[J].Radiat Oncol,2002,54(2):99-100.
[18] Shin S,Sung BJ,Cho YS,et al.Anantiapoptotic protein human Survivin is a direct inhibitor of caspase-3 and caspase-7[J].Biochemistry,2001,40(4):1117-1123.
[19] 王佩飞,陈建武,郑佩赞,等.Survivin、fhit在结直肠良恶性病变中的表达及意义[J].武汉科技大学学报(自然科学版),2007,30(4):423-425.
[20] Rhat UG,Raychaudhuri P,Beck WT.Functional interaction between human topoisomerase and retinoblastoma protein[J].Proe Natl Acad Sci USA,1999,96(14):7859-7864.

