苯酚降解菌的筛选及其降解特性初探
周倩倩,丁 丛,王志平,蔡伟民
(上海交通大学环境科学与工程学院,上海 200240)
苯酚(C6H6O),又名石炭酸、羟基苯,是最简单的酚类有机物,其密度为1.071 g/cm3,熔点42~43℃,沸点182℃,在常温下微溶于水、乙醚、氯仿、甘油和二硫化碳,几乎不溶于石油醚[1-2].
作为重要的化工原料,苯酚及其衍生物被广泛应用于酚醛树脂、造纸、炼油、焦炭、染料、纺织、杀虫剂、农药和医药合成等行业生产中[3-4],并成为这些工业废水中的主要污染物,其在焦化厂和煤气厂废水中含量(挥发酚)可达1600~3200mg/L[5].酚类化合物是原型质高毒类物质,具有三致效应,美国环境保护署(EPA)把苯酚列入129种优先控制污染物和65种有毒污染物之列,我国也把苯酚列入中国环境优先污染物“黑名单”之中[6].我国污水综合排放标准(GB8978-1996)规定,挥发酚的一级标准、二级标准和三级标准分别为0.5、0.5、2.0mg/L.
含酚废水的处理方法有很多种[7],微生物降解法因其效果好、成本低、无二次污染等优点而在应用中发挥着日益重要的作用[8].为此,近些年来,研究人员在含酚废水微生物处理方面进行了大量研究[9-11],明确了生物法的关键在于高效破酚菌的驯化与应用.在降酚微生物菌种的研究中,热带假丝酵母因其高效降解性逐渐成为国内外的研究热点[12].本文以实验室前期培养的苯酚降解好氧颗粒污泥为主体,采用选择性培养基从中分离出了一株降酚菌,它的高苯酚耐受度与高效的苯酚降解率,在其他文献很罕见.针对影响其降解苯酚的因素开展了系列研究,以明确好氧颗粒污泥的降酚机理及其操作工艺优化,为好氧颗粒污泥工艺用于含酚废水处理提供理论支持.
1 材料和方法
1.1 菌源
实验室前期培养的苯酚降解颗粒污泥,经粉碎、悬浮后于YEPD培养基中培养.
1.2 培养基的制备
1.2.1 固体培养基
1)虎红琼脂培养基(Rose Bengal medium)
虎红琼脂培养基31 g/L(含13 g/L琼脂),补至琼脂质量分数为1.8%.培养基在121℃湿热灭菌20min后制成平板,倒置晾干于超净工作台备用.
2)PDA固体培养基(Potato Dextrose Agar medium)
马铃薯200 g/L,葡萄糖20 g/L,琼脂18 g/L.培养基在121℃湿热灭菌20min后制成平板,倒置晾干于超净工作台备用.
1.2.2 富集培养基
富集培养基采用YEPD培养基(YEPD medium):酵母提取物(Yeast extract)10 g/L,蛋白胨(peptone)20 g/L,葡萄糖(Dextrose)20 g/L.培养基在121℃湿热灭菌20min后备用.1.2.3 无机盐培养基
无机盐培养基(NMS medium):(NH4)2SO40.5 g/L,NH4NO31.0 g/L,NaCl 0.5 g/L,MgSO4·7H2O 0.5 g/L,KH2PO40.5 g/L,K2HPO41.5 g/L,CaCl20.01g/L,微量元素1mL/L.121℃湿热灭菌20min后备用.
(微量元素液:FeSO40.1 g/L,ZnSO40.1g/L,AlK(SO4)20.01 g/L,Na2MoO40.01 g/L,CoCl20.1 g/L,CuSO40.01 g/L,H3BO40.01 g/L)
1.3 仪器与设备
主要仪器设备包括荧光相差显微镜(Nikon E400)、高速台式冷冻离心机(德国SIGMA 3-18K型)、低速台式离心机(Anke KA-1000型)、超净工作台(哈尔滨市东联公司FLC-3型)、紫外-可见分光光度计(Unico UV-2102PCS型)、恒温振荡培养箱(上海常思工贸有限公司)、微型旋涡混合仪(上海沪西分析仪器厂有限公司XW-80A型)、精密pH计(上海雷磁仪器厂 PHS-3C)、生化培养箱(上海精宏实验设备有限公司 SHP-250型)等.苯酚(Phenol,crystalline,ultra pure)购于上海生工生物工程有限公司.
1.4 实验方法
1.4.1 苯酚降解优势菌的选育
1)菌种富集
取活性颗粒污泥50mL到含有200mg/L苯酚的150mL无机盐液体培养基中,并加入5粒玻璃珠,于30℃、120 r/min摇床中培养,24 h后取50mL转移至含有400mg/L苯酚的150mL无机盐液体培养基中,同样条件下继续培养24 h,依次逐步提高培养基中的苯酚质量浓度至1200mg/L,共5个周期,120 h.最后取培养液进行一系列稀释后涂布于苯酚质量浓度为1000mg/L的无机盐固体培养基平板上,置于生化培养箱中30℃培养.
2)菌种的纯化分离.
将驯化后所得混合菌株采用平板划线和涂布法进行纯化分离.在无菌操作条件下挑取菌落,划线及以10-3、10-4和 10-5的质量浓度梯度涂于虎红琼脂培养基和PDA培养基上,通过比较菌落特征(包括菌落大小、形状、颜色,隆起形态,边缘特征等)将菌株初步分类,再通过荧光相差显微镜(Nikon E400)将菌株进行进一步区分.将分离出来的菌种反复纯化3次后,挑取高度分散的单菌落至培养基斜面上划线培养,待斜面上形成菌苔后置于4℃的冰箱中保存备用.
3)菌种的筛选
先将菌种在无菌条件下接种到50mL富集培养基中,在温度为30℃,转速为120 r/min的恒温振荡摇床中培养12 h;取培养液3mL转接于100mL富集培养基中,继续振荡培养12 h.取菌液90mL,在10000 r/min条件下离心5min,弃上清液后用无机盐培养基洗脱菌体3次,以去除菌体表面吸附的YEPD培养基.再将得到的菌体用无机盐培养基配成菌悬液,以3%(V/V,下同)的接菌量接种到含1000mg/L苯酚的无机盐培养基中,于30℃、120 r/min恒温摇床中继续振荡培养.通过检测菌株细胞生长量和苯酚残余质量浓度的变化考察菌体对苯酚的降解利用状况.筛选出1株苯酚降解优势菌并进行菌种鉴定.
1.4.2 优势菌的苯酚耐受试验
配制分别含 500、750、1000、1250、1500、1750、2000、2250mg/L苯酚的无机盐固体培养基,将筛选出的苯酚降解优势菌分别在这8个梯度的培养基上划线,后置于生化培养箱中培养.
1.4.3 分析与检测
1)菌株生长量的测定
采用比浊法以波长为560 nm处的光吸收值(OD560)代表培养液中的浊度,即微生物量,表征菌株的生长状况[13].
2)苯酚质量浓度的测定
培养液中苯酚质量浓度采用4-氨基安替吡啉直接吸光光度法[14]测定.
酚类化合物于pH值为10.0~10.2介质中,在铁氰化钾存在下,与4-氨基安替比林反应,生成橙红色的跺酚安替比林染料,其水溶液在510 nm波长处有最大吸收.
3)苯酚降解率的计算

1.4.4 环境因子对菌株生长及其降酚效果的影响
1)接菌量的影响
将配制的菌悬液分别以1%、3%、5%、7%的接菌量接种到含1000mg/L苯酚的无机盐培养基中,于30℃、120 r/min恒温振荡摇床中培养.间隔6 h取样,测其菌浊(菌株生长量)以及剩余苯酚质量浓度.
2)苯酚初始质量浓度的影响
根据苯酚耐受实验结果,将配制的菌悬液以3%的接菌量分别接种到苯酚含量为750、1000、1250、1500、1750mg/L的无机盐培养基中,于30℃、120 r/min恒温振荡摇床中振荡培养.分别于24 h和36 h取样,测其菌浊以及剩余苯酚质量浓度.
3)pH值的影响
将配制的菌悬液以3%的接菌量接种到苯酚质量浓度为1000mg/L的无机盐培养基中,调pH值分别为 4.00、6.00、8.00、10.00,再以一组不调pH(已测 pH=6.85)为对照,于 30 ℃、120 r/min恒温振荡摇床中振荡培养.间隔6 h取样,测其菌浊以及剩余苯酚质量浓度.
4)温度的影响
将配制的菌悬液以3%的接菌量接种到含1000mg/L苯酚的无机盐培养基中,分别放置于温度为20、25、30、35、40 ℃,振荡速率均为 120 r/min恒温振荡摇床中振荡培养.于36 h取样,测其剩余苯酚质量浓度.
5)装液量的影响
将配制的菌悬液以3%的接菌量接种到苯酚质量浓度为1000mg/L的无机盐培养基中,置于培养基体积分别为 50、75、100、125、150mL 的 250mL三角瓶中,在30℃、120 r/min恒温振荡摇床中振荡培养.于24 h取样,测其剩余苯酚质量浓度.1.4.5 外加碳源对菌株生长及其降酚能力的影响
选葡萄糖为外加碳源.将配制的菌悬液以3%的接菌量接种到含1000mg/L苯酚的无机盐培养基中,分别加入质量浓度为 0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L的葡萄糖,再以一组苯酚为惟一碳源为对照,置于温度为30℃,振荡速率为120 r/min恒温振荡摇床中振荡培养.间隔4 h取样,测其菌浊以及剩余苯酚质量浓度.
2 结果与分析
2.1 降酚菌的选育及鉴定
经过驯化和反复涂布分离,从实验室前期降酚好氧颗粒污泥中分离出了18种苯酚降解菌株,分别标记为1#至18#.用虎红琼脂培养基和PDA固体培养基划线以及涂布后于4℃的冰箱中保存备用.
选取其中降解苯酚效果最好的1#菌株进行苯酚耐受性试验,发现其在苯酚质量浓度低于2000mg/L的培养基内均能生长良好,经大连宝生物工程公司采用23S rRNA测序鉴定,该菌株为热带假丝酵母属(C.tropicalis).
2.2 接菌量的影响
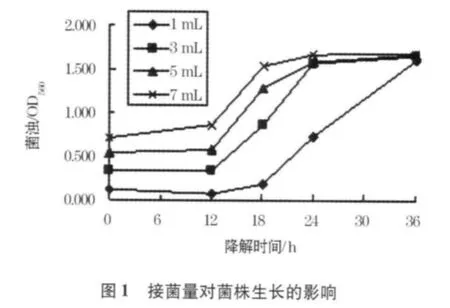
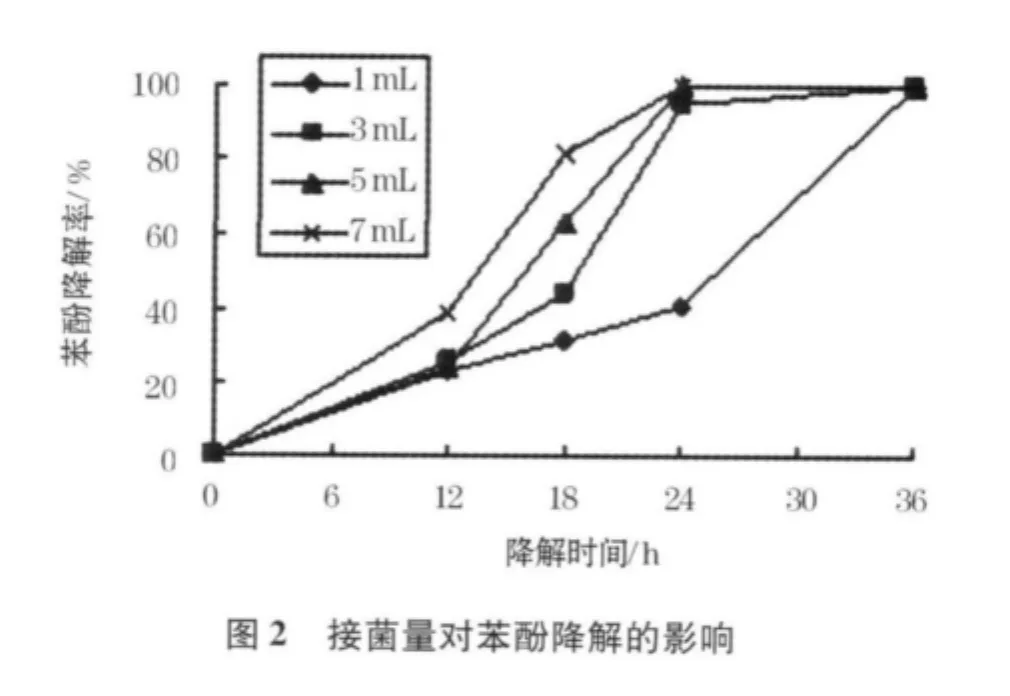
接菌量对菌株生长及苯酚降解的影响如图1、2.
从图1可以看出,当接菌量为1%时,菌株需要比较长的适应期,在12 h之后菌浊(生物量)才有比较明显的增长,而当接菌量≥3%时,菌株只需要很短的适应期即能进入对数增长期.随着微生物的增长,其中的苯酚被逐渐降解,各接种量下的试验水样均有近似的菌浊,表明由培养基质确定的微生物增长量基本相同.
试验中各接种样的剩余苯酚质量浓度如图2所示.从图2可以看出,实验初期由于微生物量较低,各试验样的剩余苯酚质量浓度相差不大,而由于菌株进入对数生长期有所差异,其剩余苯酚质量浓度出现明显差别.接菌量高的试样苯酚去除效率越高.接菌量≥3%的试样在24 h内均已基本完成试样内的苯酚降解,而接种1%的试样则明显延迟.在后续试验中,确定3%为最佳接菌量.
2.3 苯酚初始质量浓度的影响
微生物降解有毒有机化合物时需考虑化合物质量浓度本身对降解性能的影响[15].
在初始苯酚质量浓度对菌株利用苯酚的试验中发现,初始苯酚质量浓度越高对微生物毒害越大,导致苯酚的降解越慢(图3).24 h时,初始质量浓度为750mg/L的苯酚降解已完全结束,质量浓度为1000mg/L的苯酚降解率也已达到95%;而初始苯酚质量浓度≥1250mg/L的试样中,苯酚降解率急剧降低,1250mg/L的降解率仅为70%,1500mg/L和1750mg/L的更小于20%.36 h后,初始质量浓度为1250mg/L的苯酚降解率也能达到98%,而1500mg/L的降解率仅76%,1750mg/L的降解率仍不及20%.因为对2000mg/L质量浓度的苯酚降解率几乎为零,因此判断此菌株对2000mg/L的高质量浓度苯酚有耐受而无降解.在后续试验中,选取初始苯酚质量浓度1000mg/L为该菌株降解苯酚的最适宜降解质量浓度.
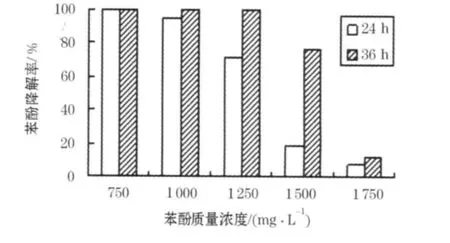
图3 苯酚质量浓度对苯酚降解的影响
2.4 pH值的影响
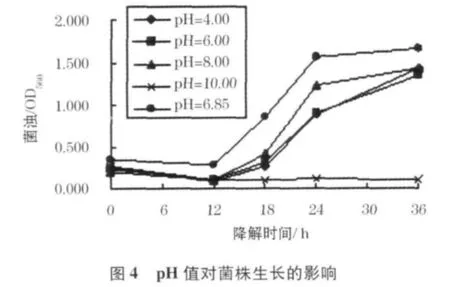
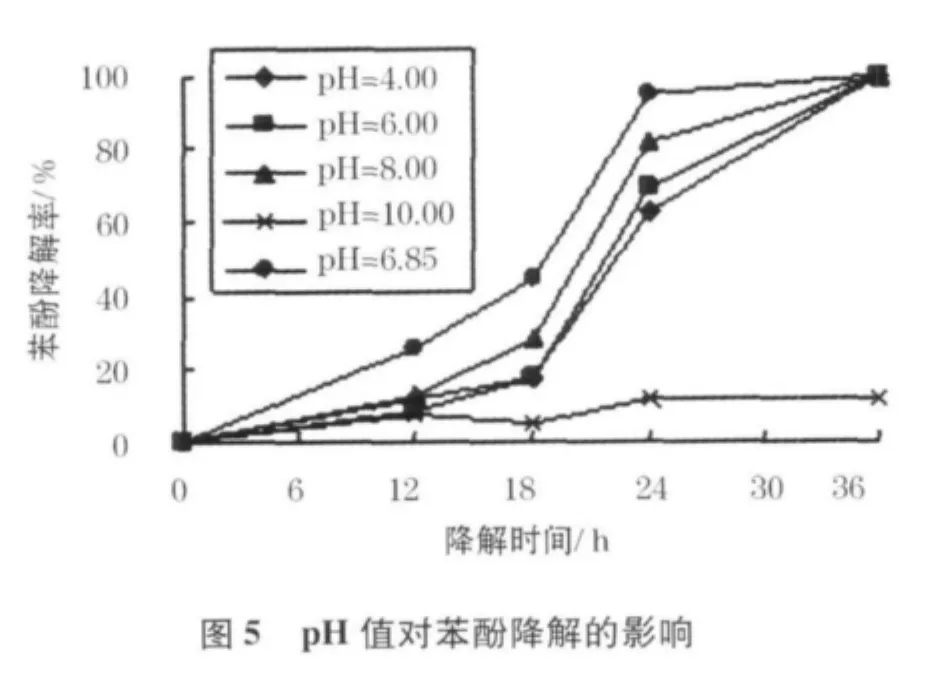
pH值是影响微生物降解苯酚的主要因素[16],不仅会直接影响微生物的生长增殖,同时可能改变水体中苯酚的存赋形态[17];它通过显著影响苯酚降解过程中的一系列生化反应,从而影响苯酚降解速率及效果[18].不同pH值对菌株生长及利用苯酚的结果如图4、5.
当pH值介于4.00到8.00之间,菌株均能较好的生长,且对苯酚都有较好的降解.其中,不调pH(pH=6.85)时菌株生长最快,适应期最短,24 h即完成了95%以上苯酚的降解;pH值为8.00时菌株生长情况和苯酚降解效果好于pH值为4.00和pH值为6.00时;而当pH值达到10.00时,菌株基本没有增殖,其中的苯酚也基本未被利用.这是因为高pH值导致苯酚电离形成弱酸根离子,对微生物产生了严重的毒害作用.
降解24 h后重新测定pH值,发现除pH值初始为10.00的试样以外,其他试样均有所降低,这可能是由于苯酚降解过程中产生的中间产物,如某些有机酸而引起的.在36 h后,pH值又有所上升,但未能恢复到pH值初始值,这与Ucun等人的研究结果一致[19].由于苯酚利用过程中pH值会降低,因此推测中性偏碱的环境有利于菌株降解苯酚,这与试验中pH值为6.85及8.0的试样有较好的降解效果相一致[20].本菌株适应pH值为4.00~8.00,最适pH值为中性稍偏碱.
2.5 温度的影响
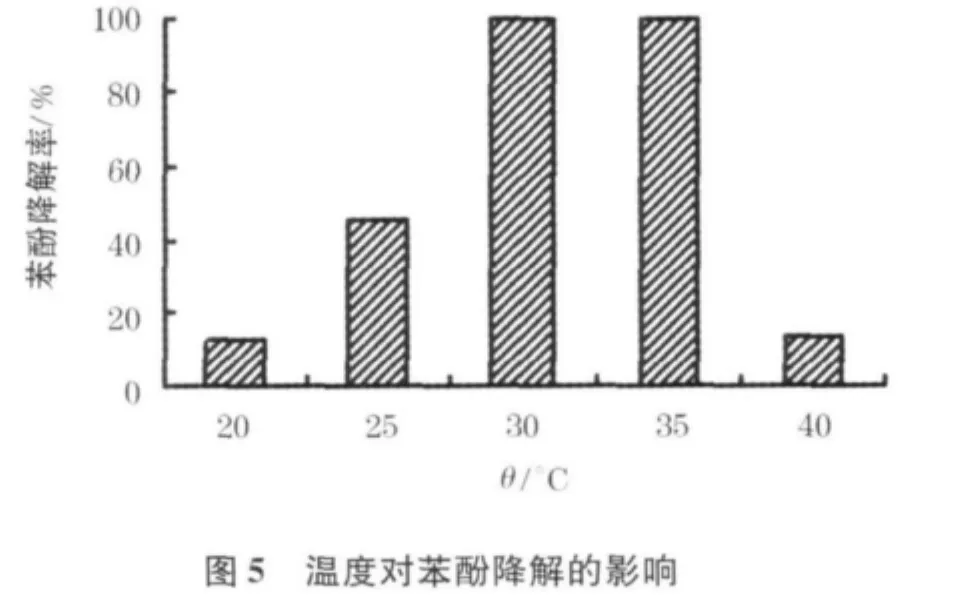
温度影响微生物体内的酶活性,在一定温度范围内,降酚酶表现出最佳催化活性[21].图6反映的是在不同温度下,接种量3%的菌株36 h后的苯酚降解率.从中可以看到,20℃和40℃下36 h后的苯酚降解率均低于20%,25℃下降解率仍仅为50%,而30℃与35℃条件下,菌株在36 h内能完成100%的苯酚降解.因此,该菌株降解苯酚的适宜温度为30~35℃,最适温度为30℃.本研究温度对该菌株降解苯酚有极大的影响,是影响苯酚降解的显著因素.
2.6 装液量的影响
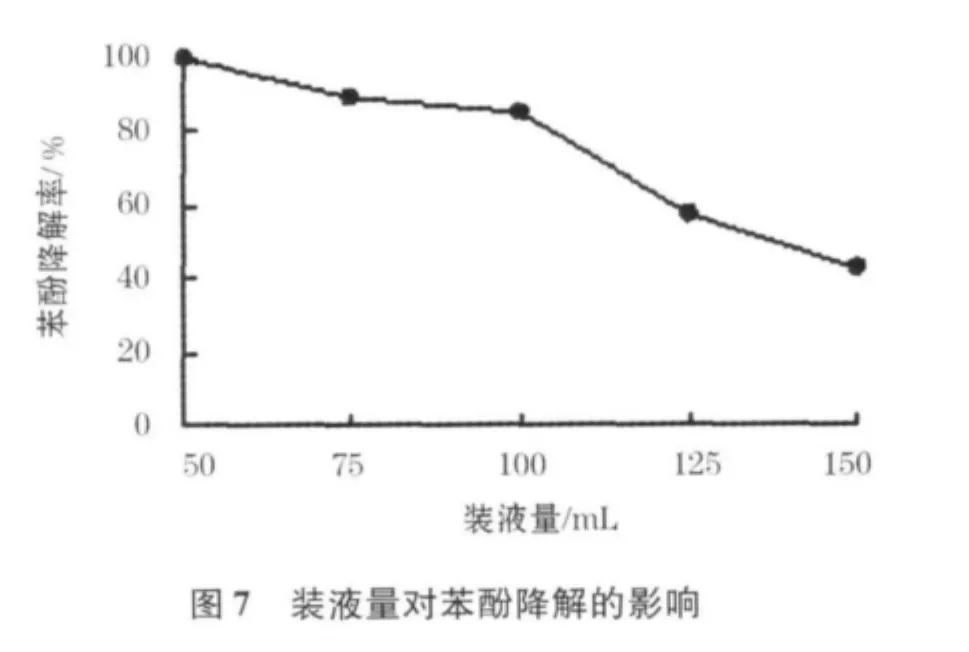
溶解氧是好氧微生物生长的重要生长条件,从而溶解氧质量浓度也会影响微生物对苯酚的利用效率.试验中采用改变装液量的方式改变摇瓶内的溶解氧含量,以实现不同溶解氧质量浓度的目的.图7给出了不同装液量情况下,菌株在24 h内的降酚情况.从图7中可以看出,使用250mL的三角瓶,随着装液量的增加,溶液的溶解氧降低,相应的苯酚降解率也逐渐降低.当装液量>100mL,通气量明显不足,菌体生长较差,苯酚降解率显著下降;而100mL以下的装液量对降酚率影响不大.后续试验中,采用100mL为最适装液量.
2.7 外加碳源的影响
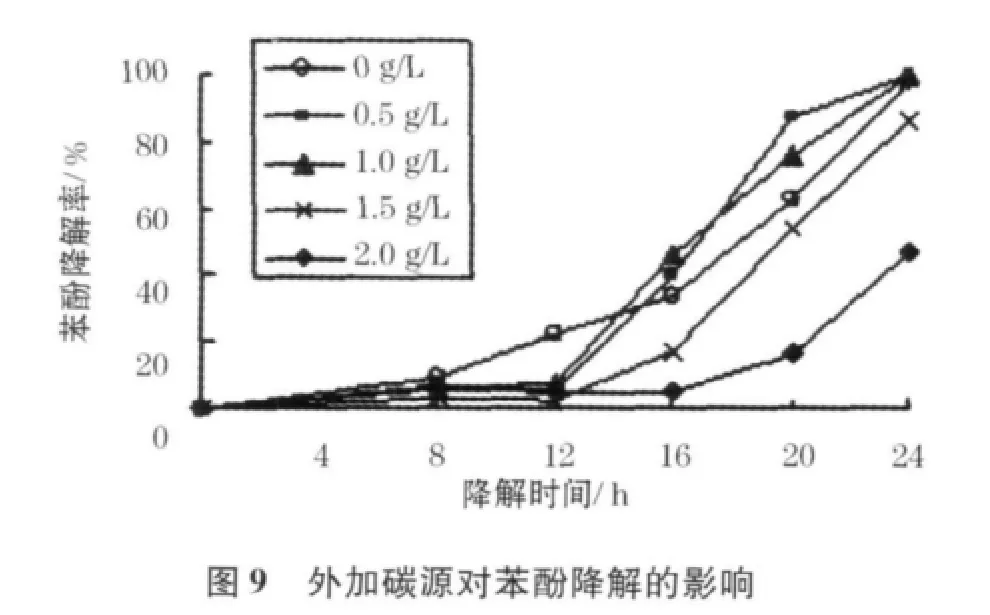
因高质量浓度苯酚对微生物的毒害作用,导致微生物生长量下降,不利于生物降解,此时投加适量易降解基质可促进微生物量的增殖,有利于难降解化合物的生物降解[22].本项研究中,通过添加葡萄糖考察了外加碳源对菌株利用苯酚的影响.综合图8、9可以看出,虽然葡萄糖的加入使菌浊迅速增长,但对起始阶段的苯酚降解并没有促进作用.无添加葡萄糖的一组在12 h对苯酚已有20%左右的降解,而添加葡萄糖的试验组反而对苯酚几乎无降解,这是由于菌株获得了更容易利用的基质,因而停止了对苯酚的利用.12 h后,添加少量葡萄糖(0.5 g/L和1.0 g/L)试验组的苯酚降解速率明显加快,这是因为葡萄糖的投入迅速提高了实验组的微生物量,而在葡萄糖被完全利用后,菌株开始转而利用苯酚为营养基质,从而使得苯酚利用率迅速提高.在添加质量浓度≥1.5 g/L的试样中,菌株在试验周期内始终处于富营养阶段,加入的葡萄糖足以满足其全部营养需求,由此降低了其对于苯酚的利用,造成苯酚利用“受抑制”的假象.为提高苯酚降解率,后续试验中投加的葡萄糖质量浓度应控制在0.0 ~1.0 g/L.

3 讨论与结论
1)采用苯酚选择性培养基从实验室前期培养的苯酚降解颗粒污泥中富集分离出了18株苯酚降解菌株,其中挑选出具有高苯酚耐受和降解率的1#菌株,其可耐受苯酚质量浓度达2000mg/L,24 h内可使初始质量浓度为1000mg/L的苯酚降解达到95%以上,经鉴定为热带假丝酵母(C.tropicalis).
2)对该菌株降解苯酚的试验表明,其最佳投加量为3%,最适温度为30~35℃,pH值为6~8,装瓶量为100mL/250mL,初始苯酚质量浓度为1000mg/L.
3)为促进菌株的快速增殖并提高其降酚效率,外加碳源葡萄糖的投加质量浓度应控制在0.0~1.0 g/L,过低则不利于微生物增殖,过高则不利于菌株对苯酚的有效利用.
[1]金相灿,程振华,徐南妮,等.有机化合物污染化学[M].北京:清华大学出版社,1999:250-265.
[2]黄蓓佳,张兰英,王少平.低温条件下1,2,4-三氯苯降解菌的筛选及降解特性[J].环境科学研究,2008,21(5):19-22.
[3]HA S R,VINTTNANTHARAT S,OZAKI H.Bioregeneration by mixed microorganisms of granular activated carbon loaded with a mixture of phenols[J].Biotechnology Letters,2000,22(13):1093-1096.
[4]SANTOS V L,LINARDI V R.Biodegradation of phenol by a filamentous fungi isolated from industrial effluents-identification and degradation potential[J].Process Biochemistry,2004,39(8):1001-1006.
[5]汪晋三,黄新华,程国佩.水化学与水污染[M].广州:中山大学出版社,1990:367-370.
[6]WAGNER M,NICELL J A.Peroxidase-catalyzed removal of phenols from a petroleum refinery wastewater[J].Water Science Technology,2001,43(2):253-260.
[7]佟丽萍,唐 霞,朱宝花,等.含酚废水处理方法的选择[J].工业水处理,1998,18(5):36-37.
[8]邱凌峰,吴芳芳,姚 尧.苯酚降解菌TX1的分离鉴定及其降解特性[J].上海环境科学,2010,29(1):35-40.
[9]JEONG J J,KIM J H,KIM C K,et al.3- and 4-alkylphenol degradation pathway in Pseudomonas sp.strain KL28:genetic organization of the lap gene cluster and substrate specificities of phenol hydroxylase and catechol 2,3-dioxygenase[J].Microbiology,2003,149(11):3265-3277.
[10]TERAMOTO M,OHNISHI K,HARAYAMA S,et al.An AraC/XylS family member at a high level in a hierarchy of regulators for phenol-metabolizing enzymes in Comamonas testosteroni R5[J].Journal of Bacteriology,2002,184(14):3941-3946.
[11]TSIROGIANNI I,AIVALIOTIS M,KARAS M,et al.Mass spectrometric mapping of the enzymes involved in the phenol degradation of an indigenous soil pseudomonad[J].Biochimica et Biophysica acta,2004,1700(1):117-123.
[12]MANGRULKAR P A,KAMBLE S P,MESHRAM J,et al.Adsorption of phenol and o-chlorophenol by mesoporous MCM-41[J].Journal of hazardous materials,2008,160(2-3):414-421.
[13]钱存柔,黄仪秀.微生物学实验教程[M].北京:北京大学出版社,1999:225-228.
[14]国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].北京:中国环境科学出版社,1997:408-410.
[15]许庆清,周作明.微生物降解苯酚废水的特性研究[J].环境科学与管理,2006,31(4):136-138.
[16]SA C S A,BOAVENTURA R A R.Biodegradation of phenol by Pseudomonas putida DSM 548 in a trickling bed reactor[J].Biochemical Engineering Journal,2001,9(3):211-219.
[17]LALLAI A,MURA G.Kinetics of growth for mixed cultures of microorganisms growing on phenol[J].The Chemical Engineering Journal,1989,41(3):55-60.
[18]CHUNG T P,TSENG H Y,JUANG R S.Mass transfer effect and intermediate detection for phenol degradation in immobilized Pseudomonas putida systems[J].Process Biochemistry,2003,38(10):1497-1507.
[19]UCUN H,YILDIZ E,NUHOGLU A.Phenol biodegradation in a batch jet loop bioreactor(JLB):Kinetics study and pH variation[J].Bioresource Technology,2010,101(9):2965-2971.
[20]MONTEIRO A M G,BOAVENTURA R A R,RODRIGUES A E.Phenol biodegradation by Pseudomonas putida DSM 548 in a batch reactor[J].Biochemical Engineering Journal,2000,6(1):45-49.
[21]ONYSKO K A,BUDMAN H M,ROBINSON C W.Effect of temperature on the inhibition kinetics of phenol biodegradation by pseudomonas putida Q5[J].Biotechnology and Bioengineering,2000,70(3):291-299.
[22]HABY P A,CROWLEY D E.Biodegradation of 3-chlorobenzoate as affected by rhizodeposition and selected carbon substrates[J].Journal Environment Quality,1996,25(2):304-310.

