启动子区E-box以及周围CpG岛的甲基化与基因节律性表达的关系
左晓虹 刘 姝 林庆玲 李 宁 陈 彪 蔡彦宁
(首都医科大学宣武医院神经生物学研究室,教育部神经变性病重点实验室北京 100053)
mPer1(mPeriod 1)、mPer2(mPeriod 2)、mCry1(cryptochrome 1)和mDBP(D site of albumin promoter binding protein)等节律基因的节律性表达是通过其基因启动子区域的 E-box和 BMAL1〔brain and muscle aryl hydrocarbon receptor nuclear translocator(ARNT)-like〕/CLOCK异源二聚体的结合来调节,其结合在节律基因日波动表达的调节中起关键作用[1-4]。但是这些基因的E-box与BMAL1/CLOCK的结合方式有明显不同。在经典节律器官——肝脏中,mPer1、mPer2的 E-box 全天持续稳定和 BMAL1/CLOCK 结合[3,5],而mCry1和mDBP的E-box和BMAL1/CLOCK的结合在一天之中呈动态变化[2,4],mCry1 E-box 的结合高峰出现在开灯后(hours after light onset,HALO)3~9 h,低点在 HALO 15 ~18 h[6];mDBPE-box 的结合高峰出现在HALO 5~11 h,低点在HALO 17~23 h。影响基因和蛋白相互作用的因素很多,包括蛋白含量、NAD(P)/NAD(P)H浓度、蛋白磷酸化水平等,但在同一个细胞内,这些因素是相同的,因此我们推测影响E-box和异源二聚体结合差异的原因极可能是由于E-box及其周围的序列差异造成的。
人们普遍认为MAP激酶磷酸化酶1(MAP kinase phosphatise 1,MKP1)是一种典型的时钟控制基因(clock-controlled gene,CCG),其启动子区有一个功能节律性的E-box[7]。MKP1的转录水平在小鼠视交叉上核(suprachiasmatic nucleus,SCN)呈现强节律性表达,而在肝脏呈现弱节律表达,在肾脏有持续稳定的表达[8],因此可以推测组织特异性的E-box及其周围的序列可能决定了MKP1的组织特异性表达。
由于在经典形式(如mPer1、mCry1、mDBP和mMKP1中)和非经典形式(如mPer2中)的E-box中常常包含DNA甲基化潜在靶点——CpG双核苷酸,因此有研究推测E-box的甲基化极可能参与分子水平的节律性表达[9]。此外大多数E-box都位于CpG岛中,附近其他CpG岛序列的甲基化亦可能调节E-box的节律性功能活动。在肿瘤组织和细胞系中发现一些E-box和CpG岛在发育过程中被甲基化[10-13]。本实验组前期实验[14]结果也表明mPer1的E-box3和E-box4发生明显甲基化。
为更好地了解甲基化在E-box和BMAL1/CLOCK异源二聚体相互作用中是否起调节作用以及甲基化是否在MKP1的组织特异性表达中起决定作用,本研究将采用重硫酸盐基因组测序法检测mPer2、mCry1、mDBP和mMKP1启动子区含E-box的CpG岛的甲基化形式。结果表明甲基化与所有E-box与BMAL1/CLOCK异源二聚体的节律性结合无关,大部分含E-box的CpG岛也与甲基化无关。
1 材料与方法
1.1 实验动物
雄性C57 BL/6J小鼠18只,8周龄,体质量18~20 g,由军事医学科学实验动物中心提供,实验动物许可证号:SCXK-(军)-2007-004。
1.2 主要试剂、药物和器械
QIAamp DNA mini试剂盒(美国Qiagen公司),Wizard DNA纯化试剂盒(美国 Promega公司),HS Taq(日本Takara公司)。
1.3 动物分组与实验处理
小鼠按如下条件饲养2周:饮食、饮水自由,早8:00开灯、晚20:00关灯,12 h照明、黑暗循环。2周后采用数字表法随机分6组,每组3只,从早9:00开始每隔4 h取1组动物的肝脏、肾脏。
1.4 E-box和CpG岛的选择
检测以下基因E-box和旁侧区域CpG岛的甲基化位点:肝脏mPer2、mCry1、mDBP、mMKP1 以及肾脏mMKP1。具体选择5个特定的E-box:mPer2非典型E-box[3]、mCry1 在-270 和-265 之间的 E-box[2]、mDBP2个内含子区域以及mMKP1启动子区E-box[7]。
1.5 制备基因组DNA和重硫酸盐处理
基因组DNA用QIAamp DNA mini试剂盒制备。在重硫酸盐处理过程中所有胞嘧啶将转变为尿嘧啶,而5'甲基化胞嘧啶保持不变。先将基因组DNA用0.3 mmol/L NaOH变性处理,再加入偏亚硫酸氢钠(pH 5.0)和对苯二酚使终浓度分别为3.0 mmol/L和0.5 mmol/L。反应混合物上加矿物油,避光,于50℃孵育16 h。修饰后的DNA用Wizard DNA纯化试剂盒纯化后用0.3 mmol/L NaOH处理15 min,乙醇沉淀。
1.6 扩增、测序
经重硫酸盐处理的DNA样品用HS Taq扩增,选用4个基因CpG岛的引物见表1。将相同基因同一时间点相同组织的3个DNA扩增产物混合,克隆到pGEMT载体,挑选10~15个克隆送北京诺赛基因生物公司测序。相同实验重复3次。
1.7 结果分析
用网上软件(MethPrimer)分析每个基因E-box和周围CpG岛的数目;通过对比所有测序数据,评估每个基因甲基化的状态。

表1 用于重硫酸盐处理后PCR的引物Tab.1 Oligonucleotide primer sequences used in bisulfite PCRs
2 结果
2.1 MethPrimer分析结果
每个基因的E-box及旁侧序列见图1A,用网上软件(MethPrimer)分析E-box中的CpG岛,选择限制:100 bp,CpG岛比率≥0.6。分析结果显示以上5个 E-box均包含一个假定的CpG岛,见图1。
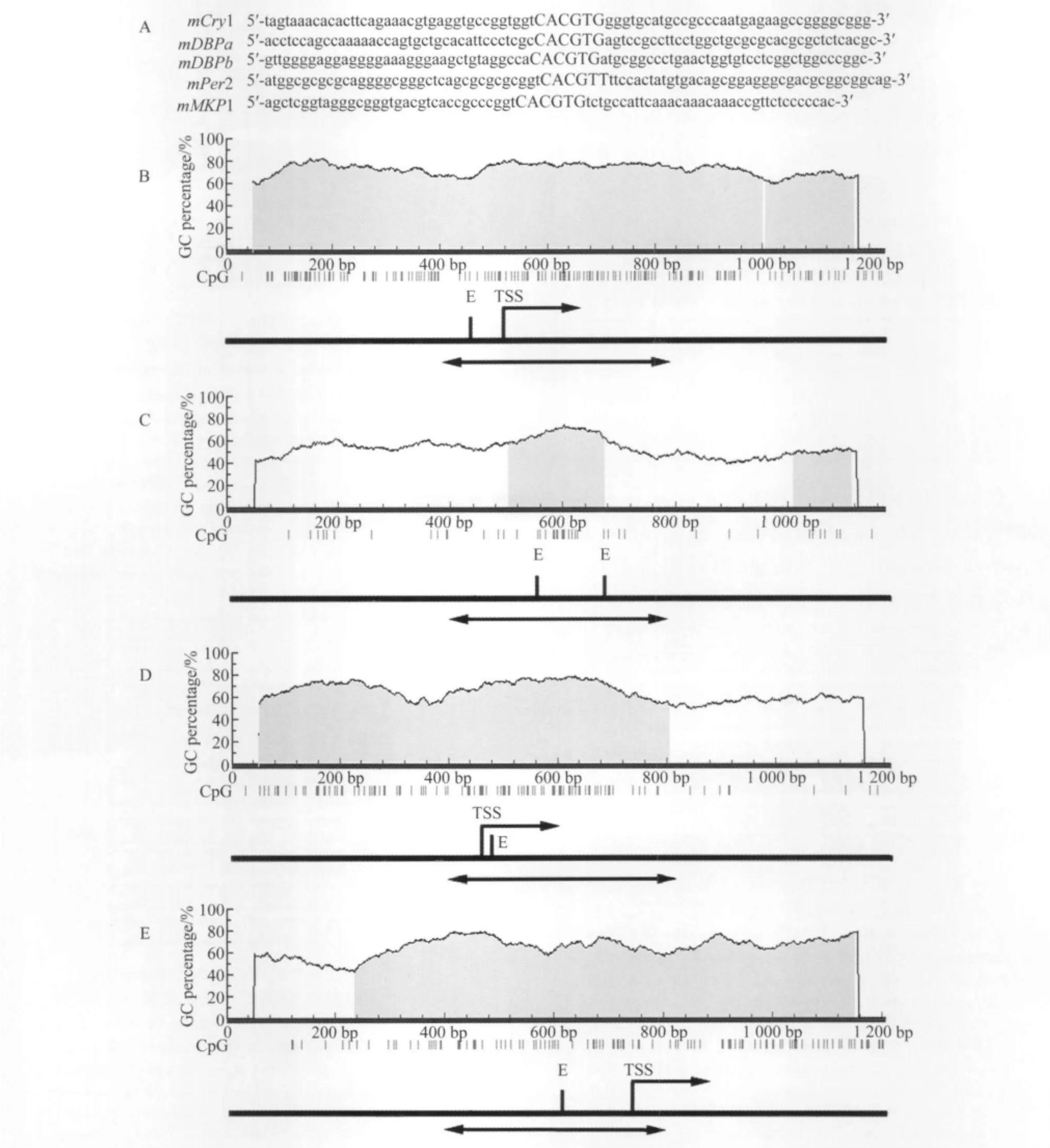
图1 基因启动子区扩增序列汇总Fig.1 Summary of promoter regions subject to bisulfite genomic sequencing
2.2 肝脏中 mCry1、mDBP、mPer2 E-box和周围CpG岛的甲基化状态
重硫酸盐处理基因组DNA测序用于检测E-box和周围CpG岛的甲基化状态。如表2所示,mCry1共检测59个CpG岛,E-box在第3个CpG岛位点;mDBP有22个CpG岛,包含2个E-box分别在第6个和19个CpG岛位点;mPer2有54个CpG岛,E-box在第10个CpG岛位点。

表2 节律基因重硫酸盐处理后PCR产物大小以及CpG岛数目Tab.2 PCR products and number of CpG in every gene
图2、3、4分别显示肝脏中6个时间点mCry1、mDBP、mPer2 E-box的甲基化状态,表明mCry1、mDBP、mPer2 E-box甲基化不明显,而且包含E-box的CpG岛也更大程度表现为非甲基化状态。

图2 肝脏6个时间点mCry1 E-box和周围CpG岛的甲基化状态Fig.2 Examination of methylation status of E-box containing CpG islands in the promoter of mCry1
2.3 肝脏和肾脏中mMKP1 E-box和周围CpG岛的甲基化状态
Cyber分析表明mMKP1的E-box为第22个CpG岛,共有40个CpG岛,如图5所示,测序结果表明在肝脏和肾脏中E-box和周围CpG岛的甲基化无明显差异。
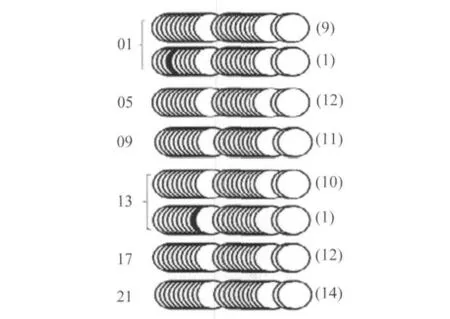
图3 肝脏6个时间点mDBP E-box和周围CpG岛的甲基化状态Fig.3 Examination of methylation status of E-box containing CpG islands in the promoter of mDBP
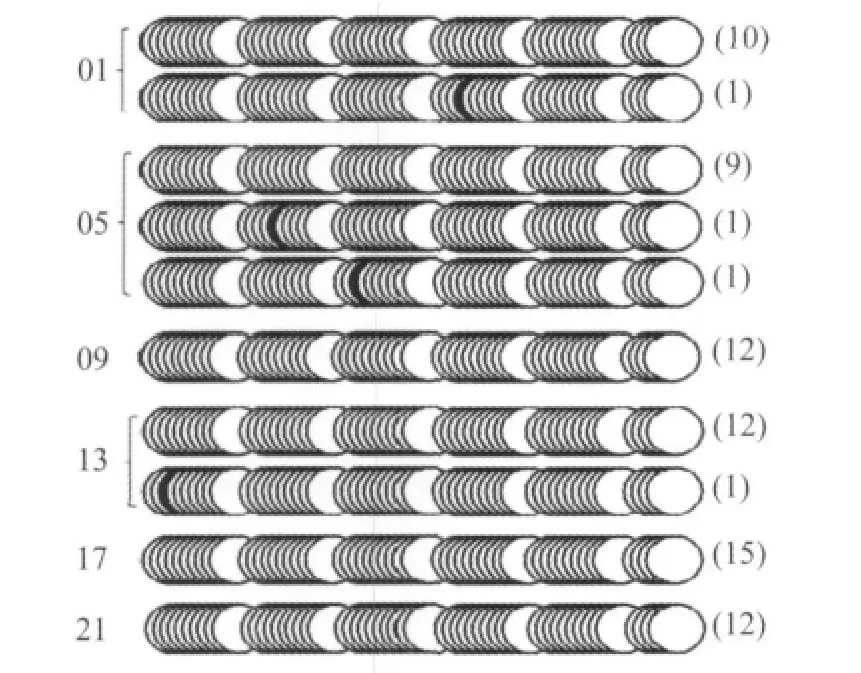
图4 肝脏6个时间点mPer2 E-box和周围CpG岛的甲基化状态Fig.4 Examination of methylation status of E-box containing CpG islands in the promoter of mPer2
3 讨论

图5 肝脏和肾脏01HALO mMKP1 E-box和周围CpG岛的甲基化状态Fig.5 Examination of methylation status of E-box containing CpG islands in the promoter of mMKP1
已有学者[2-5]利用定量染色质免疫沉淀-PCR的方法研究肝脏中BMAL1/CLOCK异源二聚体与mPer1、mPer2、mCry1和mDBP等节律基因的E-box之间的相互作用,这些结果表明BMAL1/CLOCK异源二聚体与不同节律基因的E-box之间的结合方式不同,它们与mPer1、mPer2的E-box 24 h内持续结合,而与mCry1、mDBP的结合呈现日节律变化,与mCry1的结合高峰在HALO 03~09 h,低点在HALO 15~18 h;与DBP的结合高峰在 HALO 05~11 h,低点在 HALO 17~23 h。我们推测mCry1、mDBP的E-box甲基化水平在24 h呈波动性波动,并且影响蛋白和DNA的相互作用;而mPer1、mPer2启动子E-box的甲基化水平保持恒定。由于mPer1 E-box的甲基化状况已有研究组[14]检查过,此次研究主要检测mPer2、mCry1 和mDBP启动子E-box的甲基化水平。本研究的结果中所有E-box无明显甲基化状态,而且包含E-box的CpG岛也更大程度表现为非甲基化状态。这些结果证明在肝脏中DNA甲基化不会影响BMAL1/CLOCK异源二聚体与节律基因mPer2、mCry1和mDBP启动子E-box之间的相互作用。不同启动子与BMAL1/CLOCK异源二聚体结合方式的细微差别的潜在机制将有待于从其他角度进一步研究。
MKP1在SCN和肝脏中的表达是节律性的,但在肾脏中不具有节律性[7]。表明由分子时钟机制控制的MKP1的表达有组织特异性。我们推测肾脏中MKP1启动子的功能性E-box可能被甲基化并保持持续不与BMAL1/CLOCK异源二聚体结合。为检验这一假说的正确性,我们检测肝脏和肾脏中MKP1在HALO 01 h的甲基化状态。Cyber分析结果证实mMKP1的E-box为第22个CpG岛,共有40个CpG岛,测序结果表明在肝脏和肾脏中E-box和周围CpG岛甲基化状态差异无统计学意义。这些结果证实DNA的甲基化不参与MKP1的组织特异性分子时钟调控。
到目前为止,通过微矩阵分析已有数千个时钟控制基因(clock control gene,CCG)被证实[15],而这些CCG中只有一小部分在不同组织中有相同的表达模式,多数CCG因受到组织特异的分子时钟机制的调控在不同组织中有特异性的表达模式,它们多通过E-box和BMAL1/CLOCK异源二聚体的节律性结合来调节基因的表达[16]。本研究组研究结果证实DNA甲基化在CCG的组织特异性调控中并不起决定性作用。
总之,本研究结果和我们的前期研究[14]结果证实节律基因的E-box默认处于非甲基化状态,便于其能与BMAL1/CLOCK异源二聚体相结合。而节律基因组织特异性表达的具体机制有待于进一步研究。
[1]Hida A,Koike N,Hirose M,et al.The human and mouse period1 genes:five well-conserved E-boxes additively contribute to the enhancement ofmPer1 transcription[J].Genomics,2000,65(3):224-233.
[2]Etchegaray J P,Lee C,Wade P A,et al.Rhythmic histone acetylation underlies transcription in the mammalian circadian clock[J].Nature,2003,421(6919):177-182.
[3]Yoo S H,Ko C H,Lowrey P L,et al.A noncanonical E-box enhancer drives mouse Period2 circadian oscillations in vivo[J].Proc Natl Acad Sci USA,2005,102(7):2608-2613.
[4]Ripperger J A,Schibler U.Rhythmic CLOCK-BMAL1 binding to multiple E-box motifs drives circadian Dbp transcription and chromatin transitions[J].Nat Genet,2006,38(3):369-374.
[5]Lee C,Etchegaray J P,Cagampang F R,et al.Posttranslational mechanisms regulate the mammalian circadian clock[J].Cell,2001,107(7):855-867.
[6]Sothern R B.Time of day versus internal circadian timing references[J].J Infus Chemother,1995,5(1):24-30.
[7]Doi M,Cho S,Yujnovsky I,et al.Light-inducible and clock-controlled expression of MAP kinase phosphatase 1 in mouse central pacemaker neurons[J].J Biol Rhythms,2007,22(2):127-139.
[8]Liu S,Cai Y,Sothern R B,et al.Chronobiological analysis of circadian patterns in transcription of seven key clock genes in six peripheral tissues in mice[J].Chronobiol Int,2007,24(5):793-820.
[9]Munoz E,Baler R.The circadian E-box:when perfect is not good enough[J].Chronobiol Int,2003,20(3):371-388.
[10]Yeh K T,Yang M Y,Liu T C,et al.Abnormal expression of period 1(PER1)in endometrial carcinoma[J].J Pathol,2005,206(1):111-120.
[11]Hsu M S,Huang C C,Choo K B,et al.Uncoupling of promoter methylation and expression of period1 in cervical cancer cells[J].Biochem Biophys Res Commun,2007,360:257-262.
[12]Kuo S J,Chen S T,Yeh K T,et al.Disturbance of circadian gene expression in breast cancer[J].Virchows Arch,2009,454(4):467-474.
[13]Ji Y,Qin Y,Shu H,et al.Methylation analyses on promoters ofmPer1,mPer2,andmCry1 during perinatal development[J].Biochem Biophys Res Commun,2010,391(4):1742-1747.
[14]Cai Y,Liu S,Sothern R B,et al.Expression of clock genes Per1 and Bmal1 in total leukocytes in health and Parkinson's disease[J].Eur J Neurol,2010,17(4):550-554.
[15]Lowrey P L,Takahashi J S.Mammalian circadian biology:elucidating genome-wide levels of temporal organization[J].Annu Rev Genomics Hum Genet,2004,5:407-441.
[16]Zhang J,Dong X,Fujimoto Y,et al.Molecular signals of Mammalian circadian clock[J].Kobe J Med Sci,2004,50(3):101-109.

