672名不同年龄段妇女骨密度和护骨素等骨代谢生化指标的变化及其意义
方团育,廖二元,伍贤平,张 红,高勇义
(1.海南省人民医院内分泌科,海口570311;2.中南大学湘雅二院代谢内分泌研究所,海口410011)
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是严重危害中老年妇女健康的疾病,为了更好地做好该病的防治工作,需要早期预测骨质量变化及骨折的检测手段。骨密度(bone mineral density,BMD)不能及时地反映全身骨骼正在进行的代谢活动和反映骨转换的速率[1]。骨生化指标能直接反映骨转换的变化,可以在骨量明显丢失之前就提示患者的骨转换水平,并能间接反映整体的骨丢失情况[1-5]。本研究拟通过大规模的横断面流行病学研究来探讨女性血清护骨素(serum osteoprotegrin,sOPG)、血清骨钙素(bone gla protein,sBGP)和尿脱氧吡啶啉/尿肌酐(urinary deoxypyridino line crosslinke/creatinine,uDPD/Cr)与绝经、绝经年限和BMD之间的关系。现报道如下。
1 资料与方法
1.1 一般资料 长沙地区女性志愿者 672名,年龄20~80岁,平均(45.2±14.7)岁,绝经年龄(48.4±3.8)岁,体质量指数(22.59±3.10)kg/m2。详细询问现婚育、月经、家族及个人病史等,并进行身高、体质量、血压、脉搏等检测。排除影响骨代谢的内分泌疾病(糖尿病、甲状腺和甲状旁腺功能改变等),慢性肝、肾疾病,骨关节病,近期骨折及服用影响骨代谢药物的志愿者[6]。按是否绝经分3组,绝经前组344名(33.10±7.95)岁,围绝经期组 57名(48.02±3.08)岁,绝经后组 271名(59.72±7.39)岁。绝经后组中,根据绝经年限分为4个阶段:<4年,46例,(51.35±3.72)岁;≥4~10年,76例,(55.00±4.31)岁;≥10~20年,102例,(62.64±3.52)岁和≥20年,47例,(69.24±5.29)岁。并根据绝经及绝经年限的分组进行逐级的比较,观察各组BMD及其他指标的改变幅度。
1.2 检测方法 留取空腹静脉血和第2次晨尿(避光),分离血清及尿标本后,置于-70℃冰箱保存,统一用酶联免疫法(ELISA)方法检测(Bio-Tek公司酶标仪)。sOPG采用Biomedia Gruppe公司的ELISA测定[批内变异系数(coefficient of variation,CV)CV6.4%,批间 CV 8.2%],sBGP采用 Diagnostic Systems Laboratories公司的ELISA盒测定(批内CV 4.6%,批间CV8.0%),uDPD用Quidel公司的 ELISA盒测定(批内CV4.8%,批间CV8.4%),尿Cr用 Hitachi 7170A全自动生化分析仪分析,用于较正uDPD。骨密度测定:用Hologic QDR-4500A型扇形束DEA仪,测量腰椎正位总体、腰椎侧位中间区、左侧股骨颈和髋部 BMD。该仪器的长期 CV为0.33%~0.40%[7]。
1.3 统计学处理 应用SPSS11.0软件进行统计学分析。计量资料以±s表示,组间采用χ2检验,两均数用t检验。一般相关用直线相关(Pearson)分析。P<0.05为差异有统计学意义。
表1 腰椎正位和腰椎侧位中间区BM D(g/cm2)在绝经前后的比较(±s)
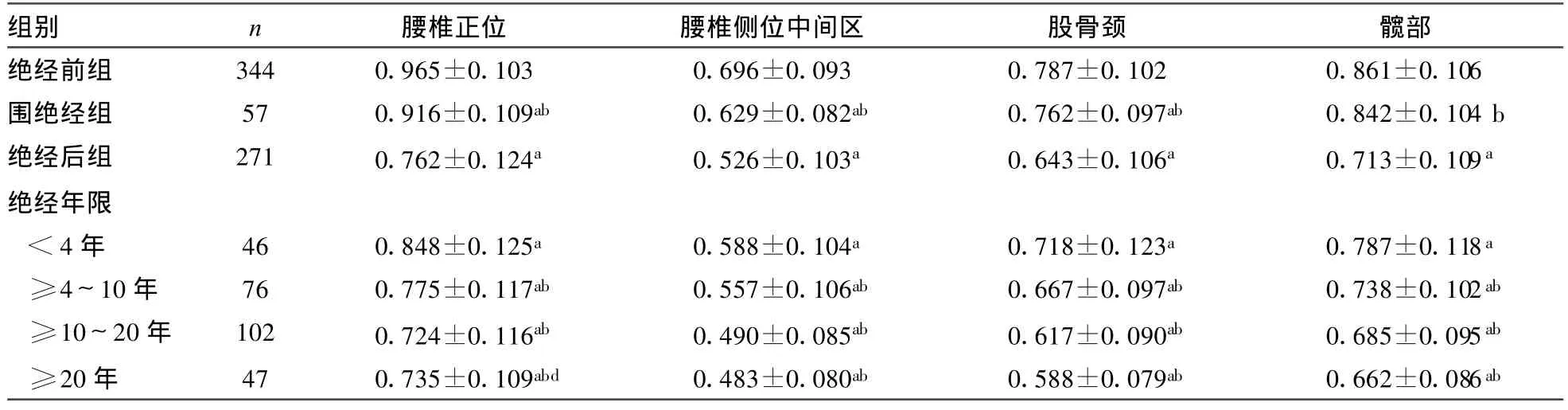
表1 腰椎正位和腰椎侧位中间区BM D(g/cm2)在绝经前后的比较(±s)
a:P<0.05,与绝经前组比较;b:P<0.05,与绝经年限(<4年)组比较。d:P<0.05,与绝经年限(≥10~20年)组比较。
组别 n 腰椎正位 腰椎侧位中间区 股骨颈 髋部绝经前组 344 0.965±0.103 0.696±0.093 0.787±0.102 0.861±0.106围绝经组 57 0.916±0.109ab 0.629±0.082ab 0.762±0.097ab 0.842±0.104 b绝经后组 271 0.762±0.124a 0.526±0.103a 0.643±0.106a 0.713±0.109a绝经年限<4年 46 0.848±0.125a 0.588±0.104a 0.718±0.123a 0.787±0.118a≥4~10年 76 0.775±0.117ab 0.557±0.106ab 0.667±0.097ab 0.738±0.102ab≥10~20年 102 0.724±0.116ab 0.490±0.085ab 0.617±0.090ab 0.685±0.095ab≥20年 47 0.735±0.109abd 0.483±0.080ab 0.588±0.079ab 0.662±0.086ab
表2 绝经前后 sOPG、sBGP和uDPD/Cr的比较(±s)
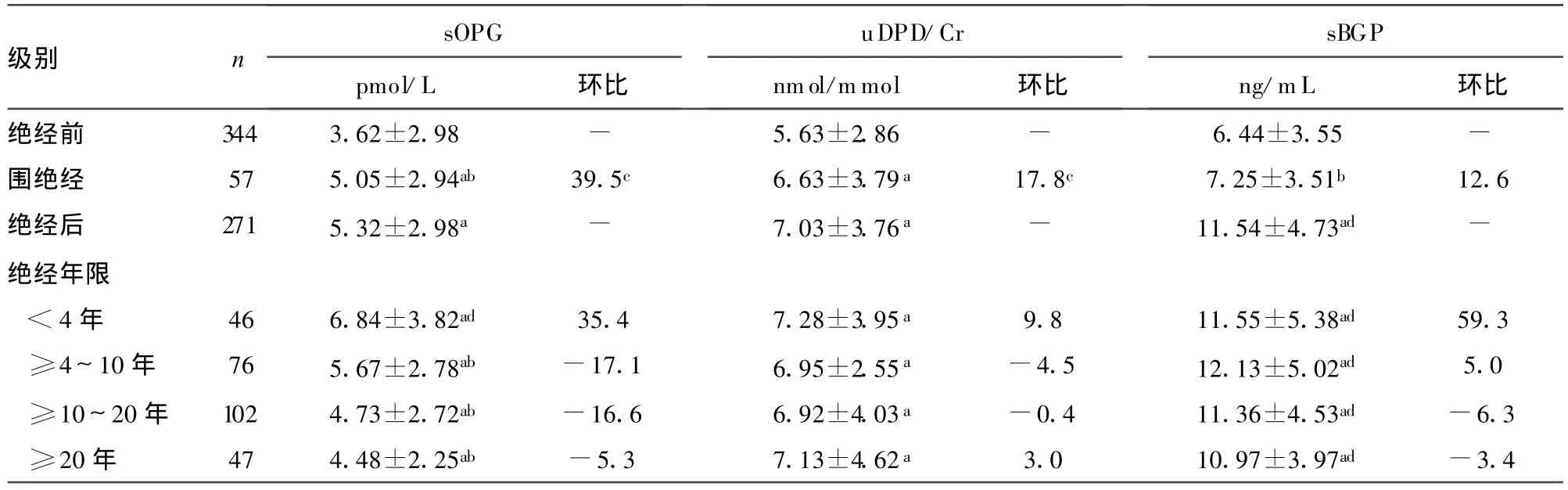
表2 绝经前后 sOPG、sBGP和uDPD/Cr的比较(±s)
a:P<0.05与绝经前组比较;b:P<0.05,与绝经年限(<4年)组比较;d:P<0.05,与围绝经组比较;-:表示无数据。
级别 n sOPG pmol/L 环比uDPD/Cr nmol/mmol 环比sBGP ng/mL 环比绝经前 344 3.62±2.98 - 5.63±2.86 - 6.44±3.55 -围绝经 57 5.05±2.94ab 39.5c 6.63±3.79a 17.8c 7.25±3.51b 12.6绝经后 271 5.32±2.98a - 7.03±3.76a - 11.54±4.73ad -绝经年限<4年 46 6.84±3.82ad 35.4 7.28±3.95a 9.8 11.55±5.38ad 59.3≥4~10年 76 5.67±2.78ab -17.1 6.95±2.55a -4.5 12.13±5.02ad 5.0≥10~20年 102 4.73±2.72ab -16.6 6.92±4.03a -0.4 11.36±4.53ad -6.3≥20年 47 4.48±2.25ab -5.3 7.13±4.62a 3.0 10.97±3.97ad -3.4
2 结 果
2.1 各部位BMD绝经前后的变化(表1)。腰椎正位和腰椎侧位中间区BM D的下降从围绝经期开始(P=0.002,0.000);腰椎侧位中间区BMD的快速骨丢失期在围绝经期及10~20年(分别为9.6%和12.0%),腰椎正位、股骨颈和髋部BM D在绝经1年后至20年间保持较高的骨丢失速率。
2.2 sOPG、sBGP和 uDPD/Cr在绝经前后的变化(表 2)。sOPG和uDPD/Cr的围绝经和绝经后比绝经前低(P<0.05);sOPG的绝经年限组间存在差异(P<0.05);围绝经期是sOPG和 uDPD/Cr增加最快的时期(分别为 39.5%和17.8%);sBGP的增加最快时期在绝经后 1~4年组(为59.3%)。
2.3 直线相关分析示:BGP、uDPD/Cr与绝经年限不相关,sOPG及腰椎正位、腰椎侧位中间区、股骨颈和髋部BMD与绝经年限均呈负相关(r值分别为-0.234、-0.298、-0.421、-0.399和-0.382,P=0.000)。
3 讨 论
3.1 BM D与绝经及绝经年限的关系 女性一生中骨代谢处于不断更新的变化中。绝经、绝经年限和各部位BMD存在负相关,是骨代谢的重要影响因素。进入绝经期后,由于增龄和卵巢功能的下降[8-9],骨吸收的速度明显超过骨形成,各部位的BMD迅速减少,且在绝经1~20年均保持较高的骨丢失速率,以后骨量丢失趋于缓慢。绝经引起的骨丢失主要以骨松质为主[10],且各部位骨松质、骨密质比例不同,显示了不同部位骨丢失速度的差异[11],因此,各部位的骨量快速丢失期不完全一致;本研究显示,腰椎侧位中间区BMD的骨量快速丢失期在围绝经期和绝经后10~20年,腰椎正位、股骨颈和髋部在绝经后1~20年,也说明机体1个部位的骨丢失率不能用来代表其他部位的骨丢失率。而长时期的骨快速丢失速率也提示,PMOP的防治需长期进行。
本研究结果显示,绝经前和围绝经期女性的腰椎部位BMD改变较早,且腰椎侧位中间区BMD骨量快速丢失期在围绝经期较明显,是早期发现绝经后骨丢失的最好部位。因此,应以测量腰椎侧位中间区BMD为主;而绝经年限大于或等于20年时则因为老年性的腰椎骨质增生、腹主动脉钙化和骨关节炎等影响[12-14],腰椎正位的BMD会有一定程度的回升,因此,采用腰椎正位不合适。提示不同年龄段和绝经年限的女性,其BMD扫描部位应该有所侧重。
3.2 sOPG、sBGP和uDPD/Cr与绝经及绝经年限的关系BGP是由成骨细胞分泌的1种小分子非胶原蛋白[1,3,15],反映骨形成状况。而DPD是Ⅰ型胶原分子之间构成胶原纤维的非还原性共价交联物,能直接反映骨吸收状况[16-17]。在骨骼的OPG主要由成骨细胞谱系的细胞产生,其作用是结合并中和骨细胞膜上的核因子κ B受体活化因子配基(receptor activator of NF-κ B ligand,RANKL),抑制前体破骨细胞分化、生存、融合与活化,诱导成熟破骨细胞凋亡,是破骨细胞负性调节因子[18-20],测定血清中OPG的变化,可敏感地反映骨的代谢变化[21-23]。本研究显示,绝经、绝经年限是影响 sBGP、uDPD/Cr和sOPG的重要因素,且sOPG水平与和绝经年限变化相关(r=-0.234;P=0.000)。绝经后妇女雌激素水平降低,对骨吸收的抑制作用减弱,并反馈引起成骨细胞数量及功能增加,以抵消破骨细胞的活动,最终骨形成指标也增加[24-25],因而绝经后的骨代谢为高转换性,表现在 3个指标均急剧升高[15-16,26],绝经前后的测定值差异明显,且uDPD/Cr和 sOPG的快速改变(围绝经期)较sBGP(绝经1~4年组)出现早;而这种高转换状况在绝经后20年内仍是如此;且随着绝经年限的进一步延长(≥20年),骨吸收指标uDPD/Cr基本保持恒定,而骨形成减弱,sBGP和sOPG轻度下降。与Yano等[21]及肖丽平与邱明才[27]的研究一致。
本研究结果看出,sOPG与uDPD/Cr的快速改变时期均在围绝经期,最高点在绝经年限小于4年时期,而sBGP在绝经年限小于4年增加最快,≥4~10年时期达;且sOPG在绝经前后、绝经年限分组的改变幅度高于uDPD/Cr,仅sOPG与绝经年限存在相关性;绝经年限的组间比较中,只有sOPG的各组间比较差异有统计学意义;提示sOPG与uDPD/Cr的变化较sBGP早,达峰时间较快,sOPG与uDPD/Cr(尤其 sOPG)能敏感地反映绝经前后骨代谢变化。
另外,sOPG和uDPD/Cr统计学意义上的改变早于腰椎正位、股骨颈和髋部这3个部位的BM D变化,与腰椎侧位中间区BMD相同;sBGP则与腰椎正位、股骨颈和髋部相一致。从绝经年限分组来看,围绝经期是sOPG和uDPD/Cr增加最快的时期(分别为39.5%和17.8%),也较腰椎正位、股骨颈和髋部这3个部位的骨快速丢失期早出现。
综上所述,腰椎、股骨颈和髋部各部位的BMD在绝经后均迅速减少,腰椎侧位中间区 BMD改变较早。对不同年龄段和绝经年限的女性,其BMD扫描部位应该有所侧重。sOPG、sBGP和uDPD/Cr(尤其sOPG)能敏感、特异地反映妇女随绝经及绝经年限变化的骨转换情况;且sOPG和uDPD/Cr指标的变化先于骨密度,可以预测骨丢失,因此,临床上监测这3个指标能很好地提高骨质疏松的早期防治效率、评价骨质疏松的病情及治疗变化。
[1] Garnero P,Delmas PD.Contribution of bone mineral density and bone turnover markers to the estimation of risk of osteoporotic fracture in postmenopausal women[J].J Musculoskelet Neuronal Interact,2004,4(1):50-63.
[2] Melton LJ 3rd,Crowson CS,O′Fallon WM,et al.Relative contributions of bone density,bone turnover,and clinical risk factors to long-term fracture predictions[J].J Bone Miner Res,2003,18(2):312-318.
[3] Garnero P,Hausherr E,Chapuy MC,et al.Markers of bone resorption predict hip fracture in elderly women:the EPIDOS prospective study[J].J Bone Miner Res,1996,11(10):1531-1538.
[4] Bikle DD.Biochemical markers in the assessment of bone disease[J].Am J Med,1997,103(5):427-436.
[5] Garnero P.Biomarkers for osteoporosis management:utility in diagnosis,fracture risk prediction and therapy monitoring[J].Mol Diagn Ther,2008,12(3):157-170.
[6] Liao EY,Wu XP,Luo XH,et al.Establishment and evaluation of bone mineral density reference databases appropriate for diagnosis and evaluation of osteoporosis in Chinese women[J].J Bone Miner Metab,2003,21(3):184-192.
[7] Liao EY,Wu XP,Deng XG,et al.Age-related bone mineral density,accumulated bone loss rate and prevalence of osteoporosis at multiple sites in Chinese women[J].Osteoporos Int,2002,13(8):669-676.
[8] 杨雪萍,赵纯全.单纯子宫切除术对卵巢功能的影响[J].重庆医学,2007,36(8):753-755.
[9] Gallagher JC.Role of estrogens in the management of postmenopausal bone loss[J].Rheum Dis Clin North Am,2001,27(1):143-162.
[10]Ribot C,Tremollieres F,Pouilles JM.Late consequences of a low peak bone mass[J].Acta Paediatr Suppl,1995,411:31-35.
[11]徐会清,吴宜勇,严颖元,等.绝经后不同时期骨丢失的初步探讨[J].中华妇产科杂志,1998,33(9):542-545.
[12]Yamauchi T,Taketomi E,Matsunaga S,et al.Bone mineral density in patients with ossification of the posterior longitudinal ligament in the cervical spine[J].J Bone Miner Metab,1999,17(4):296-300.
[13]Toussaint ND,Lau KK,Strauss BJ,et al.Associations between vascular calcification,arterial stiffness and bone mineral density in chronic kidney disease[J].Nephrol Dial Transplant,2008,23(2):586-593.
[14]Kim HJ,Lee HM,Kim HS,et al.Bone metabolism in postmenopausal women with lumbar spinal stenosis:analysis of bone mineral density and bone turnover markers[J].Spine,2008,33(22):2435-2439.
[15]Lian JB,Stein GS,Stein JL,et al.Osteocalcin gene promoter:unlocking the secrets for regulation of osteoblast growth and differentiation[J].J Cell Biochem Suppl,1998(30/31):62-72.
[16] Bettica P,Moro L,Robins SP,et al.Bone-resorption markers galactosyl hydroxylysine, pyridineium crosslinks,and hydroxyproline compared[J].Clin Chem,1992,38(11):2313-2318.
[17]Di Stefano M,Formoso F,Tamone C,et al.Short-Term Urine Deoxypyridinoline Biological Variability in the First 5 Years after Menopause[J].Clin Chem,2005,51(11):2189-2192.
[18]Khosla S.Minireview:The OPG/RANKL/RANK System[J].Endocrinology,2001,142(12):5050-5055.
[19]Schoppet M,Preissner KT,Hofbauer LC.RANK Ligand and Osteoprotegerin:Paracrine Regulators of Bone Metabolism and VascularFunction[J].Arteriosclerosis Thromb Vasc Biol,2002,22(4):549-553.
[20]Walsh MC,Choi Y.Biology of the T RANCE axis[J].Cytokine Growth Factor Rev,2003,14(3/4):251-263.
[21]Yano K,Tsuda E,Washida N,et al.Immunological characterization of circulating osteoprotegerin/osteoclastogenesis inhibitory factor:increased serum concentrations in postmenopausal women with osteoporosis[J].J Bone Miner Res,1999,14(4):518-527.
[22]Trofimov S,Pantsulaia I,Kobyliansky E,et al.Circulating levels of receptor activator of nuclear factor-kappaB ligand/osteoprotegerin/macrophage-colony stimulating factor in a presumably healthy human population[J].Eur J Endocrinol,2004,150(3):305-311.
[23]Dai Y,Shen L.Relationships between serum osteoprotegerin,matrix metalloproteinase-2 levels and bone metabolism in postmenopausal women[J].Chin Med J(Engl),2007,120(22):2017-2021.
[24]Hart SM,Eastell R.Biochemical markers of bone turnover[J].Curr Opin Nephrol Hypertens,1999,8(4):421-427.
[25]Watts NB.Clinical utility of biochemical markers of bone remodeling[J].Clin Chem,1999,45(8):1359-1368.
[26]Navarro Casado L,Blázquez Cabrera JA,Del Pino Montes J,et al.Clinical usefulness of biochemical markers of bone turnover in early postmenopausal women:two years longitudinal study[J].Med Clin(Barc),2008,131(9):333-338.
[27]肖丽平,邱明才.正常人尿脱氧吡啶酚的变化及其临床意义[J].中华内分泌代谢杂志,2000,16(5):312-313.

