茶树芽叶花色苷含量测定方法的研究
陈 琼, 陆瑞琼
花青素(anthocyanidin)及其糖苷(anthocyanins)是植物中一大类次级代谢产物,是使植物花朵、果实呈现五彩缤纷颜色的主要水溶性色素,涉及27个科,73个属的数万种植物,分布极为广泛.花青素的结构以C6-C3-C6为基本骨架,见图1[1].目前在植物体内发现的花青素有22种,食品中主要有6种,自然条件下游离状态的花青素极少见,其A环3-,5-,7-碳位上的羟基以糖苷键与糖结合形成花色苷,与花青素结合的糖种类、数量、结合位置不同,花色苷的种类则不相同[2].
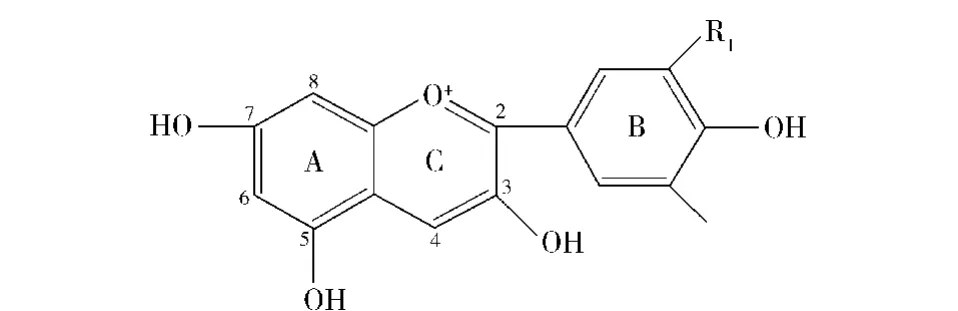
图1 花色苷母核结构Fig.1 Mother nucleus structure of anthocyanins
在自然界的茶树中,常见有部分红紫色芽叶的茶树品种或单株,在高海拔、强光照、夏秋季茶园中,茶树紫芽的发生率较高.花色苷是茶树紫色芽叶的主要特征内含成分,含量远高于绿色芽叶[3].在传统的绿、红等茶叶加工过程中,紫色芽叶由于其滋味苦涩、色泽深暗、花杂等不良品质特征而被剔除.然而,随着多种富含花色苷的天然植物的研究揭示了花色苷具有抗氧化、抗炎、抗肿瘤、抵抗胰岛素调节等的特殊功能活性后,茶叶紫色芽叶的研究开始受到关注.
植物中花色苷单体的准确定量受到花色苷分离纯度的限制,并需要单体标准品作为对照,目前的研究多将花色苷作为一个整体测定其总含量.定量方法根据其光学特性,用紫外 可见分光光度法进行分析,有单一pH法、pH示差法、差减法等.近年来,国外文献中一般用pH示差法分析花色苷含量[4-5].对于茶树芽叶中花色苷的含量测定,目前没有国家标准,而沿用单一pH法进行测定[6].本研究采用单一pH法、pH示差法来测定茶树紫色芽叶的花色苷含量,比较茶树芽叶花色苷含量测定的方法,可为茶树紫色芽叶的开发研究提供基础.
1 方法原理
1.1 单一p H法
植物花色苷的最大吸收波长一般在500~540 nm,而茶树芽叶花色苷的最大吸收波长在520~540 nm.单一pH值法测定花色苷含量需要在一个恒定的pH介质中进行,由于花色苷单体之间差别很小且比例未知,一般用平均比消光度(ε)来测定花色苷总量.茶叶花色苷消光系数按照文献[6]提供数据,为101.83.
1.2 p H示差法[4-5]
pH示差法的依据是花色苷发色基团的结构转换是pH值的函数,且干扰物质的吸收特性不随pH值变化.pH值为1时,花色苷以红色的2-苯基苯并吡喃的形式存在,pH值为4.5时,花色苷以无色的甲醇假碱的形式存在.通过确定两个对花色苷吸光度差别最大,但是对花色苷稳定的pH值(一般选择pH值为1.0和pH值为4.5),在最大吸收波长为700 nm处,花色苷溶液的吸光度差值与花色苷的含量成比例,根据 Fuleki公式可以计算花色苷总量[7].
2 实验部分
2.1 仪器与试剂
UV1200型紫外可见分光光度计,HITACHI公司;FE-20型pH计,梅特勒 托利多公司;HH-6型电子恒温水浴锅,国华电器有限公司.
pH值为1.0缓冲溶液(0.2 mol/L KCl:0.2 mol/L HCl:H2O 为 50∶97∶53(v∶v∶v));
pH值为4.5缓冲溶液(准确称取19.294 g NaAC加入24 mL冰醋酸中,定容至500 mL);
酸性乙醇溶液:85 mL无水乙醇加15 mL 1.5 mol/L盐酸混匀.
2.2 样品
茶叶来源,广东省龙门县南昆山采集茶树紫芽1芽2叶,蒸青、烘干、磨碎、过筛供试验用.
2.3 紫芽茶花色苷含量测定方法
紫芽茶理化测定制样方法参考文献[6]:准确称取1.0 g紫芽茶磨碎干样,加沸水40 mL,在沸水浴中提取30 min,过滤.滤液加水定容至50 mL为供试液.
单一pH法:取2~4 mL供试液于刻度试管中,用酸性乙醇定容至10 mL,摇匀立即显出刚果红色,平衡30 min,如发现有絮状沉淀,可离心弃去沉淀物(2 000~2 500 r/mim,离心5 min),澄清的红色溶液在最大吸收波长下测吸光值,以酸性乙醇为空白对照,计算花色苷含量[6].重复试验3次.花色苷质量分数(mg/g) =
pH示差法:取5 mL上述供试液,分别用pH值为1.0和pH值为4.5的缓冲溶液定容至10 mL.待平衡后在最大吸收波长下测吸光值,计算花色苷含量.重复试验3次.当样品花色苷单体成分未知时,一般用在植物中最为普遍的花色苷矢车菊-3-葡萄糖苷作为标准物[8].
花色苷质量分数=
(A/εL) ×MW×DF ×V/Wt×100.
式中 A——吸光值;L——光程,1 cm;
ε——矢车菊-3-葡萄 糖苷的消 光 系 数,26 900;
MW——矢车菊-3-葡萄糖苷的分子量,449.2;
DF——稀释因子;
V——最终体积,mL;
Wt——产品质量,mg;
A=(A535pH1.0-A700pH1.0)-(A535pH4.5-A700pH4.5).
2.4 数据分析
实验数据以x±s表示,用 SPSS Statistics 17.0软件进行均值显著性差异分析.
3 结果与分析
3.1 最大吸收波长的确定
一般花色苷特征吸收波长在520~540 nm,将pH值为1.0的花色苷待测液在500~700 nm波长范围内进行可见光扫描,结果见图2,确定茶树紫芽花色苷最大吸收波长为530 nm.
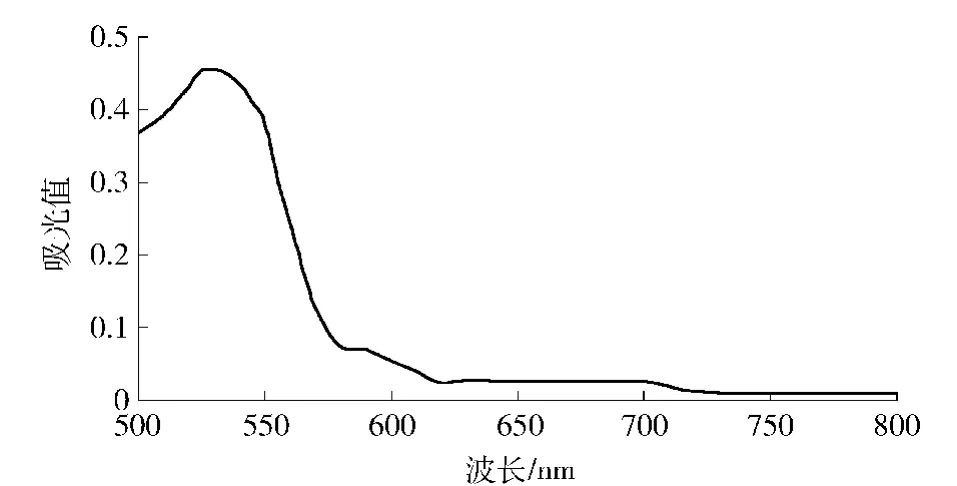
图2 紫芽茶花青素的可见光谱Fig.2 Visible absorption spectrum of anthocyanins from purple tea leaves
3.2 平衡时间的确定
对pH值为1.0和pH值为4.5花色苷待测液在530 nm处进行可见光扫描,结果见图3、图4.根据时间 吸光值曲线确定平衡时间.花色苷在pH值为1.0的缓冲溶液中,随着时间延长,吸光值缓慢上升,在65 min后基本稳定(A值变化<1%).花色苷在pH值为4.5的缓冲溶液中,随着时间延长吸光值变化不大.
因此,确定平衡时间为65 min.

图3 pH值为1.0时花色苷吸光值随时间变化光谱扫描图Fig.3 Visible absorption spectrum of anthocyanins at pH 1.0
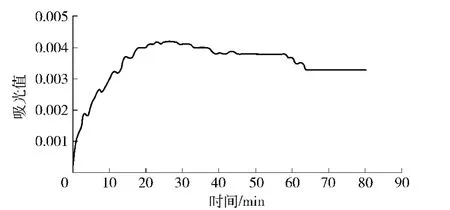
图4 pH值为4.5时花色苷吸光值随时间变化光谱扫描图Fig.4 Visible absorption spectrum of anthocyanins at pH 4.5
3.3 花色苷含量的测定
对于5株茶树紫芽茶芽叶,分别用单一pH法和pH示差法测花色苷含量,结果见表1.

表1 单一pH法和pH示差法测紫芽茶花色苷含量结果Tab.1 Determination of anthocyanins content by single-pH method and pH-differential spectrophotometry
单一pH法与pH示差法对紫芽茶花色苷含量测定存在显著差异(P<0.05),对于同一单株,单一pH法所测花色苷含量较pH示差法高5倍多.不同单株之间花色苷含量存在显著差异(P<0.05).
3.4 单一pH法与pH示差法测花色苷含量的相关性分析
对单一pH法与pH示差法测花色苷含量的相关性分析显示,两种方法之间具有良好的线性关系,回归方程y=0.129 8x+0.000 3,R2=0.992 7(见图5).
4 结 论
对5株紫芽茶单株采用单一pH法和pH示差法测定花色苷含量,结果表明,单一pH法所测结果均高于pH示差法,两者存在良好线性关系.
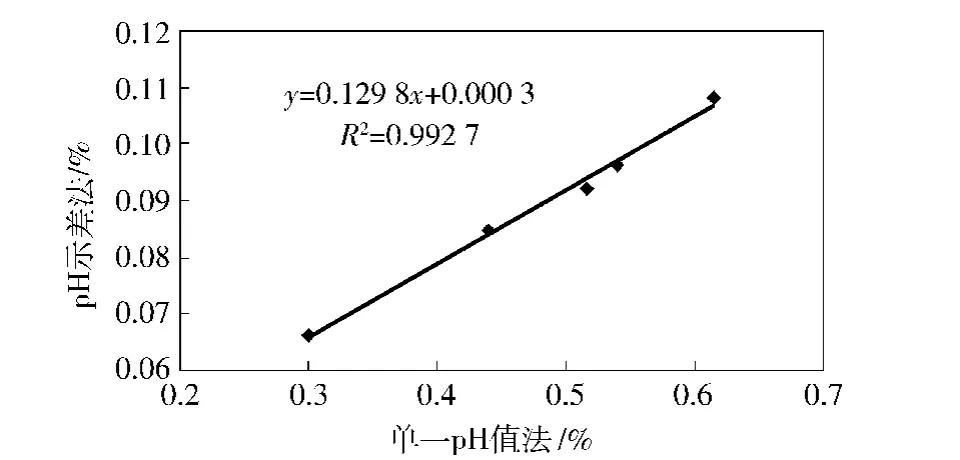
图5 单一pH法和pH示差法测紫芽茶花色苷相关性分析Fig.5 Correlation analysis between single-pH method and pH-differential spectrophotometry on determination of anthocyanins content
单一pH法测定花色苷的波长为530 nm,而类黄酮的吸收波长为350~380 nm,因此,本法不受黄酮苷、儿茶素的干扰.但受到茶叶中花白素的影响,花白素在酸性条件下会降解为花色苷,使实验结果比实际值增大.pH示差法可以避免干扰物质因具有与花色苷相同的能量吸收范围而造成含量的影响.但受两个不同pH值下两种花色苷存在形态的平衡转化率的影响,花色苷测量值会略低于实际值.
高效液相色谱技术虽能准确地测定花色苷单体含量,但要对样品花色苷进行分离纯化,并需要花色苷单体标准品,而花色苷标准品的不稳定,或是不明确样品中的花色苷单体组成,该方法的使用则受到限制.
综上所述,本研究采用的pH示差法测定茶叶鲜叶样品中的花色苷总含量,能消除干扰物质对测定结果的影响,便于与其他来源植物花色苷含量的比较,可为茶树芽叶的花色苷定量分析提供依据.
——霜冻芽叶产品研发思路与实践

