Red重组系统在克雷伯氏肺炎杆菌中的应用研究
莫隽颖,陶 冶,周佳佳,高黎荣,付水林,宫 衡
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
目前,克雷伯氏肺炎杆菌基因敲除的相关研究多为利用oriR6K型自杀质粒的传统敲除方法[1~4],其实验周期较长,且整合到受体菌株基因组上的抗性标记无法去除,不适用于多基因突变的研究。
Datsenko等[5]构建了一套适用于E.coliK-12菌株靶基因快速敲除的Red重组质粒系统。该系统需要3类质粒,分别是:表达Exo、Beta、Gam蛋白的协助同源重组质粒pKD46、pKD20等;两侧含FRT位点的抗性基因的质粒pKD3、pKD4、pKD13;受诱导表达FLP重组酶以消除基因组上同源重组抗性基因的质粒pCP20。利用Red重组质粒系统敲除靶基因的主要流程是:(1)以pKD3/pKD4为模板,设计含40~60 bp靶基因的同源序列引物,PCR扩增含FRT位点的抗性基因(打靶片段);(2)将打靶片段转化到已表达Red重组酶的宿主中,抗性筛选阳性克隆;(3)将pCP20导入筛选出的重组子中,诱导FLP重组酶表达,移除抗性标记。Red重组质粒系统已被证实也能在其它一些菌株中有效地敲除靶基因[6,7],但目前尚没有Red重组系统在克雷伯氏肺炎杆菌中应用的报道。作者在此以荚膜基因wzi作为敲除对象[8,9],研究了Red重组系统在克雷伯氏肺炎杆菌中的敲除效果。
1 实验
1.1 菌株与质粒
K.pneumoniae,自行筛选。
E.coliDH5α、 pKD46、 pKD4、 pCP20,自行保存;载体pMD18T、质粒pBR322,TaKaRa公司。
1.2 限制性内切酶与主要试剂
XmnⅠ限制性内切酶,Fermentas公司;T4连接酶、DL 10 000TMDNA Marker,TaKaRa公司;2×TaqPCR MasterMix、2×TaqPlus PCR MasterMix、DNA MarkerⅢ、细菌基因组DNA抽提试剂盒、质粒小量提取试剂盒、琼脂糖凝胶回收试剂盒,北京天根公司;其它试剂均为国产分析纯。
1.3 细菌培养、电转化及PCR方法
参见《分子克隆》。
1.4 引物设计
实验所用引物由英潍捷基(上海)贸易有限公司合成,见表1。

表1 实验中所用的引物
1.5 适用于克雷伯氏肺炎杆菌的Red重组系统的构建
由于K.pneumoniae菌株本身含有Amp抗性,故pKD46与pCP20质粒不能直接用于该菌株的基因敲除实验,需要对其改造。通过序列查找发现这两个质粒的Amp抗性基因上有一个XmnⅠ限制性酶切位点,且整个质粒中该位点只有一个[10],在该位置插入其它抗性基因可以使这两个质粒具有新的抗性标记,同时去除了Amp抗性标记。构建方案见图1。
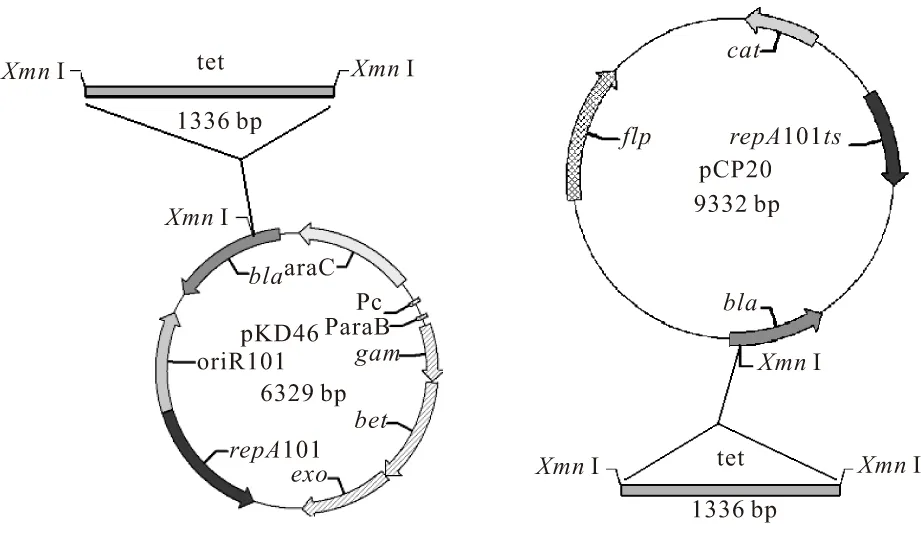
图1 pKD46-Tc和 pCP20-Tc的构建
首先扩增适合的抗性基因。以pBR322质粒为模板,设计其四环素抗性基因的引物F-tet和R-tet,两端加上XmnⅠ酶切位点,PCR扩增tet基因,胶回收tet片段,连到pMD18 T载体后转化至DH5α感受态细胞中,涂LB平板(含盐酸四环素20 μg·mL-1),37 ℃过夜培养12~16 h;次日挑取单克隆扩增后抽质粒,用XmnⅠ酶切鉴定重组质粒tet-pMD18T。
用T4连接酶将片段tet分别与同样经XmnⅠ酶切的pKD46和pCP20 连接,将连接产物转化至DH5α感受态细胞中,涂LB平板(含盐酸四环素20 μg·mL-1),30 ℃过夜培养16~20 h,挑取单克隆扩增后抽质粒,用XmnⅠ酶切鉴定重组质粒pKD46-Tc和pCP20-Tc。
将pKD46-Tc转化到K.pneumoniae菌株中,涂LB平板(含盐酸四环素20 μg·mL-1),30 ℃培养过夜,得到的K.pneumoniae/pKD46-Tc菌株阳性克隆,根据pKD46质粒上exo-bet-gam基因设计引物F-46和R-46,进行菌落PCR鉴定。
1.6 二步PCR法扩增片段△wzi::FK
由于直接合成同源臂的成本较高且长度有限,故采用二步PCR的方法来扩增得到重组片段[6]。以pKD4质粒为模板,设计引物F-FRT和R-FRT,扩增两端含FRT位点的kan抗性基因片段FK(约1500 bp)。确定同源臂为250 bp,设计wzi片段的上游250 bp序列的两端引物Fup-wzi和Rup-wzi::FRT,反向引物的5′端加入F-FRT的序列,wzi片段下游250 bp序列的两端引物Fdown-FRT::wzi和Rdown-wzi,正向引物的5′端加入R-FRT的序列,以wzi-pMD18T为模板扩增。将PCR扩增得到的3个片段up-wzi、down-wzi、FK按物质的量比1∶1∶1混合作为模板,以Fup-wzi和Rdown-wzi为引物,扩增片段△wzi::FK(1981 bp)。
1.7 wzi基因缺失阳性重组子的获得
制备K.pneumoniae/pKD46-Tc电转化感受态细胞,加20 mmol·L-1L-阿拉伯糖,30 ℃诱导Red重组酶表达2.5 h。电转化体系为5 μL △wzi::FK片段+100 μLK.pneumoniae/pKD46-Tc感受态细胞,电转化条件2500 V、5~6 ms,转化后涂LB板(含卡那霉素20 μg·mL-1),37 ℃过夜培养。以wzi上下游外侧的序列设计重组子鉴定引物Fupout-wzi和Rdownout-wzi,菌落PCR鉴定基因敲除的效果。
2 结果与讨论
2.1 重组质粒tet-pMD18T的构建
tet基因的PCR产物及tet-pMD18T的XmnⅠ酶切片段见图2。

1.tet基因的PCR产物 2、3.tet-pMD18T的XmnⅠ酶切片段M.DNA MarkerⅢ
由图2可看出,重组质粒tet-pMD18T的酶切片段有3个。这是因为,pMD18T质粒本身含有一个XmnⅠ酶切位点,中间那条1300 bp左右的片段为tet片段。
2.2 重组质粒pKD46-Tc与pCP20-Tc的构建
重组质粒pKD46-Tc和pCP20-Tc的酶切鉴定结果见图3。
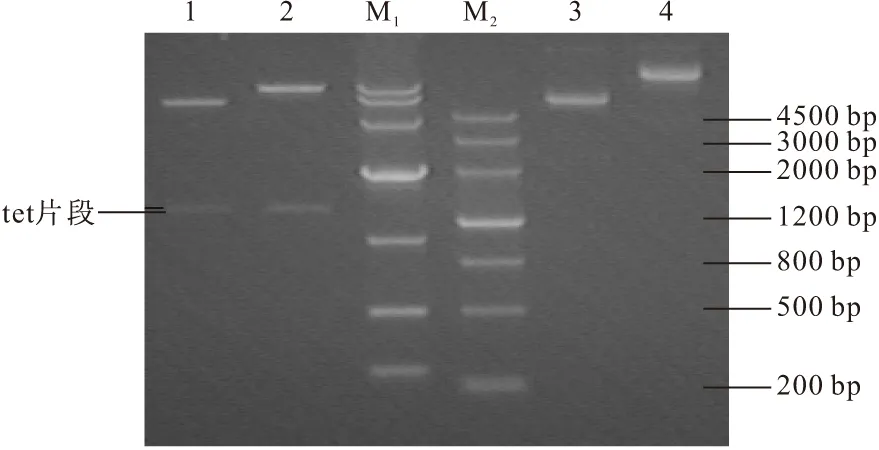
1.pKD46-Tc digested by XmnⅠ 2.pCP20-Tc digested by XmnⅠ 3.pKD46-Tc plasmid 4.pCP20-Tc plasmid M1.DL 10 000TM DNA Marker M2.DNA MarkerⅢ
在图3中2000~1000 bp的位置能看到一条目的片段。由于重组质粒pKD46-Tc和pCP20-Tc是低拷贝质粒,量较少,所以酶切的片段不是太明显。由于克隆的是Tc抗性基因,菌体能在Tc抗性的培养基中生长,表明该基因已成功表达,故不测序。
2.3 K.pneumoniae/pKD46-Tc菌株的筛选(图4)

1~11.the 11 monoclones 12.pKD46-Tc plasmid(positive) 13.K.pneumoniae(negative) M.DNA MarkerⅢ
由图4可以看出,1#~10#阳性克隆均有相似大小的条带,11#克隆没有条带,12#阳性对照有明显的目的片段(1922 bp),13#阴性对照无条带。表明1#~10#均转入了pKD46-Tc,得到了K.pneumoniae/pKD46-Tc菌株。
2.4 二步PCR法扩增片段△wzi::FK(图5)

1.up-wzi 2.down-wzi 3~12.退火温度(℃):45、46.2、47.4、50.2、53.1、40、44、48.8、51.2、53.6 M.DNA MarkerⅢ
由图5a可以看出,up-wzi和down-wzi片段的大小在250 bp左右处,与理论位置相符。由图5b可以看出,在1500 bp左右有明显的条带,应为FK片段,且随退火温度的升高条带亮度逐渐增强。估算up-wzi浓度约为60 ng·μL-1、down-wzi浓度约为20 ng·μL-1、FK浓度约为10 ng·μL-1。由图5c可以看出,除了目的条带△wzi::FK(1981 bp)外还有一些非特异条带。胶回收图中2000 bp左右的条带,考虑到以此条带为模板PCR扩增的效果不好,存在较多非特异性条带,扩增前需要将该片段与T载体相连进行亚克隆。
2.5 wzi基因缺失重组子的鉴定
卡那霉素抗性平板上长出9个克隆,用引物Fupout-wzi和Rdownout-wzi PCR鉴定,结果见图6。
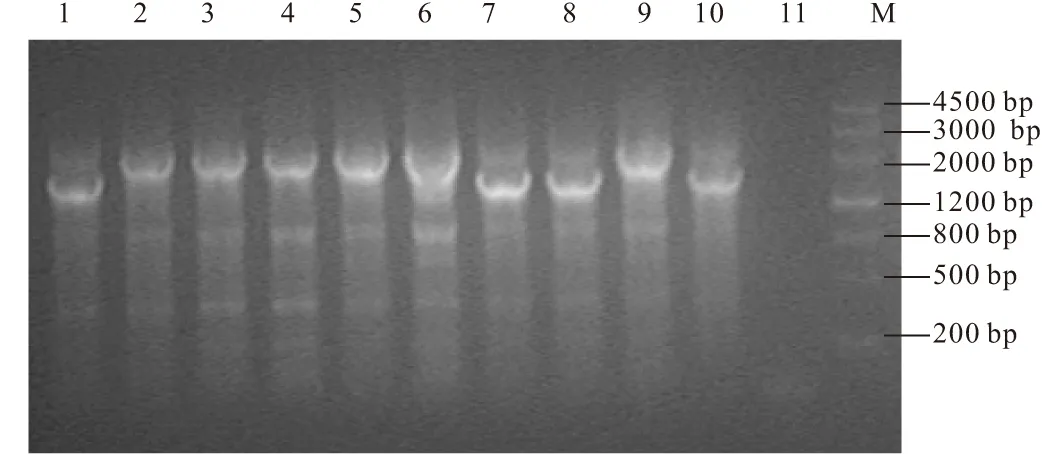
1~9.阳性克隆 10.K.pneumoniae genome DNA(未敲除的基因对照) 11.ddH2O(阴性对照) M.DNA MarkerⅢ
未敲除的原始序列PCR产物应该在1500 bp左右的位置,理论上重组子PCR产物应该在2000 bp左右的位置。由图6可以初步确定9个克隆中有6个是wzi基因敲除的重组子,其余3个克隆为假阳性。
3 结论
通过构建含四环素抗性标记的重组质粒pKD46-Tc和pCP20-Tc,建立了一套能在K.pneumoniae菌株中运用的Red重组系统,以荚膜基因中的高保守wzi基因为敲除对象,导入同源臂为250 bp的打靶片段Δwzi::FK,转化后得到6个重组子,通过菌落PCR鉴定初步确定敲除了K.pneumoniae菌株的wzi基因。在后续的研究中,需要利用pCP20-Tc质粒表达FLP重组酶将抗性筛选标记去除,得到不含抗性基因的基因敲除重组子,并且对wzi基因缺失株的荚膜表达进行鉴定,分析wzi基因缺失对荚膜多糖合成的影响。Red重组系统的建立为后续K.pneumoniae菌株代谢途径有关基因突变株的构建奠定了一定基础。
[1] Fadeeva M S,Yakovtseva E A,Belevich G A,et al.Regulation of expression of Na+-translocating NADH:Quinone oxidoreductase genes inVibrioharveyiandKlebsiellapneumoniae[J].Archives of Microbiology,2007,188(4):341-348.
[2] Bertsova Y V,Bogachev A V.The origin of the sodium-dependent NADH oxidation by the respiratory chain ofKlebsiellapneumoniae[J].FEBS Letters,2004,563(1):207-212.
[3] Yang G,Tian J,Li J.Fermentation of 1,3-propanediol by a lactate deficient mutant ofKlebsiellaoxytocaunder microaerobic conditions[J].Applied Microbiology and Biotechnology,2007,73(5):1017-1024.
[4] Balestrino D,Haagensen J A J,Rich C,et al.Characterization of type 2 quorum sensing inKlebsiellapneumoniaeand relationship with biofilm formation[J].Journal of Bacteriology,2005,187(8):2870-2880.
[5] Datsenko K A,Wanner B L.One-step inactivation of chromosomal genes inEscherichiacoliK-12 using PCR products[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6640-6645.
[6] Yamamoto S,Izumiya H,Morita M,et al.Application of λ Red recombination system toVibriocholeraegenetics:Simple methods for inactivation and modification of chromosomal genes[J].Gene,2009,438(1-2):57-64.
[7] Lesic B,Rahme L G.Use of the lambda Red recombinase system to rapidly generate mutants inPseudomonasaeruginosa[J].BMC Molecular Biology,2008,9(1):20.
[8] Fang C T,Lai S Y,Yi W C,et al.Klebsiellapneumoniaegenotype K1:An emerging pathogen that causes septic ocular or central nervous system complications from pyogenic liver abscess[J].Clinical Infectious Diseases,2007,45(3):284-293.
[9] Arakawa Y,Wacharotayankun R,Nagatsuka T,et al.Genomic organization of theKlebsiellapneumoniaecps region responsible for serotype K2 capsular polysaccharide synthesis in the virulent strain Chedid[J].Journal of Bacteriology,1995,177(7):1788-1796.
[10] Doublet B,Douard G,Targant H,et al.Antibiotic marker modifications of λ Red and FLP helper plasmids,pKD46 and pCP20,for inactivation of chromosomal genes using PCR products in multidrug-resistant strains[J].Journal of Microbiological Methods,2008,75(2):359-361.

