机械压力对人牙周膜成纤维细胞增殖活力的影响
汤楚华,施生根,牛忠英,党 平,李 丹
(解放军306医院全军口腔疾病诊治中心,北京 100101)
细胞应力实验研究是组织工程和细胞工程的基础之一,近年来的研究表明,从器官、组织到细胞、亚细胞等各个层次上的生命运动都是在一定力学环境中进行的,机械力深刻影响着细胞和组织的生长、维持和重建[1]。牙周膜成纤维细胞(human periodontal ligament fibroblasts,HPLF)作为牙周膜的主体细胞在咀嚼、咬合等状态下,必然要承受各种机械力的刺激,近年研究发现牙周膜成纤维细胞对不同形式、大小、频率和时间的应力所产生的反应是复杂的[2]。HPLF的增殖活力直接反映了牙周组织生长改建的状态,但是压力对HPLF增殖活力的影响及其在不同时段是如何变化的,目前尚不清楚。本研究通过四唑盐(MTT)比色试验,探讨HPLF增殖活力与压力值、压力作用时间的关系,以进一步认识压力对HPLF功能的影响。
1 材料和方法
1.1 主要材料和仪器
低糖DMEM和胰蛋白酶(Gibco,美国);胎牛血清(华美生物工程公司);噻唑蓝(MTT Sigma,美国);二甲基亚砜(DMSO,Sigma,美国);96孔培养板(Costar,美国);医用净化工作台(北京半导管仪器厂);倒置相差显微镜(Olympus,日本);自动CO2培养箱(HERAcell,德国);Model 550酶联免疫检测仪(BIO-RAD,美国)。
1.2 人牙周膜成纤维细胞的培养
经病人或(和)其家长同意,取12~16岁因正畸减数拔除的无龋、无牙周病的第一前磨牙,无菌条件下刮取根中1/3的牙周膜,采用酶消化-组织块法进行原代培养[3],成功传代后,选用第6代细胞用于实验。
1.3 细胞加载装置和方法
本研究所用的细胞加载装置是由北京航空航天医学研究所研制的液压细胞加载装置,主要由高压储气室、气流量调控器、细胞加载室、压力检测器组成,高压储气室储备950 mL/L空气和50 mL/L CO2。该装置具有精密的自动控制系统,可对细胞产生精确可调的恒定液压。实验时,按设计方案,将细胞培养板放入加载室内,通过高压储气室和气流量调控器将气体输入细胞加载室内,作用于细胞培养液对细胞产生液压。
1.4 方法
1.4.1 不同力值压力对HPLF增殖活力的影响
取生长良好的第6代HPLF,2.5 g/L胰蛋白酶消化计数后,以1×104/孔接种于4块96孔培养板,每孔200 μL。将培养板移入 CO2孵箱中,在37℃、50 mL/L CO2、饱和湿度条件下,培养24 h后,将 4 块培养板随机分为对照组、0.25、0.5、1.0 MPa压力组,每块板为一大组,对照组不予加压,其他3组细胞分别接受相应的压力刺激30 min。然后再将各组细胞置CO2培养箱中继续培养,在加力后 6、12、18、24、30、36 h 检测各组细胞增殖活力,每小组测5孔。
1.4.2 同一压力作用不同时间对HPLF增殖活力的影响
取生长良好的第6代HPLF以1×104/孔接种于4块96孔板,按上述条件培养24 h后,将4块培养板随机分为对照组、加载10 min组、30 min组、50 min组,对照组不予加压,其他3组细胞分别接受1.0 MPa压力刺激相应的时间。然后,再将各组细胞置CO2培养箱继续培养,在加力后6、12、18、24、30、36 h检测细胞增殖活力,每小组测5孔。
1.5 四唑盐(MTT)比色试验检测细胞增殖活力
在上述各实验规定的观察时间,分别取各小组细胞,加入噻唑蓝(MTT,5 mg/mL)20 μL,继续孵育4 h,每孔加入二甲基亚砜终止反应,酶联免疫检测仪在490 nm波长处测定各孔的光密度值。
1.6 统计学分析
用SPSS 11.0统计软件对数据进行单因素方差分析,两两比较用SNK法,检验水准α=0.05。
2 结果
2.1 不同力值压力对HPLF增殖活力的影响
经方差分析,F=9.73,P <0.05,各组之间存在差异(表1)。
表1 不同压力对HPLF增殖活力的影响(OD值,)
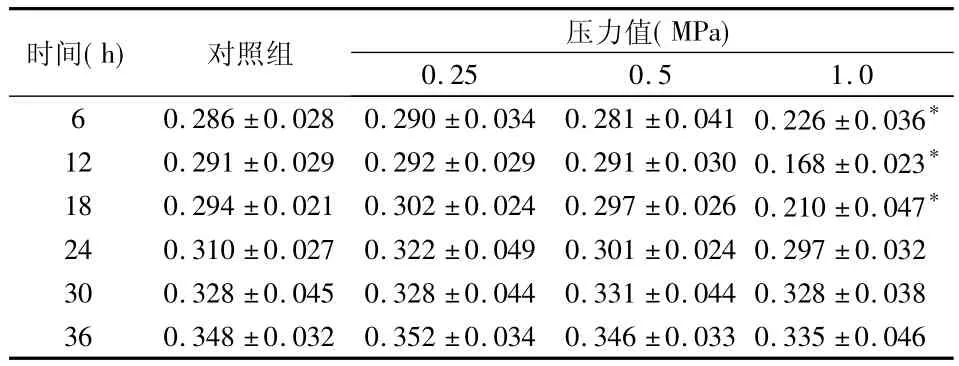
表1 不同压力对HPLF增殖活力的影响(OD值,)
*与对照组相比P<0.05
时间(h) 对照组 压力值(MPa)0.25 0.5 1.06 0.286 ±0.028 0.290 ±0.034 0.281 ±0.0410.226 ±0.036*12 0.291 ±0.029 0.292 ±0.029 0.291 ±0.0300.168 ±0.023*18 0.294 ±0.021 0.302 ±0.024 0.297 ±0.0260.210 ±0.047*24 0.310 ±0.027 0.322 ±0.049 0.301 ±0.0240.297 ±0.03230 0.328 ±0.045 0.328 ±0.044 0.331 ±0.0440.328 ±0.03836 0.348 ±0.032 0.352 ±0.034 0.346 ±0.0330.335 ±0.046
2.1.1 各实验组HPLF的OD值变化趋势
对照组、0.25 MPa组、0.5 MPa组 HPLF 的 OD值随着观测时间的延长逐渐升高,1.0 MPa组在受力后的12 h内OD值呈下降趋势,12 h后随着观测时间的延长OD值逐渐升高。
2.1.2 压力对HPLF的OD值的影响
0.25 、0.5 MPa组在各个时点与对照组相比无显著性差异(P>0.05);1.0 MPa组与对照组相比有显著性差异,表现为细胞在受力后6 h时OD值显著降低(P<0.05),12 h时 OD值进一步降低(P<0.05);18 h时OD值虽有所回升但差异仍有统计学意义(P<0.05);24 h以后各时间点与对照组相比均无显著性差异(P>0.05)。
2.2 相同压力作用不同时间对HPLF增殖活力的影响
经方差分析,F=9.10,P <0.05,各组之间存在差异,SNK法多组均数间两两比较结果(表2)。
表2 压力作用不同时间对HPLF增殖活力的影响(OD值,)
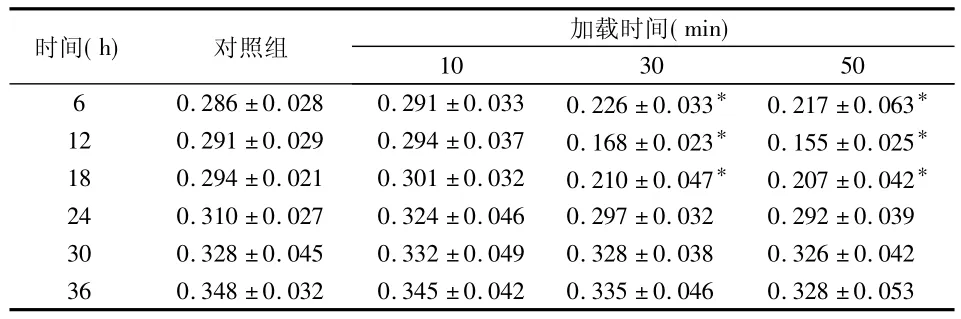
表2 压力作用不同时间对HPLF增殖活力的影响(OD值,)
*与对照组相比P<0.05
时间(h) 对照组 加载时间(min)10 30 506 0.286 ± 0.028 0.291 ± 0.033 0.226 ±0.033* 0.217 ± 0.063*8 ±0.05312 0.291 ± 0.029 0.294 ± 0.037 0.168 ±0.023* 0.155 ± 0.025*18 0.294 ± 0.021 0.301 ± 0.032 0.210 ±0.047* 0.207 ± 0.042*24 0.310 ± 0.027 0.324 ± 0.046 0.297 ±0.032 0.292 ±0.03930 0.328 ± 0.045 0.332 ± 0.049 0.328 ±0.038 0.326 ±0.04236 0.348 ± 0.032 0.345 ± 0.042 0.335 ±0.046 0.32
2.2.1 各实验组HPLF的OD值变化总趋势
对照组、加载10 min组HPLF的OD值随着观测时间的延长逐渐升高;加载30 min组与加载50 min组在受力后的12 h内OD值呈下降趋势,12 h后OD值随着观测时间的延长逐渐升高。
2.2.2 相同压力作用不同时间对HPLF的OD值的影响
加载10 min组在各个时点与对照组相比均无显著性差异(P>0.05);加载30 min组和加载50 min组与对照组相比,在细胞受力后6 h时OD值即有明显降低(P<0.05),12 h时OD值进一步降低(P<0.05),18 h时OD值虽有所回升,但差异仍有有统计学意义(P<0.05),24 h以后各时间点OD值与对照组相比差异均无统计学意义(P>0.05)。加载50 min组与加载30 min组之间相比无显著性差异(P>0.05)。
3 讨论
HPLF是形成新的牙周组织的细胞基础,牙周组织再生修复首先要有一定数量的、健康的牙周膜细胞。因此了解应力对HPLF生物学行为的影响,首先就要了解细胞的增殖活力情况。由于牙周膜位于牙槽骨与牙骨质两种硬组织之间,体内研究其受力情况存在诸多困难,因此,只能通过三维有限元、体外细胞模拟加载等方面来了解。而且还受压力装置的条件限制,以前实验所提供的最大压力值仅约200 kPa,不能反映口腔的实际情况。鉴于牙周膜所受压强的个体差异较大,本研究以下颌第一磨牙平均咬合力除以平均牙周膜面积来粗略估计牙周膜所受压强的数量级。根据北京医科大学对462例青壮年男女检测所得下颌第一磨牙咬合力均数40~50 kg,魏治统等测量下颌第一磨牙牙周膜面积为346 mm2,则粗略估计牙周组织所受压强(N/m2)为 1 ~ 1.5 MPa[4-5]。同时考虑到牙周韧带的缓冲作用会减小咬合压力引起的组织液液压改变及传递至HPLF的压力,HPLF的实际受力相对估计值可能稍小,故本研究选用压强分别为0.25、0.5、1.0 MPa。
对于机械应力对牙周膜成纤维细胞增殖活力的影响,以前报道的结果并不一致,原因在于力的性质、力值大小、作用时间、作用方式有所不同。Matsuda等报道HPLF经受为期4 d 9%或18%的间歇性张力刺激后,其增殖活力受到轻度地抑制;Kletsas等给予HPLF牵张力作用1~6 h后,发现牵张力可以促进细胞DNA合成从而导致细胞增殖加快;而Yamaguchi则报道HPLF经为期5 d的循环拉伸后,实验组HPLF增殖与对照组并无明显差异[6-8]。张晓东等给予HPLF牵张力刺激后,发现频率为0.1 Hz时,12%的牵张应力对牙周膜细胞促增殖作用强,18%的牵张应力对HPDLF的增殖有抑制作用;持续性牵张应力促增殖作用最小[9]。
Yousefian等发现在压力持续作用24、48 h后,较小负压对HPLF增殖有显著促进作用,较小正压对HPLF增殖有显著抑制作用[10]。本课题组张惠采用细胞加载装置对细胞施以30、60、90 kPa压力,每日3次,每次15 min,发现在这种反复多次压力刺激下,细胞增殖受到抑制,该抑制作用随压力值增大而增强[11]。Yamamoto等在不含气体的容器中,对人牙周膜细胞施加流体静压1 MPa,分别持续10、60 min;6 MPa持续60 min,发现细胞没有发生形态学上的改变,细胞的活力也没有受到影响[12]。
本研究结果表明:0.25、0.5 MPa组 OD值在各个时点与对照组相比无显著性差异,1.0 MPa组与对照组相比有显著性差异,表现为受力后6 h时OD值与对照组相比即有显著降低,12 h时OD值进一步降低,18 h有所回升,24 h以后与对照组无差异。提示力值的大小与细胞增殖活力之间存在一定的关系,细胞的活力在此加载范围内随着压力的增大而有所降低。Pavlidis等对大鼠右侧上颌第一磨牙施加0.25和0.5 N的持续力4 h,采用免疫组化方法检测增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)在牙周膜细胞中的表达,发现张力侧和压力侧的细胞阳性染色率均较对照组低,说明细胞增殖活力受到抑制[13]。这与本研究压力作用下HPLF增殖活力降低这一结果相一致。
1.0 MPa的压力作用10 min对细胞OD值没有显著影响,1.0 MPa的压力作用30、50 min后,OD值在受力后6 h即明显下降,12 h时降低最为明显,18 h有所回升,24 h以后与对照组无差异。加载50 min组较加载30 min组OD值略低,但是两者没有明显差异。这可能因为细胞具有蠕变和应力松弛的特征,在静压力的作用下,细胞逐渐发生形变,在短时间内会对细胞的增殖和代谢产生影响,但是这种形变发生在一段时间后会趋向稳定,细胞会因为加载时间的延长失去对应力的敏感性。本研究还观察到加力后24 h后各项指标均恢复至对照组水平,提示在此加载时间内,压力对牙周膜成纤维细胞产生的影响是可逆的。
[1]白灵,樊瑜波,张明.离体培养细胞的力学实验方法[J].生物医学工程学杂志,2002,19(2):324-328.
[2]Krishnan V,Davidovitch Z.Cellular,molecular,and tissuelevel reactions to orthodontic force[J].Am J Orthod Dentofacial Orthop,2006,129(4):469.e1 -32.
[3]汤楚华,施生根,牛忠英,等.酶消化组织块法原代培养人牙周膜成纤维细胞的初步研究[J].中华医学杂志,2004,84(8):656-658.
[4]皮昕.口腔解剖生理学[M].4版.北京:人民卫生出版社,2001:208-209.
[5]马轩祥.口腔修复学[M].5版.北京:人民卫生出版社,2004:147-148.
[6]Matsuda N,Yokoyama K,Takeshita S,et al.Role of epidermal growth factor and its receptor in mechanical stress-induced differentiation of human periodontal ligament cells in vitro[J].Arch Oral Biol,1998,43(12):987 -997.
[7]Kletsas D,Basdra EK,Papavassiliou AG.Mechanical stress induces DNA synthesis in PDL fibroblasts by a mechanism unrelated to autocrine growth factor action[J].FEBS Lett,1998,430(3):358-362.
[8]Yamaguchi M,Shimizu N,Shibata Y,et al.Effects of different magnitudes of tension-force on alkaline phosphatase activity in periodontal ligament cells[J].J Dent Res,1996,75(3):889-894.
[9]张晓东,李永明,宋九余,等.加载牵张应力对人牙周膜成纤维细胞生长和增殖的影响[J].临床口腔医学杂志,2010,26(8):464-467.
[10]Yousefian J,Firouzian F,Shanfeld J.A new experimental model for studying the response of periodontal ligament cells to hydrostatic pressure [J].Am J Orthod Dentofacial Orthop,1995,108(4):402-409.
[11]张惠,施生根,宋应亮.人牙周膜成纤维细胞增殖与压力关系的初步观察[J].实用口腔医学杂志,2001,17(2):130-133.
[12]Yamamoto T,Kita M,Kimura I,et al.Mechanical stress induces expression of cytokines in human periodontal ligament cells[J].Oral Dis,2006,12(2):171 -175.
[13]Pavlidis D,Bourauel C,Rahimi A,et al.Proliferation and differentiation of periodontal ligament cells following short-term tooth movement in the rat using different regimens of loading.Eur J Orthod,2009,31(6):565-571.

