碱性成纤维细胞生长因子对体外培养人牙髓细胞迁移和碱性磷酸酶活性的影响
汪 敏,李 桥,潘乙怀
(浙江 温州 325000:1.温州医学院;2.温州医学院附属口腔医院)
近年来的研究表明:在牙髓组织的修复再生过程中,多种生长因子相互作用构成功能性网络,作为始动信号启动修复的过程。碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是一种肝素粘合多肽,广泛存在于人体组织中,目前认为bFGF具有促进创伤组织愈合、软硬组织修复的功能[1]。bFGF与牙髓牙本质复合体损伤后修复的相关作用研究越来越受重视。本研究旨在通过体外培养人牙髓细胞,探讨bFGF对牙髓细胞的迁移和碱性磷酸酶活性的影响,为将其应用于牙髓组织的修复再生提供实验依据。
1 材料和方法
1.1 主要仪器设备和试剂
二氧化碳恒温孵箱(Thermo公司,美国);超净工作台(上海净化设备有限公司);生物倒置相差显微镜、体视显微镜和光源(Nikon公司,日本);高糖DMEM培养基(Hyclone公司,美国);标准型胎牛血清(FBS,Gibco公司,美国);bFGF(PeproTech公司,美国);Transwell培养小室(Millipore公司,美国);ALP试剂盒(南京建成)。
1.2 人牙髓细胞的体外培养
取因正畸或阻生拔除的健康恒牙(均无龋损、根尖周炎和牙周炎 ),严格无菌下获取牙髓,无血清DMEM培养液反复冲洗3次,在DMEM培养液浸润下剪弃根尖1/3牙髓组织,其余部分剪成0.5 mm ×0.5 mm ×0.5 mm 的碎块,以含200 mL/L胎牛血清的 DMEM培养液,在 37℃、50 mL/L CO2、饱和湿度条件的培养箱中孵育。待组织块贴壁后隔日半量换液。倒置相差显微镜下逐日观察细胞的形态特征和生长情况。细胞出现融合以胰蛋白酶消化法(20 g/L胰蛋白酶+2 g/L EDTA)收集细胞,按1∶2传代。取第4代牙髓细胞行波形蛋白、角蛋白单克隆抗体染色。取第5~8代牙髓细胞进行实验。
1.3 bFGF对人牙髓细胞迁移活性的影响
制备1×106/mL的牙髓细胞悬液。Transwell小室置24孔板中,上室加入200 μL牙髓细胞悬液,静置培养24 h后弃去上室内培养液,无血清培养基浸洗细胞两次。下室加入bFGF终浓度为10 ng/mL含10 mL/L胎牛血清的培养液1.5 mL,对照组仅加入等量的含10 mL/L胎牛血清的培养液,继续培养48 h。取出Transwell小室,弃去上室培养液,PBS浸洗2 min,棉签轻轻拭去小室滤膜内表面细胞,将小室滤膜外表面细胞以40 g/L多聚甲醛固定10 min,10 g/L结晶紫染色10 min,蒸馏水洗涤5 min,显微镜下观察细胞,每张滤膜随机取5个视野(×400)计算穿膜牙髓细胞数并取均值。实验复3孔设计,重复3次。
1.4 bFGF对人牙髓细胞ALP活性的影响
取生长良好的牙髓细胞,制备2×104/mL的细胞悬液,按每孔100 μL接种于4块96孔板。待细胞长满孔底后,弃去孔中培养液,以无血清DMEM浸洗细胞两次,实验组加入含bFGF终浓度为10 ng/mL含10 mL/L胎牛血清的培养液;对照组仅加入等量的含10 mL/L胎牛血清的培养液,每组20个复孔。在继续培养的第1、7、14和21 d后弃孔中培养液,以PBS浸洗3次。每孔加入1 g/L Triton X-100各50 μL,4℃过夜,镜下观察细胞完全裂解后,分别加入 ALP底物混合液200 μL,37℃孵育30 min,以0.5 mol/L氢氧化钠液终止反应,室温振荡5 min,用酶联检测仪选择410 nm波长,测定每孔吸光度A值,取均值。
1.5 统计分析
用SPSS 17.0统计软件进行单因素方差分析,两两比较用t检验,检验水准α=0.05。
2 结果
2.1 人牙髓细胞的形态学观察
培养15~20 d,倒置显微镜下可见人牙髓细胞从组织块周围游离出(图1a),多为典型的梭形结构,胞体丰满,胞浆均匀,核圆形或卵圆形(图1b)。免疫细胞化学染色结果显示:牙髓细胞抗波形蛋白染色阳性(图2a),抗角蛋白染色阴性(图2b)。

图1 人牙髓细胞在倒置显微镜下所见(100×)
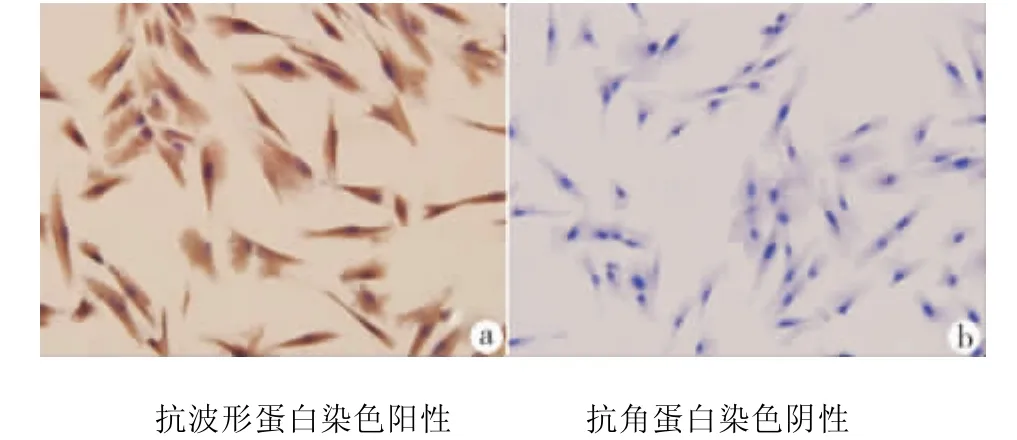
图2 人牙髓细胞免疫细胞染色(200×)
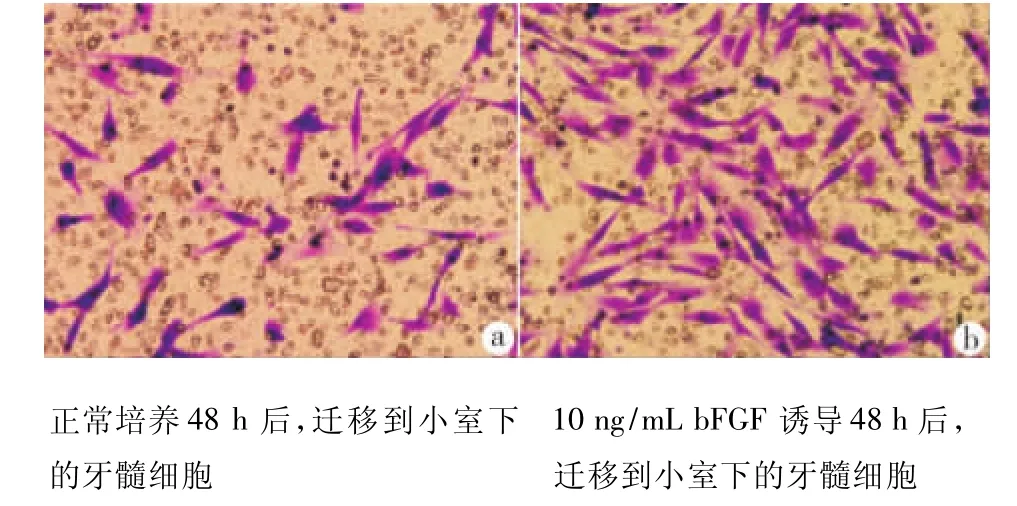
图3 人牙髓细胞迁移情况(200×)
2.2 bFGF对人牙髓细胞迁移活性的影响
培养48 h后,10 ng/mL bFGF组细胞迁移数明显多于对照组(图3),两组比较,差异具有统计学意义(P <0.05)(表1)。
表1 bFGF对人牙髓细胞迁移活性的影响(个,)

表1 bFGF对人牙髓细胞迁移活性的影响(个,)
组别 n 细胞迁移数 相对迁移率(%) P值3 15.58 ±1.49 - -bFGF组对照组3 40.61 ±3.35 260.65 0.00
2.3 bFGF对人牙髓细胞碱性磷酸酶活性的影响
从第7天开始,与对照组相比,10 ng/mL的bFGF可明显抑制体外培养牙髓细胞的ALP活性(P<0.05)。bFGF组各时间点间比较,差异无统计学意义(P >0.05)(表2)。
表2 bFGF对人牙髓细胞ALP活性的影响(OD值,)

表2 bFGF对人牙髓细胞ALP活性的影响(OD值,)
*与对照组相比P<0.05
0.030 bFGF 组 0.276 ± 0.035 0.323 ± 0.035* 0.353 ±0.045* 0.369 ±0.0561 d 7 d 14 d 21 d对照组 0.303 ±0.043 0.408 ±0.025 0.481 ±0.029 0.600 ±组别*
3 讨论
牙髓组织中存在具有自我更新和多向分化潜能的牙髓干细胞[2]。在受到伤害性刺激以后,这些间充质细胞迁移到相应的病变部位,发生增殖。并分化为成牙本质细胞从而形成修复性牙本质,参与牙髓组织修复再生过程[3-4]。在牙髓组织的修复过程中,储存于牙本质中的生长因子会被释放出来,受损的成牙本质细胞以及炎症细胞亦可以释放细胞因子,直接参与牙髓组织的修复再生过程[5]。
bFGF是成纤维生长因子家族的重要成员之一,在牙齿发育中对细胞的增殖和分化起重要作用[1]。Morito[6]的研究表明:bFGF 可体外诱导具有干细胞特性的牙髓细胞向成骨细胞、软骨细胞和脂肪细胞分化。谭震等[7]研究表明bFGF可诱导体外培养的成骨细胞和牙周膜细胞增殖和迁移。
在组织损伤或感染过程中,通常伴有特定细胞向损伤部位的迁移。牙髓组织在受到伤害性刺激之后,未分化的间充质细胞向病变部位的定向迁移对后续的牙本质牙髓复合体修复起着决定性作用。本研究采用Transwell小室法[8]研究bFGF最佳显效浓度[9-10]10 ng/mL对体外培养人牙髓细胞迁移活性的影响,结果表明bFGF可有效诱导牙髓细胞迁移(P <0.05),与 Shimabukuro[11]的“硅块诱导”法研究结果相一致。说明bFGF作为一种信号分子,可诱导牙髓细胞向损伤部位迁移,促进牙本质牙髓复合体的修复。
ALP是参与钙化组织代谢和再生的一种功能性标志酶[12],牙髓组织中的ALP活性可以反映牙髓成纤维细胞向成牙本质样细胞分化的能力。本研究观察10 ng/mL的bFGF对体外培养的人牙髓细胞ALP活性的影响,结果表明bFGF可以抑制体外培养牙髓细胞的ALP活性,且随着培养时间的延长,该抑制作用更加显著(P<0.05),与Shimabukuro[11]、Morito[6]的结果相类似。提示 bFGF 抑制牙髓细胞进一步分化成熟为矿化组织形成细胞。
近年来研究表明:在牙髓的修复再生过程中,多种生长因子相互作用构成功能性网络,作为始动信号启动修复的过程。牙髓组织的修复再生过程复杂,需要多种生长因子、细胞外基质以及细胞本身特性的综合作用。bFGF在这个复杂的调控网络中究竟起多大作用,与其他因子的协同作用和量效关系如何,还有待进一步的研究。
[1]Gospodarowicz D.Fibroblast growth factor.Chemical structure and biological function [J].Clin Orthop Relat Res,1990,(257):231-248.
[2]Gronthos S,Brahim J,Li W,et al.Stem cell properties of human dental pulp stem cells[J].J Dent Res,2002,81(8):531 -535.
[3]Goldberg M,Smith AJ.Cells and extracellular matrices of dentin and pulp:a biological basis for repair and tissue engineering[J].Crit Rev Oral Biol Med,2004,15(l):13-27.
[4]Grando ML,Westphalen BL,de Figueiredo JA,et al.Vascular endothelial growth factor and its relationship with the dental pulp[J].J Endod,2007,33(5):524 -530.
[5]Mitsiadis TA,Rahiotis C.Parallels between tooth development and repair:conserved molecular mechanisms following carious and dental injury[J].J Dent Res,2004,83(12):896 -902.
[6]Morito A,Kida Y,Suzuki K,et al.Effects of basic fibroblast growth factor on the development of the stem cell properties of human dental pulp cells[J].Arch Histol Cytol,2009,72(1):51 -56.
[7]谭震,苹赵青.碱性成纤维细胞生长因子对成骨细胞和牙周膜成纤维细胞迁移、增殖的影响[J].华西口腔医学杂志,2005,23(3):201-203.
[8]唐杰,陈龙菊,王 军,等.Transwell和Wound healing在细胞迁移中的应用比较[J].中国临床解剖学杂志,2007,25(6):687-689.
[9]张颍丽,姜新朋,张影杰,等.碱性成纤维细胞生长因子对人体外培养牙髓细胞增殖的影响[J].现代口腔医学杂志,2008,22(2):173-175.
[10]韦永珍,汪敏,潘乙怀,等.牙髓成纤维细胞体外培养及增值的实验研究[J].实用医学杂志,2010,26(23):4283-4285.
[11]Shimabukuro Y,Ueda M,Ozasa M,et al.Fibroblast growth factor-2 regulates the cell function of human dental pulp cells[J].J Endod,2009,35(11):1529-1535.
[12]Babaei H,Mansouri NL,Molaei MM.Assessment of lactate dehydrogenase,alkaline phosphatase and aspartate amino transferase activities in cow’s milk as an indicator of subclinical mastitis[J].Vet Res Commun,2007,31(4):419.

