采用UPLC-ESI-MS快速测定博落回各器官中主要生物碱的含量
钟明 ,黄可龙,曾建国,黎霜,佘金明,张丽
(1. 中南大学 化学化工学院,湖南 长沙,410083;2. 湖南省中药提取工程研究中心,湖南 浏阳,410301;3. 湖南理工学院 化学化工学院,湖南 岳阳,414006)
博落回(Macleagua cordata(Willd)R.Br.)系罂粟科博落回属植物,俗称号筒杆、落回等,在我国的大部分省、自治区以及日本等都有分布。博落回在我国的药用历史有1 000多年,《本草纲目》《本草拾遗》及《中药志》等均有记载。博落回常以干燥的全草入药,具有驱虫、抗菌、消肿、平喘、镇痛等功效[1-3],临床上已用于痔疮、脓性指头炎、滴虫性阴道炎、宫颈糜烂等治疗[4]。研究表明:博落回全草中含有多种生物碱,包括原阿片碱(PRO)、别隐品碱(ALL)、血根碱(SA)、小檗碱(BER)、白屈菜红碱(CHE)、氧化血根碱(OSA)、二氢血根碱(DHSA)、二氢白屈菜红碱(DHCHE)等异喹啉类生物碱。现已发现博落回中某些生物碱(如血根碱、白屈菜红碱、博落回总碱等)具有显著的抗肿瘤作用[5-8],可望发展成为一类高效的抗癌药物,因而倍受人们关注。据国内外有关博落回的研究结果可知:大多数研究集中在提取与分析博落回中总生物碱与4种主要生物碱[9-12],而对于生物碱在博落回各器官中的分布、合成、代谢途径以及基因的协同表达等研究甚少。由于生物碱成分与含量是博落回药材质量控制的主要指标,也是生物碱代谢组学的研究基础,因而,这些研究对于博落回的品质鉴定与资源利用具有重要意义。目前人们主要采取 HPLC和HPLC/MS来检测博落回中主要生物碱的含量[13-14],但由于博落回中已知的生物碱都属于同源代谢途径中的次生产物,分子结构与化学性质均类似,因此,对博落回中生物碱的分离比较耗时,进行传统的HPLC的全分析大多需要45 min以上,批量分析时溶剂的消耗很大,所需时间较多,且存在线性响应较差、峰拖尾等问题。为了解决这些问题,本文作者研究一种超高效液相色谱-电喷雾质谱联用(UPLC-ESI-MS)快速测定博落回中8种主要生物碱含量的方法。
1 实验部分
1.1 仪器与试剂
仪器为:超高效液相色谱仪(Acquity UPLC,美国waters公司制造);三重四极杆串联质谱仪(Waters Quattro Premier XE triple quadrupole mass spectrometer,美国 Waters公司制造),工作软件为MassLynx 4.1;超声波清洗器(昆山超声波仪器有限公司制造);通用植物粉碎机(浙江瑞安制造)。
试剂为:乙腈,为色谱纯(Merck公司生产);其他试剂,均为分析纯。所有溶剂使用前均使用微孔滤膜过滤。
标准品中的盐酸血根碱、盐酸小檗碱和盐酸白屈菜红碱购于中国药品生物制品检定所,其余5种标准品(原阿片碱、别隐品碱、氧化血根碱、二氢血根碱和二氢白屈菜红碱)由本实验室自制,经1HNMR和13CNMR鉴定后,再通过HPLC测定其质量分数不低于99%。
1.2 实验方法
取博落回全草5 kg。全草在温度为50 ℃干燥箱中风干。准确称取博落回根、茎、叶、果荚的干燥样品(粉碎至粒度为0.25~0.38 μm)各2.0 g,分别放入4个具塞锥形瓶中,各加入 100 mL甲醇,在超声清洗器(SB3200-T,50 kHz,250 W,必能信超声(上海)有限公司制造)中连续超声60 min后,放置冷却至室温,摇匀,用孔径为0.2 μm的微孔滤膜滤取适量上清液,待测。
1.3 分离方法
称取一定量的博落回果荚,用酸水渗漉提取,经稀氨水碱化提取液后滤去沉淀。上清液经 AB-8大孔树脂吸附、60%乙醇洗脱,经旋转蒸发仪蒸干后再用高纯度乙醇回流提取,过滤后将上清液保温析晶。将析出的粗晶用葡聚糖凝胶分离,用等体积混合的氯仿-甲醇溶液洗脱,可分离出较多的别隐品碱晶体和另一种微量的白色晶体。经核磁共振鉴定,该白色晶体为隐品碱。
1.4 色谱与质谱条件
采用BEH C18色谱柱(1.7 μm,2.1 mm×50 mm,美国waters公司制造);柱温为30 ℃;流动相A为乙腈;流动相B是质量分数为0.12%的甲酸水溶液,内含15 mmol/L醋酸铵;梯度洗脱条件为:0~5 min,20%~50% A(体积分数,下同),5.5~6.0 min,50%~55% A;6.0~6.5 min,55%~50% A;6.5~10.8 min,50%~63% A;10.8~11.0 min,63%~20% A。流速为0.25 mL/min;进样量为 2 μL。
质谱采用电喷雾电离(ESI),全扫描模式,质荷比为90~450。离子源参数如下:毛细管电压为3.0 kV;锥孔电压为25 V (channel Ⅰ)和 55V (channel Ⅱ);萃取电压为4 V;源温度为120 ℃;脱溶剂温度为350 ℃;脱溶剂气流量为750 L/h;锥孔气流量为50 L/h。
2 结果与讨论
2.1 色谱条件优化
本实验首先比较甲醇-水与乙腈-水2种流动相体系。发现乙腈-水体系比甲醇-水体系的压力更小,且洗脱能力更强,能有效洗去BEH C18柱中杂质残留。其次研究以乙腈-氨水、乙腈-甲酸、乙腈-TFA(三氟乙酸)和乙腈-醋酸胺(加甲酸)等体系对于生物碱分离度的影响,结果发现乙腈-TFA体系的分离效果最好,而乙腈-醋酸胺(加甲酸)体系次之,其余2种效果不太理想。究其原因可能是TFA与所测生物碱形成离子对增加了生物碱的保留时间,从而改善了被测物的分离效果。但由于TFA对生物碱的质谱信号特别是对其中氧化血根碱的离子信号抑制作用过大,所以,最后选择的流动相为乙腈-醋酸胺(加甲酸)体系。经进一步实验发现:使用该缓冲盐体系也可有效增加生物碱在BEH C18柱中的保留时间,不仅目标峰分离度较大,且色谱峰形与其他体系相比也得到有效改善,满足质谱分析对缓冲盐的使用要求;同时,甲酸的加入可增加离子化效率,有利于质谱信号的加强。由于博落回中所含的生物碱在化学结构上具有很多的相似性(见图1),等度洗脱很难将它们完全分开,因此,选择分离效果较好的梯度洗脱方式。采用混标溶液考察色谱条件对各物质分离度的影响,从而确定了 1.4节中所使用的梯度方案,在样品的实测中分离效果良好。
2.2 质谱条件优化
在质谱分析中,选择电喷雾(ESI)电离模式分别对毛细管电压、一级与二级锥孔电压、源温度、脱溶剂气温度等质谱参数进行优化,通过全扫描方式从总离子流图(TIC)中分别找出 8种生物碱精确的分子离子峰,其中季胺碱型(SA,CHE和BER)选用[M]+作为母离子,叔胺碱型(PRO,ALL,DHSA,OSA和DHCHE)选用[M+H]+作为母离子。实验结果表明:脱溶剂气流量以及温度对生物碱的离子化效率有较大影响。在0.25 mL/min的流速下不分流进样时,通过调整雾化气流量与温度,观察雾化情况,发现在脱溶剂气流量为750 L/h、温度为 350 ℃的情况下喷雾效果较好并且稳定。
采用上述色谱条件对混标溶液和博落回根、茎、叶以及果荚的 UPLC-ESI/MS进行分析,检测样品的总离子流图(ESI模式),见图2。样品中8种生物碱含量根据标准品与样品中对应峰的保留时间与质谱峰来确定(见表1)。结果表明:4个样品与标准品的总离子流图(TIC)和质谱图的对应成分在保留时间、准分子离子和碎片离子峰等方面较吻合,重现性很好;与HPLC的分析时间相比,UPLC分析博落回果荚所需时间仅需11 min,约为同条件下HPLC全分析时间(45 min)的 1/4,且峰形更锐,灵敏度更高。这是因为 UPLC采用了小粒径色谱填料(1.7 μm)的短柱,使得 UPLC在高压、高流速下依然保持了良好的分离效率,从而节约了分析时间,实现了复杂物质的快速分离。
2.3 方法的线性与回收率
分别配制系列浓度的混合标准品溶液,在最佳的分离条件下进行测定,以各化合物峰面积(y)对各生物碱质量浓度(x)绘制工作曲线,回归方程与相关系数见表2。以信噪比≥3作为检出限,将标准储备液逐级稀释进样,得各物质的最低检出限(表2)。结果表明:UPLC-ESI-MS方法可同时满足博落回中 8种生物碱成分的定量检测要求。
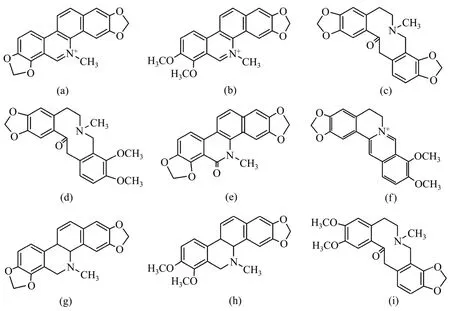
图1 博落回中主要生物碱的化学结构Fig.1 Chemical structures of main alkaloids in M.cordata.
2.4 方法的精密度与检出限
精密称取已测定含量的博落回果荚质量,共 12份,每份1 g。将其中6份样品分别加入0.5 mL混合标准品溶液,另外6份各加入1 mL混合标准品溶液,按加标试样测定值与试样测定值之差再与加标量之比计算回收率。对每个添加浓度重复6次实验,计算加样回收率和相对标准偏差,测定结果见表3。
2.5 博落回根、茎、叶与果荚的样品分析
博落回全草中现已发现的生物碱全部为异喹啉类生物碱,通常可分为3种类型:原阿片碱型(原阿片碱、别隐品碱和隐品碱等)、苯并菲啶型(血根碱和白屈菜红碱等)、小檗碱型(小檗碱和黄连碱等)。这些异喹啉类生物碱在植物体内的合成均起始于L-酪氨酸,经过(S)-norcoclaurine 和(S)-scoulerine等共同的中间体,然后从(S)-scoulerine开始分成3条主要途径,在不同的酶催化下合成博落回中其他各种生物碱[15-16]。虽然它们都是同源的次生代谢产物,但它们的生物活性与药用效果差别很大,并且在博落回各器官中的分布也各不相同。中医理论认为即使是同种的道地药材,其用药部位不同,疗效差异显著,因为不同部位的药性与其有效成分的种类和含量密切相关。本研究中测定的8种生物碱都是药理作用明确且在博落回各器官中含量较高的成分,因此,系统研究博落回各部位的生物碱成分与含量变化规律,不仅对博落回的资源利用很有价值,而且有利于中药博落回及其制成品的质量控制。

表1 8种生物碱的确定Table 1 Identification of eight alkaloids
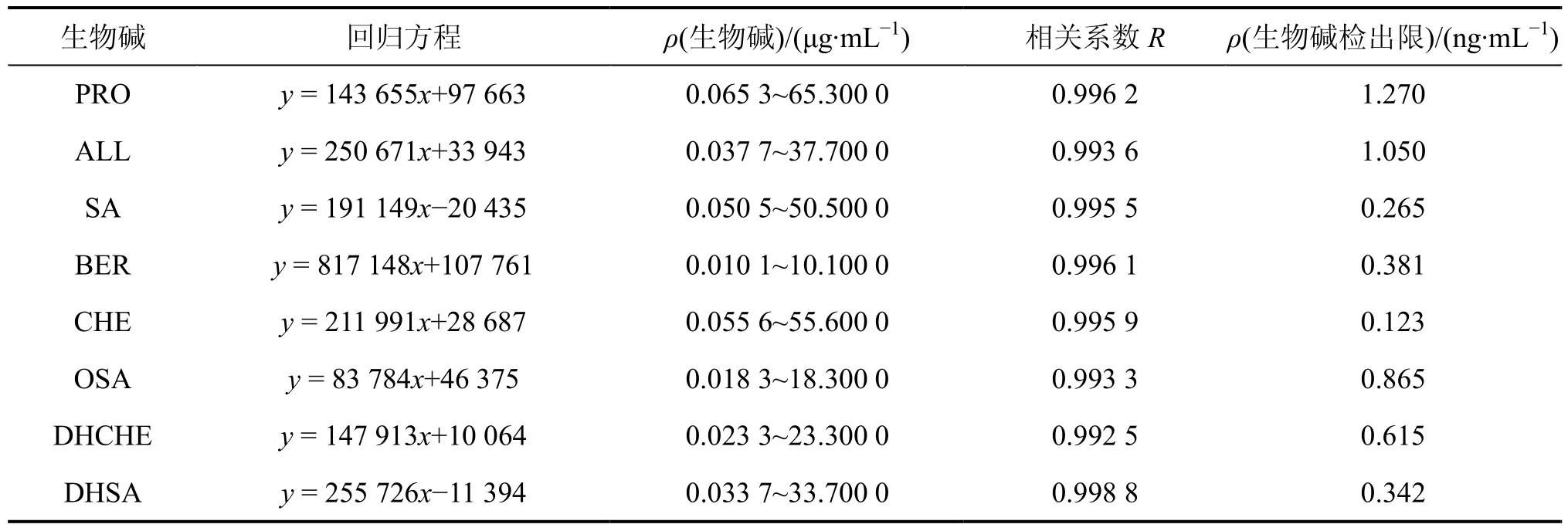
表2 8种生物碱的回归方程与相关系数Table 2 Linear regression equation and coefficient of correlation in determination of eight alkaloids

表3 博落回果荚样品分析的精密度与回收率(n=6)Table 3 Recovery and precision in determination of eight alkaloids from fruits of M.cordata (n=6)
采用提出的UPLC-ESI-MS方法,在1.4节的色谱条件下对博落回的根、茎、叶和果荚中8种生物碱质量分数进行快速分析(见图3)。结果表明:8种所测生物碱在博落回各部位的含量差别明显,见图3。由图3可见:这8种生物碱在博落回各器官中均有分布,其中SA,CHE,PRO和ALL是各器官中的主要生物碱,含量比其他4种的含量要高很多。所测样品中以博落回果荚所含总生物碱量最高(以8种生物碱计),达4.89 mg/g,其中,SA质量分数为1.79%,不仅是果荚中含量最高的生物碱,而且是该植物中含量最高的生物碱。同样,CHE含量也以果荚为最高,达 0.7%,所以,果荚就成为博落回中获取商品化的血根碱和白屈菜红碱的最佳药用部位。在博落回根中检出最高含量的原阿片碱和别隐品碱,分别为 1.09%和 0.97%,其中别隐品碱含量明显比其他几个器官的碱含量高,但由于根是植物中相对不可再生的资源,所以,从根中提取别隐品碱并不是一种很好的选择。叶中所含生物碱的含量也比较大,但由于博落回地上部分的采收期一般为11月左右,叶在这段时间已大多枯黄掉落,而提前采摘时,其他各部分的生物碱总量未达高值,所以,目前博落回叶子的利用尚不充分。通过比较图3中的含量可知:茎中生物碱含量最低,其中4种主要生物碱含量中,SA为0.20%,CHE为0.17%,PRO为0.25%,ALL为 0.17%,但茎的干质量占地上部分干质量的70%~80%,所以,生物碱的总量也较大,可结合茎的特点在提取生物碱后对其综合利用。在8种生物碱中,BER,OSA,DHSA和DHCHE在博落回各器官中的含量都比较低,提取与分离也很不容易,因此,需仔细分析微量生物碱含量,以便博落回资源的综合开发与利用。
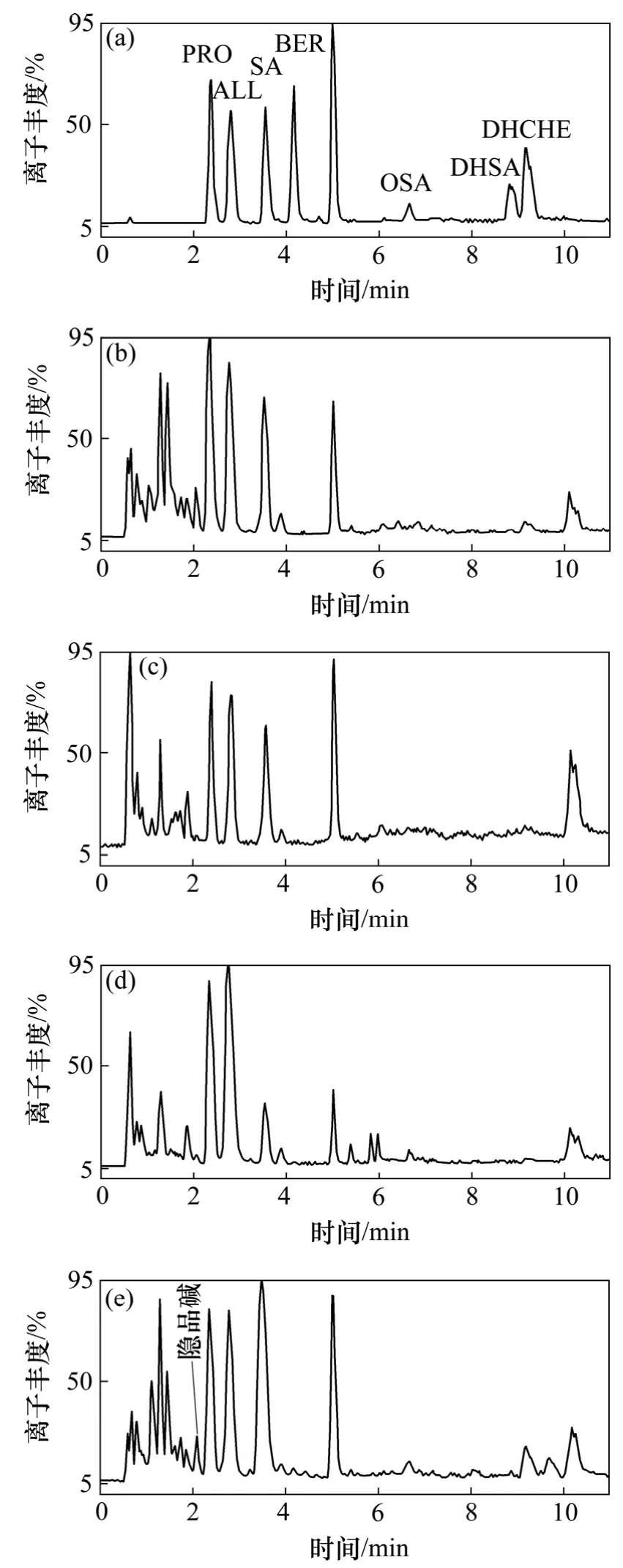
图2 博落回中根、茎、叶和果荚的总离子流图(TIC)Fig.2 UPLC-ESI-MS total ion current chromatogram of extract from four organs of M.cordat
2.6 隐品碱的分离与鉴定
通过样品的TIC图的分析,还在博落回的根和果荚中发现一定含量的隐品碱(保留时间tR为2.08 min)。它是别隐品碱的同分异构体,其分子离子峰[M+H]+的相对分子质量与别隐品碱的相同,与其他离子碎片不同,UPLC的出峰时间也有明显区别,见图4。胡之壁等[6]从博落回果实中分离并鉴定了α型和β型别隐品碱,并证实二者为2种物理异构体,虽然晶形不同而熔点各异,但它们在氯仿溶液中的红外光谱是完全一致的。然而,本文分离出的隐品碱不是别隐品碱的物理异构体,而是它的化学异构体。通过比较图1中别隐品碱与隐品碱的分子结构式可知:二者的分子结构完全不同(仅相对分子质量相同),因此,隐品碱和别隐品碱互为化学异构体。从图4可见:当锥孔电压为25 V时,隐品碱与别隐品碱都可以获得高强度的分子离子峰([M+H]+质荷比为 370);而当锥孔电压升高为55 V时,隐品碱获得的强度最高的碎片峰质荷比为204,但别隐品碱强度最高的碎片峰质荷比为188。由此可见,根据二者在UPLC-ESI-MS分析中tR和质谱碎片峰的差异,可以快速、简单地鉴别出隐品碱与别隐品碱。
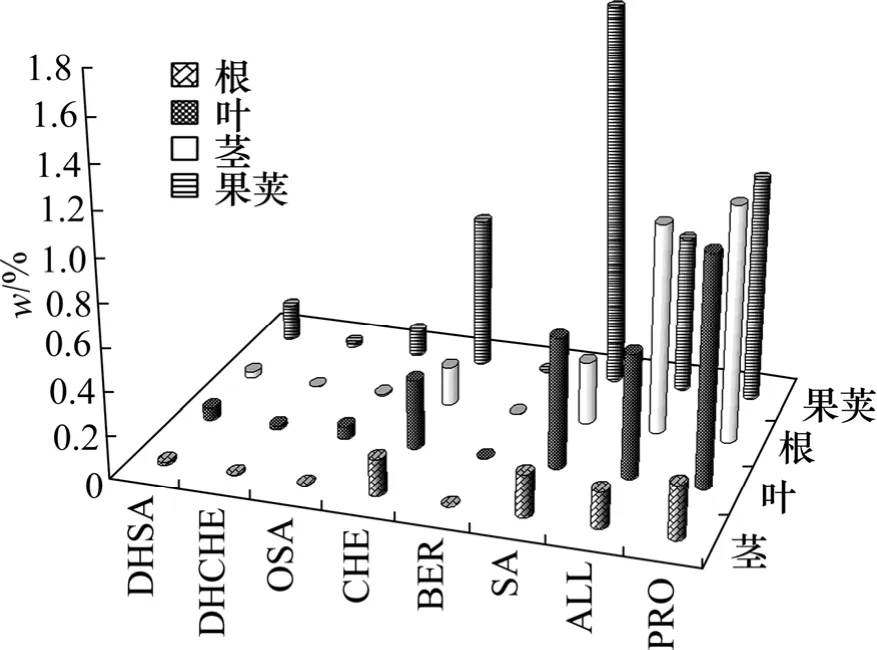
图3 博落回的根、茎、叶和果荚中8种生物碱含量Fig.3 Contents of eight alkaloids from four organs of M.cordata
对提纯后的隐品碱晶体采用1HNMR和13CNMR进行进一步验证,所得结果如下:1HNMR (500 MHz,acetone)δ: 6.72 (1H, d,J= 7.8 Hz) C11-H; 6.66 (1H, d,J= 7.8 Hz) C12-H; 6.99 (1H, s) C1-H; 6.80 (1H, s) C4-H;5.94 (2H, s) -OCH2O-2,3;3.81(6H, s) -OCH3;1.88(3H,s)N-CH3; 3.59 (2H, br,) C8-H; 2.94 (2H, br,) C13-H; 2.79(2H, m,) C5-H; 2.50 (2H, br,) C6-H;13C-NMR (100 MHz,acetone)δ: 112.7(C-1), 148.3(C-2), 150.4(C-3),114.9(C-4),136.0(C-4a),32.0(C-5),58.69(C-6),51.57(C-8),132.3(C-8a),146.7(C-9),147.1(C-10),106.9(C-11),126.1(C-12),119.4(C-12a),47.16(C-13),196.1(C-14),132.0(C-14a),56.0(2, -OCH3),56.2(3,-OCH3),41.7(-N-CH3),101.7(-OCH2O-)。该结果与参考文献[17]中隐品碱的结果相同。

图4 隐品碱和别隐品碱的双通道的质谱图Fig.4 Mass spectra of Cryptopine and Allocryptopine on two channels
3 结论
(1) UPLC-ESI-MS方法具有快速分离与检测的优点,在11 min内将待测成分完全分离,比常规HPLC的全分析速度提高了近3倍。该方法具有较高的准确度、精密度和较强稳定性,适用于博落回样品中生物碱的全分析。
(2) 博落回各器官中8种生物碱的含量差别很大,显示博落回中3类异喹啉生物碱的代谢途径与代谢方式各不相同,其中果荚为博落回根、茎、叶、果荚中生物碱含量最丰富的部位,血根碱为果荚中含量最高的生物碱成分。
(3) 从博落回果荚中分离并鉴定了隐品碱,通过质谱和1HNMR和13CNMR证明隐品碱为别隐品碱的化学同分异构体。
[1] 杨军, 王静, 刘信顺, 等. 博落回的药效研究[J]. 中药材,1999, 22(2): 88-85.YANG Jun, WANG Jing, LIU Xin-shun, et al. Experimental studies on pharmacodynamic effect of Macleaya cordata[J].Journal of Chinese Medicinal Materials, 1999, 22(2): 88-85.
[2] 李发旺, 索全伶, 李强, 等. 博落回果实中生物碱的提取分离与鉴定[J]. 内蒙古工业大学学报, 2008, 27(1): 49-53.LI Fa-wang, SUO Quan-ling, LI Qiang, et al. Extraction and separation of alkaloids from fruit ofMacleaya cordataand their characterization[J]. Journal of Inner Mongolia University of Technology, 2008, 27(1): 49-53.
[3] 蔡建国, 张涛, 陈岚. 超临界CO2流体萃取博落回总生物碱的研究[J]. 中草药, 2006, 37(6): 852-854.CAI Jian-guo, ZHANG Tao, CHEN Lan. Total alkaloid extract fromMacleaya cordatausing supercritical CO2fluid extraction[J]. Chinese Traditional and Herbal Drug, 2006, 37(6):852-854.
[4] 孙丽艳, 魏雄辉, 韦宇, 等. 博落回总生物碱提取方法的研究[J]. 药物分析杂志, 2003, 23(1): 15-18.SUN Li-yan, WEI Xiong-hui, WEI Yu,et al. Extraction of total alkaloids fromMacleaya cordata[J]. Chinese Journal of Pharmaceutical Analysis, 2003, 23(1): 15-18.
[5] BAI Li-ping, ZHAO Zhong-zhen, CAI Zong-wei, et al. DNA-binding affinities and sequence selectivity of quaternary benzophenanthridine alkaloids sanguinarine, chelerythrine, and nitidine[J]. Bioorganic & Medicinal Chemistry, 2006, 14(16):5439-5445.
[6] 胡之壁, 徐垠, 冯胜初, 等. 博落回果实中有效成分的研究[J].药学学报, 1979, 14(9): 535-539.HU Zhi-bi, XU Yin, FENG Sheng-chu, et al. Studies on the active components from fruits ofMacleaya cordata(Willd) R.Br[J]. Acta Pharmaceutica Sinica, 1979, 14(9): 535-539.
[7] Beuria T K, Santra M K, Panda D. Sanguinarine blocks cytokinesis in bacteria by inhibiting FtsZ assembly and bundling[J]. Biochemistry, 2005, 44(50): 16584-16593.
[8] 宗永立, 刘艳平. 白屈菜红碱诱导细胞凋亡的机理综述[J].时珍国医国药, 2006, 17(10): 2068-2071.ZONG Yong-li, LIU Yan-ping. Review on the mechanism of apoptosis induced by chelerythrine[J]. LISHIZHEN Medicine and Material Medica Research, 2006, 17(10): 2068-2071.
[9] LUO Xu-biao, CHEN Bo, YAO Shou-zuo. Rapid determination of protopine, allocryptopine, sanguinarine and chelerythrine in fruits ofMacleaya cordataby microwave-assisted solvent extraction and HPLC-ESI/MS[J]. Phytochem Analysis, 2005,17(6): 431-438.
[10] ZHANG Fei, CHEN Bo, XIAO Song, et al. Optimization and comparison of different extraction techniques for sanguinarine and chelerythrine in fruits ofMacleaya cordata(Willd) R. Br[J].Separation and Purification Technology, 2005, 42(3): 283-290.
[11] 曾建国, 张胜, 侯团章. 不同生长期博落回果实中血根碱与白屈菜红碱的含量[J]. 中药材, 1999, 22(5): 229-230.ZENG Jian-guo, ZHANG Sheng, HOU Tuan-zhang, et al. The contents of sanguinarine and chelerythrine from the fruits ofMaeleaya cordata( Willd) R. Br. in different growing periods[J].Journal of Chinese Medicinal Materials, 1999, 22(5): 229-230.
[12] 陈应庄. 博落回属植物中苄基异喹啉类生物碱代谢组学研究[D]. 长沙: 湖南师范大学化学化工学院, 2008: 26-32.CHEN Yin-zhuang. Study on benzylisoquinoline alkaloids metabonomics in plant of macleaya[D]. Changsha: Hunan Normal University. School of Chemistry and Chemical Engineering, 2008: 26-32.
[13] LUO Xu-biao, CHEN Bo, YAO Shou-zuo. High-performance liquid chromatography with electrospray mass spectrometry for rapid and sensitive determination of sanguinarine and chelerythrine in exogenously contaminated honey[J].Chromatographia, 2004, 60(5/6): 347-351.
[14] 李晓蒙, 程力惠, 刘慧琼. HPLC法测定博落回药材不同器官的SA与CHE含量[J]. 亚热带植物科学, 2008, 37(2): 41-43.LI Xiao-meng, CHENG Li-hui, LIU Hui-qiong. Determination of chelerythrine in different parts ofMacleaya cordataby HPLC[J]. Subtropical Plant Science, 2008, 37(2): 41-43.
[15] 唐中华, 于景华, 杨逢建, 等. 植物生物碱代谢生物学研究进展[J]. 植物学通报, 2003, 20(6): 696-702.TANG Zhong-hua, YU Jing-hua, YANG Feng-jian, et al.Metabolic biology of plant alkaloids[J]. Chinese Bulletin of Botany, 2003, 20(6): 696-702.
[16] Kutchan T M. Alkaloid biosynthesis: The basis for metabolic engineering of medicinal plants[J]. The Plant Cell, 1995, 7(7):1059-1070.
[17] Christoph S,Sonja S, Eva-Maria S, et al.1H and13C NMR signal assignment of benzylisoquinoline alkaloids fromFumaria officinalisL. (Papaveraceae)[J]. Magnetic Resonance in Chemistry, 2004, 42: 882-886.

