顺铂纳米载体体外抗肿瘤作用的比较研究
孙晓译,梁文权
(1.浙江大学城市学院医学与生命科学学院,浙江杭州310015;2.浙江大学药学院,浙江杭州310058)
目前,广泛研究和使用的亲水性药物纳米载体主要有脂质体、纳米粒、聚合胶束等。药物载体的化学组成和物理结构,会通过改变药物的释放行为[1]、粒子表面特性、与细胞膜及其它成分的相互作用力[2]、细胞转运途径[3],从而最终影响药物的疗效。面对各种可供选择的药物载体,如何进行合理选择成为人们关注的问题。目前的研究多针对一种纳米载体进行结构修饰或改变,但平行比较多种载体的研究少有报道。
顺铂是一种水溶性细胞周期非特异性抗肿瘤药物,对于卵巢癌、肺癌、鼻咽癌、食道癌、恶性淋巴瘤、乳腺癌、头颈部鳞癌等多种实体肿瘤均有疗效[4]。但因为存在肾脏毒性、神经毒性、骨髓抑制和胃肠道反应等严重的毒副作用[5],因此临床应用受到了一定的限制。目前有许多给药系统,如脂质体[6]、纳米粒[7]、纳米囊[8]等正处于研究和开发之中,以期能达到在靶部位缓慢释放药物、减少给药剂量和降低药物毒性的作用。其中研究较为成熟的是顺铂脂质体和明胶纳米粒。
本研究选用顺铂作为水溶性药物的模型药物,以顺铂脂质体和顺铂明胶纳米粒为纳米载体的研究对象,通过平行的细胞摄取、消除、内吞抑制、体外抗肿瘤等实验,比较两种纳米载体在敏感细胞A549中的转运和抗肿瘤作用的区别与特点,为顺铂的载体选择提供一定依据。
1 材料与方法
1.1 试剂与材料 顺铂(CDDP)购自山东齐鲁制药厂;氯丙嗪(CPZ)、细胞松弛素D(CytD)、非律平Ш(Filipin Ш)购自Sigma公司;氢化大豆磷脂(HSPC)和胆固醇由Lipoid公司提供;铂标准液、115In标准液购自上海晶纯试剂有限公司。DMEM培养基、小牛血清、胰酶和青霉素-链霉素双抗试剂购于Gibico公司。
1.2 细胞株 人肺腺癌A549细胞系从中科院上海生科院购得。
1.3 顺铂脂质体及顺铂明胶纳米粒的制备顺铂脂质体(CDDP-liposome)根据文献[9]稍经修改制备。65℃搅拌下溶解20 mg顺铂于2 ml生理盐水。250 mg HSPC和50 mg胆固醇溶于乙醇后,将其滴入顺铂溶液中搅拌,保持混悬液65℃,1 h。将脂质悬液进行探头超声,趁热过0.22 μm滤膜。滤液室温放冷,过0.45 μm滤膜除结晶药物。滤液于透析袋(MWCO:14 kDa)室温透析除去游离药物。
顺铂明胶纳米粒(GPs-Pt)用两步去溶剂法制备[7]。磁力搅拌下将丙酮滴加至4%(w/v)明胶溶液(以1 mol/L盐酸调节pH2.5),纳米粒悬液以0.2%戊二醛交联过夜。明胶纳米粒离心收集,并用水洗除有机溶剂及交联剂。将制得的空白纳米粒分散于1 mg/ml顺铂水溶液中,37℃振摇反应24 h。未结合的顺铂依上法离心、水洗去除。冷冻干燥即得。
1.4 纳米载体的表征 取CDDP-liposomes和GPs-Pt,用PBS稀释至合适浓度,激光衍射粒度分析仪测定粒径分布和表面电位。
透析法(MWCO:14 kDa)测定顺铂纳米载体的体外释放。透析液为DMEM培养液。37℃,75次/min振摇条件下,间隔一定时间取样。
载药量测定:将一定量的顺铂脂质体或纳米粒消解,按1.5项下处理,电感耦合等离子体质谱(ICP-MS)测定含量。
1.5 Pt含量测定 取待测细胞样本,加入115In内标液(1 μg/ml)50 μl,再加入 5 ml 65%HNO3,于120℃中消解。溶液近干时,加超纯水5 ml,再加热至近干。重复以上步骤,至棕色气体消失,溶液透明清亮,最后用超纯水定容至5 ml,ICP-MS 进样分析。
1.6 细胞摄取与消除 细胞以5×105个/孔接种,过夜。摄取时给药浓度20 μg/ml,孵育3 h。PBS洗涤后,加内标,按1.5项下消解细胞,用于整体细胞Pt含量测定。胞内Pt含量测定时,PBS洗涤细胞后用胰酶消化细胞,离心、洗涤并收集细胞后消解,用于ICP-MS定量。
消除实验前,先进行细胞摄取。后以PBS洗去药液,以新鲜培养液培养细胞,记录该时间点为消除起点。于一定时间点,胰酶消化、收集细胞。按1.5项下处理样品,用于胞内Pt含量测定。
1.7 内吞抑制 细胞5×105个/孔接种。含内吞抑制剂的培养液与细胞孵育30 min后,加入含药载体(20 μg/ml CDDP),继续培养1 h。PBS洗涤,胰酶消化收集细胞,按照1.5项下消解细胞测定Pt浓度。各抑制剂浓度:50 mmol/L 2DG/0.05%NaN3,10 μg/ml CPZ,2 μmol/L CytD,1 μg/ml filipin Ш。低温摄取时,细胞预先在4℃条件下放置30 min后低温摄取1 h,其余操作同前。
1.8 细胞毒性实验 细胞1×104个/孔接种,过夜。加入不同浓度的药液,培养72 h后,MTT法测定细胞毒性。
1.9 统计学处理 数据以“均数±标准差”表示,采用方差分析或t检验,P<0.05为差异有统计学意义。
2 结果
2.1 纳米载体表征 顺铂脂质体和明胶纳米粒的粒径、电位及载药量,如表1所列。体外释放以顺铂溶液为对照,结果显示两种载体72 h内药物释放约30%,其中脂质体的释放较明胶纳米粒更慢(72 h,P <0.05,图1)。
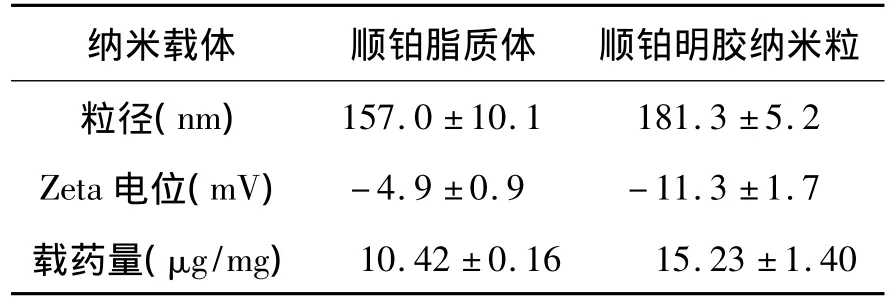
表1 顺铂脂质体和顺铂纳米粒的粒径、电位和载药量Table 1 Size,zeta potential and drug loading of CDDP-liposomes and GPs-Pt
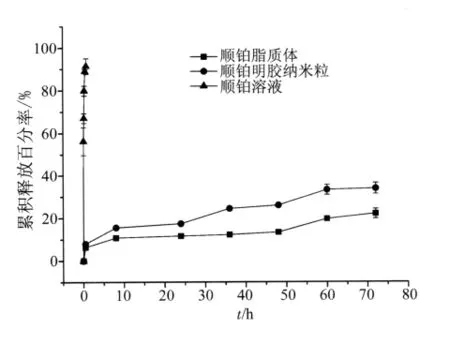
图1 顺铂脂质体和顺铂纳米粒体外释放曲线Fig.1 In vitro release of CDDP solution,CDDP liposomes and GPs-Pt
2.2 细胞摄取 经细胞摄取3 h后,纳米粒组胞内和总体细胞Pt水平均显著高于脂质体(P<0.05)。但其胞内Pt浓度低于溶液组(图2A)。明胶纳米粒细胞膜吸附能力强,约占细胞总量的80%。
2.3 内吞途径 低温摄取显著降低了胞内药物含量,CPZ显著抑制了明胶纳米粒和脂质体的细胞摄取(P<0.05)。Filipin Ш的存在对顺铂溶液和两种纳米载体的细胞摄取均无影响。CytD减小了纳米粒和脂质体的细胞内化,脂质体组胞内Pt含量减小了45%,纳米粒组减小了15%(图2B)。
2.4 细胞消除 顺铂的细胞消除动力学曲线见图3A。脂质体组4 h内约15%的药物被清除出细胞,顺铂溶液消除比例相似。纳米粒组胞内Pt含量下降最多(50%),各时间点的消除比例较脂质体组均有显著性差异(P<0.05)(图3B)。根据一室模型计算得各药动学参数如表2。脂质体组的消除速率常数小于纳米粒,k约为后者的1/3。脂质体的胞内滞留能力大,MRT约为20 h,与溶液组接近。
2.5 细胞毒性实验结果 两种空白载体在实验浓度条件下,均未发现明显的细胞毒性。载药颗粒的抗增殖作用和IC50值见图4。顺铂脂质体体外抗肿瘤活性显著大于纳米粒。
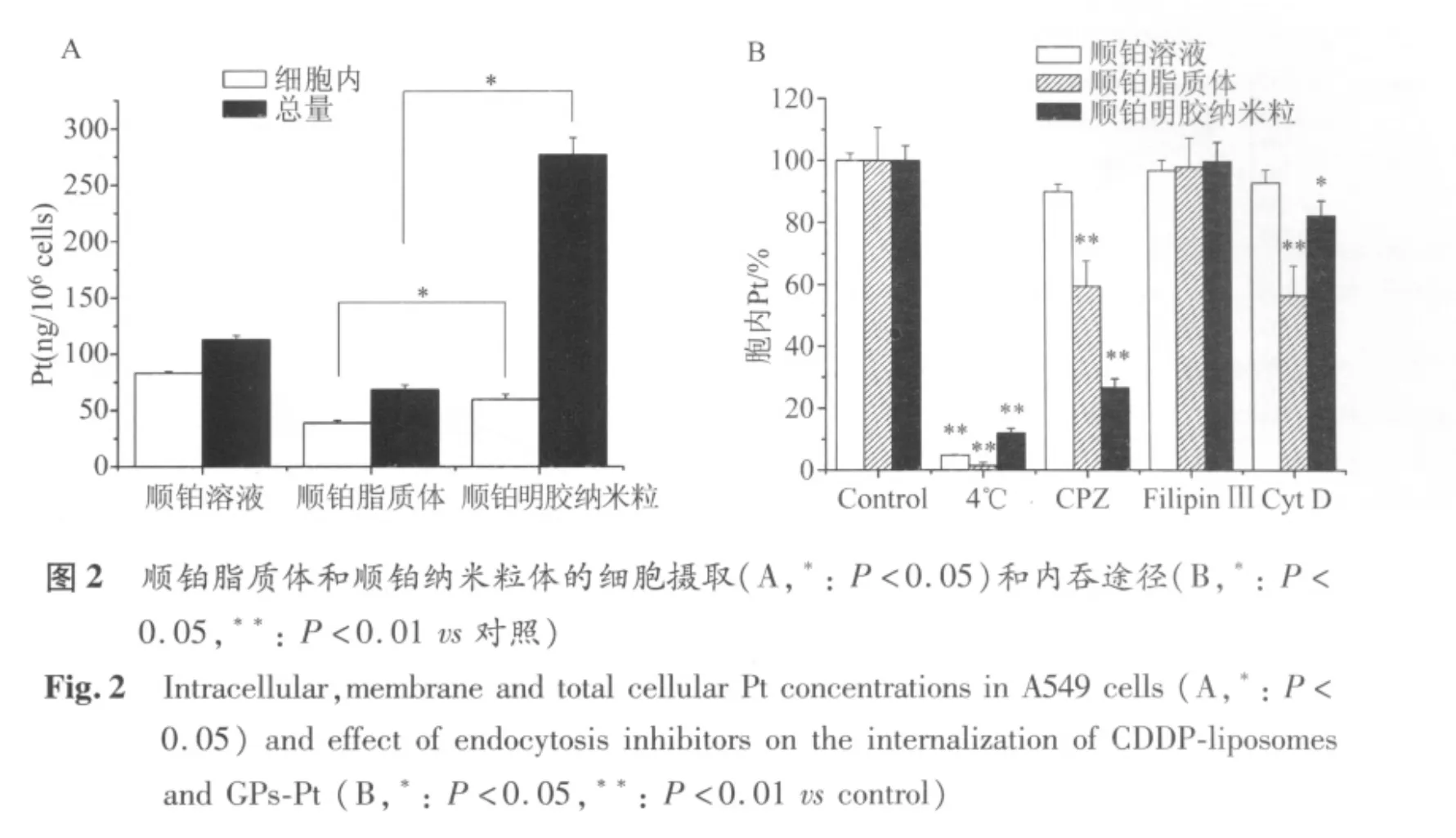
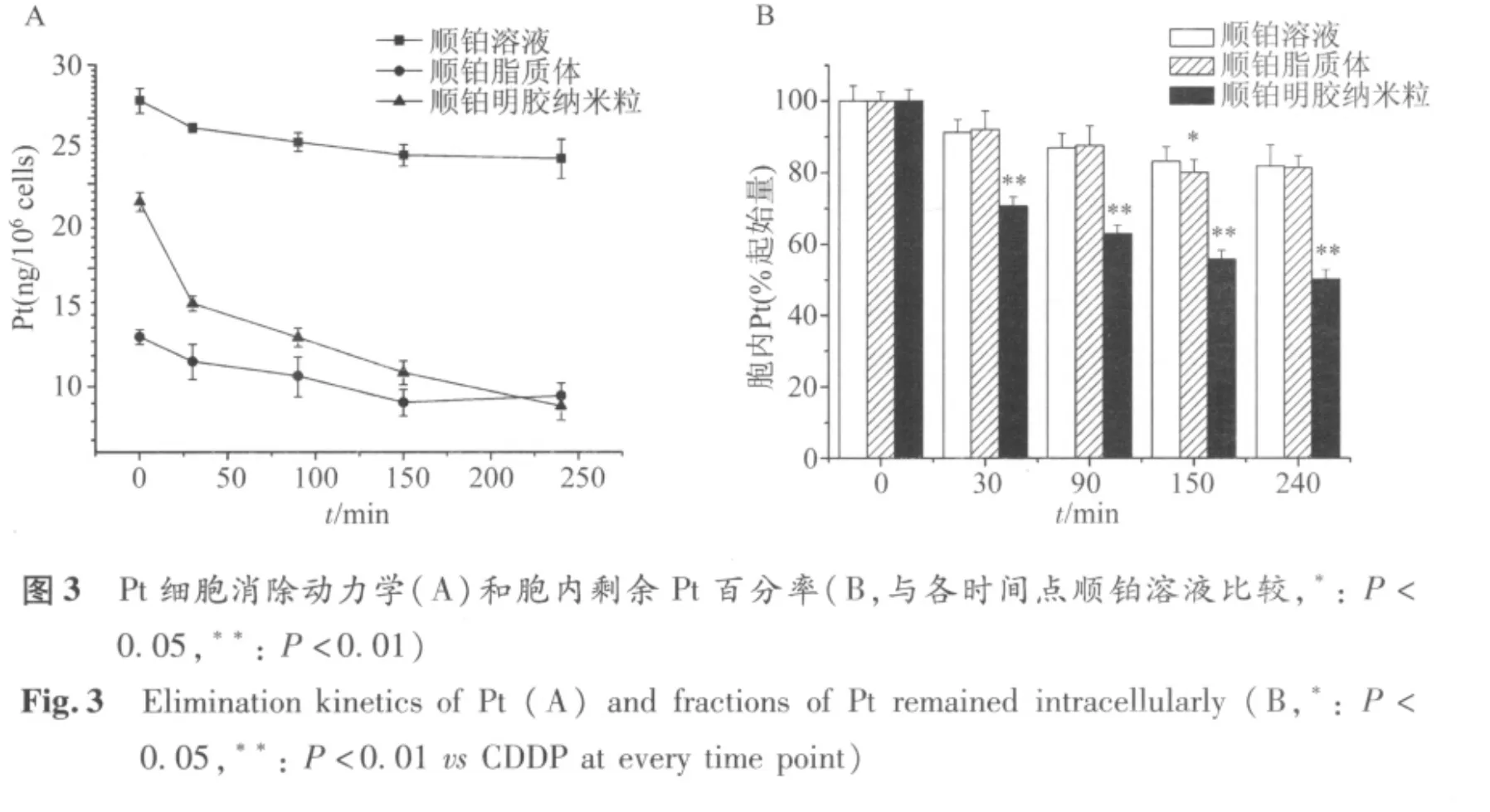

表2 顺铂细胞消除动力学参数Table 2 Cellular efflux parameters for CDDP and CDDP-nanocarriers
3 讨论
为保证载体可比性,我们通过调节工艺制备了粒径、电位、载药量、体外释放相近的两种顺铂载体。脂质体和纳米粒72 h累积释放约30%,可保证后续的细胞实验过程中药物不从或仅少量从系统中释放,避免游离药物摄取而干扰实验结果。
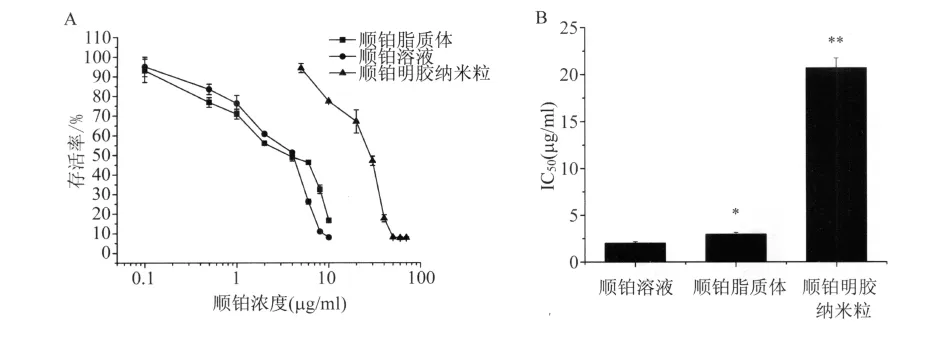
图4 顺铂脂质体和纳米粒体外抗肿瘤活性(A)和IC50值(B,与顺铂溶液比较,*:P<0.05)Fig.4 Cytotoxicity of CDDP-nanocarriers and CDDP solution towards A549 cells(A)and their IC50s(B,*:P <0.05 vs CDDP)
从Pt摄取结果分析,两种纳米载体均能不同程度地被细胞摄取。胞内药物含量以顺铂溶液为最高,两种载体中,明胶纳米粒的摄取水平较高。这主要和药物内化效率有关。顺铂分子是通过被动扩散和铜离子转运蛋白家族主动转运入胞的[10],而两种纳米载体的细胞摄取均受CPZ和低温抑制,表明脂质体和纳米粒是通过相对低效的颗粒内吞途径入胞的。结合非律平和CytD的抑制结果,说明clathrin介导的内吞和大胞饮参与了脂质体的内吞,通过两种途径入胞的药物各占一半。明胶纳米粒主要依赖clathrin途径入胞,少量粒子通过大胞饮内吞。由于纳米载体构成的差异,使其内吞途径呈现出多样性[11],继而影响内化水平和胞内传递过程。纳米给药系统的细胞膜吸附在摄取实验中普遍存在,吸附力强的粒子可在细胞表面或病变部位有更长的滞留时间,有利于持续释放药物。本实验使用了胰酶消化法来处理吸附载体[12],两种纳米载体均增加了药物的细胞膜吸附,其中,明胶纳米粒的吸附力比脂质体更强,这与载体材料和细胞膜之间的亲和力有关。
顺铂入胞后主要与DNA和胞浆蛋白结合,游离分子通过铜外排转运体ATP7A/ATP7B[13]被排出细胞。通过对消除比例的分析我们发现,纳米粒组的药物消除率远高于脂质体和溶液组,后者的胞内滞留能力更好。以一室模型拟合计算药动学参数(表2),结果显示脂质体的消除速率常数小于纳米粒,MRT与溶液剂相当。顺铂溶液的AUC最大,纳米粒最小。这可能和载体的胞内传递过程有关。纳米颗粒被内吞后,会经过内体、溶酶体等细胞内膜系统而被消化和降解,从而导致载体结构的破坏和药物的释放[14]。另一部分未被降解的载体颗粒则可经回收内体被视作异物排出细胞[15]。从载体消除实验结果分析,脂质体可能在胞内某些内膜结构中被破坏,将物理包裹的顺铂释放出来,游离的药物分子继而与靶点结合,因此消除比例和溶液组类似。而明胶纳米粒经过交联后在胞内的降解时间较长,小分子明胶降解片段与药物仍然以共价键的方式结合,需要通过离子交换实现顺铂的释放[16]。因此,GPs-Pt的缓慢释放使顺铂分子难以及时地与胞内靶点结合,而未完全降解的粒子则可能通过回收过程被清除出细胞。
从细胞摄取结果分析,顺铂明胶纳米粒的内化水平比顺铂脂质体高。而消除动力学结果显示,顺铂脂质体较顺铂明胶纳米粒更利于实现胞内释放和胞内滞留。在两种因素的相互作用下,我们用抗细胞增殖实验评价两种纳米给药系统的体外抗肿瘤活性。脂质体和明胶纳米粒的IC50值均大于顺铂溶液,这与动力学AUC结果相符。尽管纳米粒的胞内摄取含量高于脂质体,但后者的抗肿瘤活性显著优于前者。这与纳米粒胞内释放少、消除多有关。
纳米载体的包裹改变了顺铂入胞途径和内化水平,对后续的细胞转运和药物外排均有影响。在敏感细胞中未发现脂质体或纳米粒增强顺铂抗肿瘤活性的趋势,但颗粒包裹顺铂具备降低药物毒性[17]、胞外缓释[18]、克服多药耐药等优势[19]。在A549细胞中,顺铂脂质体较明胶纳米粒有更长的胞内滞留时间和更大的AUC,抗肿瘤活性远高于纳米粒。顺铂脂质体是更适合顺铂发挥疗效的纳米载体。
[1]YAN F,ZHANG C,ZHENG Y,et al.The effect of poloxamer 188 on nanoparticle morphology,size,cancer cell uptake,and cytotoxicity [J].Nanomedicine,2010,6(1):170-178.
[2]PEETLA C,LABHASETWAR V.Biophysical characterization of nanoparticle-endothelial model cell membrane interactions [J].Mol Pharm,2008,5(3):418-429.
[3]VON GERSDORFF K, SANDERS N N,VANDENBROUCKE R,et al.The internalization route resulting in successfulgene expression depends on polyethylenimine both cell line and polyplex type [J].Mol Ther,2006,14(5):745-753.
[4]HO Y P,AU-YEUNG S C,TO K K.Platinum-based anticancer agents:Innovative design strategies and biological perspectives[J].Med Res Rev,2003,23(5):633-655.
[5]WERNYJ R P,MORIN P J.Molecular mechanisms of platinum resistance:stillsearching forthe Achilles'heel[J].Drug Resist Updat,2004,7(4-5):227-232.
[6]ARIENTI C,TESEI A,RAVAIOLI A,et al.Activity of lipoplatin in tumor and in normal cells in vitro[J].Anticancer Drugs,2008,19(10):983-990.
[7]TSENG C L,SU W Y,YEN K C,et al.The use of biotinylated-EGF-modified gelatin nanoparticle carrier to enhance cisplatin accumulation in cancerous lungs via inhalation [J].Biomaterials,2009,30(30):3476-3485.
[8]BURGER K N,STAFFHORST R W,DE VIJLDER H C,et al.Nanocapsules:lipid-coated aggregates of cisplatin with high cytotoxicity [J].Nat Med,2002,8(1):81-84.
[9]PELEG-SHULMAN T,GIBSON D,COHEN R,et al.Characterization of sterically stabilized cisplatin liposomes by nuclear magnetic resonance [J].BiochimBiophysActa,2001,1510(1-2):278-291.
[10]WANG D,LIPPARD S J.Cellular processing of platinum anticancer drugs[J].Nat Rev Drug Discov,2005,4(4):307-320.
[11]RYMAN-RASMUSSENJP,RIVIERE JE,MONTEIRO-RIVIERE N A.Variables influencing interactions of untargeted quantum dot nanoparticles with skin cells and identification of biochemical modulators [J].Nano Lett,2007,7(5):1344-1348.
[12]DI MARZIO L,MARIANECCI C,CINQUE B,et al.pH-sensitive non-phospholipid vesicle and macrophage-like cells:Binding,uptake and endocytotic pathway[J].Biochim Biophys Acta,2008,1778(12):2749-2756.
[13]SAFAEI R.Role of copper transporters in the uptake and efflux of platinum containing drugs[J].Cancer Lett,2006,234(1):34-39.
[14]DELLI CASTELLI D,DASTRŬ W,TERRENO E,et al.In vivo MRI multicontrast kinetic analysis of the uptake and intracellular trafficking of paramagnetically labeled liposomes[J].J Control Release,2010,144(3):271-279.
[15]JIN H,HELLER D A,SHARMA R,et al.Sizedependent cellular uptake and expulsion of singlewalled carbon nanotubes:single particle tracking and a generic uptake model for nanoparticles[J].Acs Nano,2009,3(1):149-158.
[16]KONISHI M,TABATA Y,KARIYA M,et al.In vivo anti-tumor effect through the controlled release of cisplatin from biodegradable gelatin hydrogel[J].J Control Release,2003,92(3):301-313.
[17]LI X,LI R,QIAN X,et al.Superior antitumor efficiency ofcisplatin-loaded nanoparticles by intratumoral delivery with decreased tumor metabolism rate[J].Eur J Pharm Biopharm,2008,70(3):726-734.
[18]DING D,ZHU Z,LIU Q,et al.Cisplatin-loaded gelatin-poly (acrylic acid) nanoparticles:synthesis,antitumor efficiency in vivo and penetration in tumors [J].Eur J Pharm Biopharm,2011,Epub ahead of print.
[19]KRIEGER M L,ECKSTEIN N,SCHNEIDER V,et al.Overcomingcisplatin resistance ofovarian cancer by targeted liposomes in vitro[J].Int J Pharm,2010,389(1-2):10-17.

