林可霉素利多卡因凝胶微生物限度检查方法研究
杨淑先,赵新霞,牛坡(.河南省食品药品检验所,郑州市450003;.河南省人民医院,郑州市450003)
林可霉素利多卡因凝胶为外用半固体抗菌制剂,需要控制微生物限度。但由于该制剂中林可霉素为水溶性的抗菌成分,可抑制微生物的生长,因此,不能通过常规法进行该药品的微生物限度检查;另由于凝胶为水溶性的基质,但具有一定的黏度,直接用薄膜过滤法也难以去除抗菌成分。因此,需建立合适的方法对该样品进行微生物限度检查。笔者通过反复探索,经多次试验,最终选用以0.05 mol·L-1的四硼酸钠溶液[1]为稀释剂,采用薄膜过滤法进行本品的微生物限度检查。方法学验证结果表明,该方法有效、可行,可用于林可霉素利多卡因凝胶微生物限度检查。
1 仪器与材料
1.1 仪器
HTY-2000A集菌仪(杭州泰林医疗器械厂);离心机(上海浦东物理光学仪器厂);一次性使用薄膜过滤器(北京牛牛基因技术有限公司);PYX-DHS细菌培养箱、MJ-160B霉菌培养箱(上海跃进医疗器械厂)。
1.2 菌种
枯草芽孢杆菌 [CMCC(B)63 501]、金黄色葡萄球菌[CMCC(B)26 003]、大肠埃希菌[CMCC(B)44 102]、白色念珠菌[CMCC(F)98 001]、黑曲霉[CMCC(F)98 003]、铜绿假单胞菌[CMCC(B)10 104]均来源于中国药品生物制品检定所。
1.3 培养基[2]
营养琼脂培养基、玫瑰红钠琼脂培养基、胆盐乳糖培养基、营养肉汤培养基、溴化十六烷基三甲铵琼脂培养基、甘露醇氯化钠琼脂培养基均由中国药品生物制品检定所提供。
2 方法与结果
2.1 菌液的制备[3]
接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌的新鲜培养物至营养肉汤培养基中,培养22 h;接种白色念珠菌的新鲜培养物至改良马丁培养基中,培养24 h。上述培养物用0.9%无菌氯化钠溶液制成每1 mL含菌数为50~100 cfu的菌悬液。接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基上,培养7 d,加入5 mL 0.9%无菌氯化钠溶液,将孢子洗脱,再用0.9%无菌氯化钠溶液稀释成每1 mL含孢子数为50~100 cfu的孢子悬液。
2.2 供试品溶液的制备[1]
取样品10 g,加0.05 mol·L-1四硼酸钠溶液(85%磷酸溶液调节pH至7.0)至100 mL,边加边研磨,使供试品充分乳化,作为1∶10供试品溶液。
2.3 回收率的计算[4]
试验组的加菌回收率(%)=[(试验组平均菌落数-供试品对照组平均菌落数)/菌液组平均菌落数]×100%;稀释剂对照组加菌回收率(%)=(稀释剂对照组平均菌落数/菌液组平均菌落数)×100%。
2.4 细菌检查方法的验证
2.4.1 试验组[5]。取1 mL 1∶10供试品溶液,注入500 mL pH7.0无菌氯化钠-蛋白胨缓冲液中,薄膜过滤,用45℃、pH7.0无菌氯化钠-蛋白胨缓冲液冲洗,冲洗量为每膜1 000 mL。在最后一次冲洗液中加入含50~100 cfu的试验菌菌悬液1 mL,过滤后取出滤膜,菌面朝上贴于营养琼脂培养基上。
2.4.2 菌液组[6]。取1 mL含菌数为50~100 cfu的试验菌菌悬液,注入平皿中,倾注营养琼脂培养基,培养。测定所加的试验菌数。
2.4.3 供试品对照组。取1 mL 1∶10供试品溶液,注入500 mL、pH7.0无菌氯化钠-蛋白胨缓冲液中,薄膜过滤,用45℃、pH7.0无菌氯化钠-蛋白胨缓冲液冲洗,冲洗量为每膜1 000 mL。过滤后取出滤膜,菌面朝上贴于营养琼脂培养基上。
2.4.4 稀释剂对照组。取0.05 mol·L-1四硼酸钠溶液1 mL,注入500 mL、pH7.0无菌氯化钠-蛋白胨缓冲液中,薄膜过滤,用45℃、pH7.0无菌氯化钠-蛋白胨缓冲液进行冲洗,冲洗量为每膜1 000 mL。在最后一次冲洗液中加入含50~100 cfu的试验菌菌悬液1 mL,过滤后取出滤膜,菌面朝上贴于营养琼脂培养基上。
上述各组培养后按规定方法计算菌落数,计算回收率;试验平行3次。菌落计数结果见表1,回收率结果见表2,其中供试品对照组均为无菌生长(表1中菌落数为2个平皿的平均值)。

表1 菌落计数结果(cfu)Tab 1Results of colony coun(tcfu)
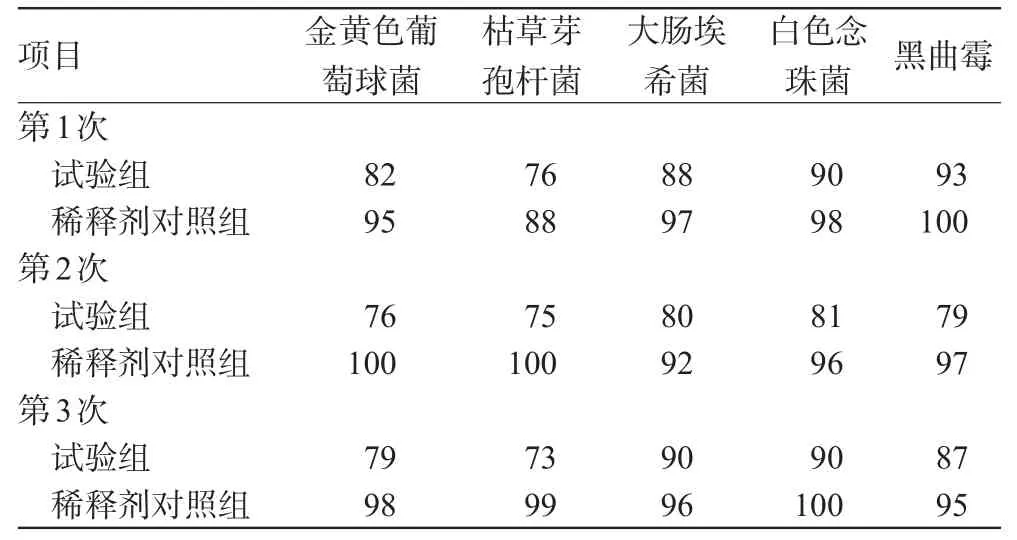
表2 回收率测定结果(%%)Tab 2Results of recovery tests(%%)
由表1、表2结果可知,3次试验中细菌回收率均大于70%。
2.5 霉菌和酵母菌计数方法的验证
2.5.1 试验组。取1∶10供试品溶液和含50~100 cfu的试验菌孢子悬液各1 mL,分别注入平皿中,立即倾注玫瑰红钠琼脂培养基,培养。
2.5.2 菌液组。取含菌数为50~100 cfu的试验菌孢子悬液1 mL,注入平皿中,倾注玫瑰红钠琼脂培养基,培养。测定所加的试验菌数。
2.5.3 供试品对照组。取1∶10供试品溶液1 mL,注入平皿中,立即倾注玫瑰红钠琼脂培养基,培养。
2.5.4 稀释剂对照组。取0.05 mol·L-1四硼酸钠溶液和含50~100 cfu的试验菌孢子悬液1 mL,分别注入平皿中,立即倾注玫瑰红钠琼脂培养基,培养。
上述各组培养后按规定方法计算菌落数,计算回收率;试验平行3次。菌落计数结果见表1,回收率结果见表2,其中供试品对照组均为无菌生长(表1中菌落数为2个平皿的平均值)。
由表1、表2结果可知,3次试验中霉菌和酵母菌回收率均大于70%。
2.6 控制菌检查方法的验证[7]
因样品为一般外用制剂,根据微生物限度要求,控制菌只做金黄色葡萄球菌和铜绿假单胞菌的检查。
2.6.1 试验组。取1∶10供试品溶液10 mL,注入500 mL、pH7.0无菌氯化钠-蛋白胨缓冲液中,薄膜过滤,用45℃、pH7.0无菌氯化钠-蛋白胨缓冲液冲洗,冲洗量为每膜1 000 mL。在最后一次冲洗液中加入含10~100 cfu的铜绿假单胞菌或金黄色葡萄球菌菌悬液1 mL,过滤后取出滤膜加至相应的100 mL培养基中培养,依相应菌的检查方法进行检查。
2.6.2 阴性菌对照组。方法同“2.6.1”项,只是加入菌悬液换为大肠埃希菌。
菌检结果见表3、表4(表中“+”表示菌生长,“-”表示未见菌生长)。

表3 铜绿假单胞菌控制菌验证方法试验结果Tab 3 Results of verification test for Pseudomonas aeruginosa
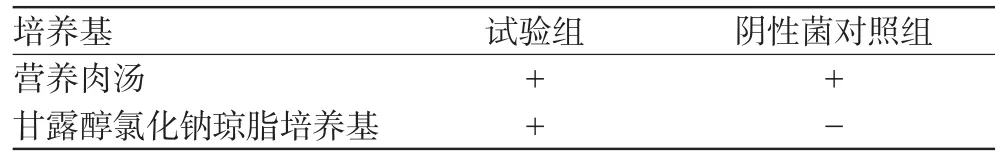
表4 金黄色葡萄球菌控制菌验证方法试验结果Tab 4 Results of verification test for Staphylococcus aureus
由表3、表4可见,试验组结果均为阳性,阴性菌对照组结果均为阴性,表明方法可行,结果符合要求。
3 讨论
(1)微生物限度检查法的方法学验证于2005年版《中国药典》执行以来,遇到了各种剂型的前处理问题,特别是具有抗菌活性的药品,既要保证彻底除去抗菌物质,又要注意所采用的方法对微生物的损伤程度[8],因此,应对所采用的必需的试剂进行方法学的验证试验,保证所采用的方法为有效的方法。
(2)本品含量测定时采用高效液相色谱法,其含量测定供试液处理时既要通过薄膜过滤进样,又要保证林可霉素溶解完全通过滤膜。本试验借鉴了这种处理方法,达到既可过滤、又能使林可霉素通过滤膜去除其抑菌作用的优点,从而使微生物在薄膜上有效截留,并对四硼酸钠溶液的pH值进行了控制,同时也证明在四硼酸钠在本试验使用量下对微生物无毒性。
(3)在微生物限度检查中,对于必须采用薄膜过滤法的品种,最大的困难是过滤速度较慢,因为多数品种为非全溶性的品种,只能采取上清液进行过滤。本品虽然为水溶性凝胶,但因凝胶的黏度严重影响过滤速度,因此,在分散凝胶的同时,选择直径较大的滤器,也是解决问题的有效途径;另外也可采用温度不超过45℃的冲洗液,降低黏度,提高冲洗速度。
(4)在微生物限度检查中,对于没有合适检查方法的品种,要充分了解供试品的本身特性及处方组成[9],甚至要了解有抗菌活性物质的抗菌谱,才有助于选择有效的方法,减少筛选的步骤[10]。本品中的林可霉素为抗细菌类抗生素,对真菌的抑制作用较弱,因此霉菌、酵母菌检查方法可直接试用常规法。细菌计数方法验证时采用薄膜过滤法,所用的冲洗量笔者曾以300、500、800、1 000 mL进行研究验证[11],最后确定1 000 mL冲洗量可达到消除抑菌活性的作用,同时稀释剂对照组菌回收率亦均超过70%。对于难过滤的品种,在过滤的同时进行振摇,有助于提高过滤速度。
(5)微生物限度检查时所采用的处理措施必须保证对微生物无毒性,本文所采用的四硼酸钠溶液(0.05 mol·L-1)经验证对微生物无毒性,可以作为前处理溶剂。
(6)对于抑菌活性较强的品种,又无理想的方法去除抑菌物质,可以制备1∶20的供试液,降低抑菌物质的浓度,增大接种体积,保证接种总量不变。但同时平皿培养基的量或者液体培养基的量应相应增加,以保证微生物的生长环境。
[1] 国家药典委员会编.国家药品标准(化学药品地方标准上升国家标准)[S].第2册.2002:147.
[2] 王文丽,马庆惠.药品微生物限度检查方法的影响因素及对策[J].中国医疗前沿,2007,2(17):90.
[3] 国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录ⅪJ.
[4] 李近磊,王嘉怡,迟丹怡,等.复方克林霉素凝胶微生物限度检查法的方法验证研究[J].中国药房,2010,21(25):2 380.
[5] 李秋菲,唐振宏,张 芹,等.4种大环内酯类药物微生物限度检查方法验证[J].中国药业,2008,17(13):20.
[6] 严 红,薛 坤,张月丹.11种口服中成药微生物限度检查方法验证[J].中国药房,2010,21(11):1 029.
[7] 易大为,陈 野,潘 强.薄膜滤过法在局部给药制剂微生物限度检查中的应用[J].中国药事,2008,22(4):342.
[8] 汤 杨.克霉唑口腔药膜微生物限度检查方法的建立[J].贵阳中医学院学报,2008,30(4):27.
[9] 李凌云,邵红燕.红霉素眼膏微生物限度检查方法的研究[J].中国药事,2007,21(8):614.
[10] 罗书香.药品微生物限度检查方法验证资料分析[J].中国药事,2007,21(7):525.
[11] 王海华,韦 涛.复方地塞米松乳膏微生物限度检查方法的验证试验 [J].广西中医学院学报,2008,11(3):47.

