关于环氧乙烷灭菌残留风险控制的探讨
郭准 毛省侠
1 国家食品药品监督管理局药品认证管理中心 (北京 100061)
2 陕西省食品药品监督管理局医疗器械处 (西安 710065)
ISO 10993-7:2008《医疗器械生物学评价 第7 部分: 环氧乙烷灭菌残留量》是国际上公认的医疗器械环氧乙烷残留限量标准。新版标准的发布促使我国开展对GB/T16886.7和相关行业标准中环氧乙烷残留量的修订。《医疗器械生产质量管理规范(试行)》的实施也对环氧乙烷灭菌提出了新的要求。本文将概要分析环氧乙烷灭菌及残留量风险控制,不断提高各类人员对环氧乙烷残留量风险的认识。
1.环氧乙烷灭菌残留的风险
环氧乙烷(简称EO)是活泼的环醚,可破坏包括孢子甚至病毒在内的各种微生物,在一定的浓度范围内对微生物不仅有抑制作用,而且有致死效应。环氧乙烷在常温下为气态,在较大蒸汽压下,对灭菌物品穿透性强,可以穿透微孔达到物品的深部,且费用较低,是目前最主要的低温灭菌方法。环氧乙烷灭菌应用于精密仪器、医疗器械、合成材料和一次性医疗用品等灭菌。现在大部分医疗器械生产企业采用此法灭菌。
环氧乙烷挥发性(沸点 13.2℃)和可燃性大,为了安全,环氧乙烷通常以混合物的形式提供,混合物组成为10%的环氧乙烷和 90%的二氧化碳。将需灭菌或消毒的产品放在密闭室中,先抽真空,然后用环氧乙烷-二氧化碳混合气将容器升压到 13.6Kg,以提供足以在一定时间内可杀死微生物的环氧乙烷浓度所需的压力。为了使这类抗菌剂和微生物能保持紧密接触,通常先用蒸气熏蒸,然后用冲洗和抽真空方法除去绝大部分剩余未反应的环氧化物。
环氧乙烷能够高效地对医疗产品进行灭菌,在杀灭微生物的同时医疗产品上的环氧乙烷残留也会对使用者和患者的身体带来一定的毒害。其毒性包括两个方面:
一是环氧乙烷本身的毒性。通过呼吸器官吸入体内刺激呼吸道,引起恶心、呕吐、头昏、头痛、嗜睡等症状。严重者可引起肺水肿;通过皮肤、粘膜接触后,引起红肿、水泡及血泡,严重者可出现局部皮肤烧伤及粘膜组织灼伤,造成毛发脱落;超量进入人体血液内,可致红细胞溶解,补体灭活和凝血酶破坏引起全身性溶血;二是灭菌后生成物的毒性。环氧乙烷与氯元素接触产生毒性很大的氯醇,与水接触形成乙二醇,对环境和种植物的生产有很大的破坏作用。因此,各国都通过制定法规和标准对环氧乙烷残留进行限量控制。
2.环氧乙烷残留限量规定的比对

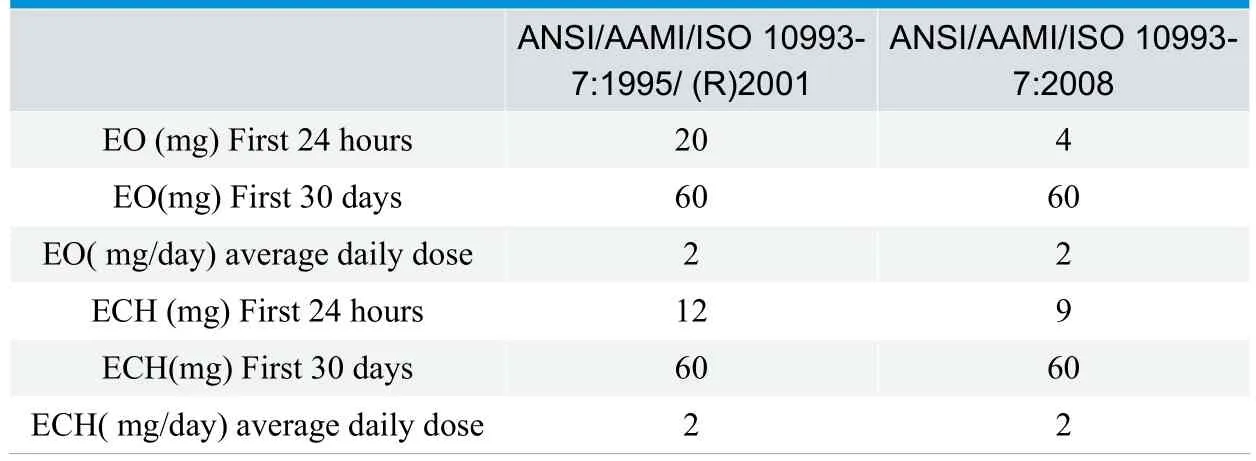
(1)短期接触类(<24h)
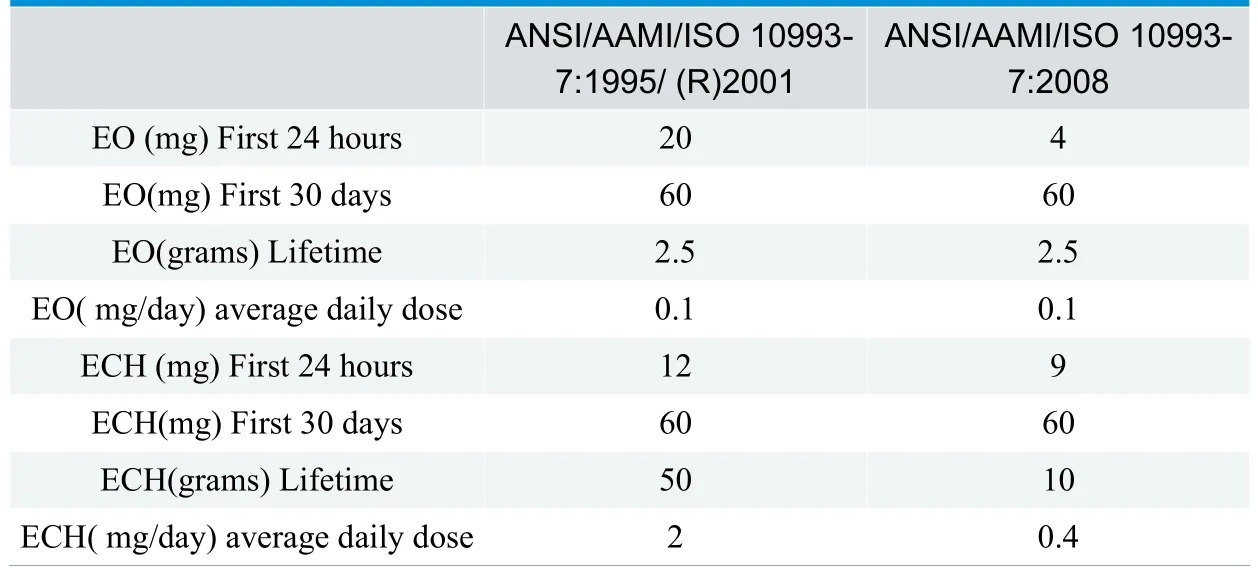
(2)长期接触类(>24h<30d)
(3)持久接触类(>30d)Permanent Exposure Devices (Greater than 30 days) :
2.1 环氧乙烷残留国际标准的变化
国际标准化组织ISO/TC 198制定的国际标准中给出了医疗器械环氧乙烷灭菌过程的开展、确认和常规控制的质量体系要求。ISO/TC 194制定的多个国际标准涉及到关于医疗器械的生物学试验、试验的选择和器械分类要求,有关环氧乙烷和其他灭菌过程残留量的具体要求,制定并发布了ISO 10993-7《医疗器械生物学评价 第7 部分: 环氧乙烷灭菌残留量》等国际标准。
新版ISO 10993-7:2008对ISO 10993-7:2002进行了技术修订,其中修改了环氧乙烷(EO)和2-氯乙醇(ECH)允许限量;增加了表面接触器械和植入物可耐受接触限量,并修改了特殊器械EO 和ECH 的平均日接触剂量。
2.2 国内标准中的环氧乙烷残留量
多年来,我国医疗器械环氧乙烷灭菌残留的限量执行GB/T16886.7-2001(等同采用ISO 10993-7-1995)的原则,并要求通过环氧乙烷灭菌来实现最终灭菌的医疗器械产品,企业在产品标准上必须明确环氧乙烷的残留量限值,作为出厂检验项目;分析方法按GB/T14233.1《医用输液、输血、注射棋局检验方法 第1部分:化学分析方法》的规定进行。
在我国已发布实施的产品行业标准中,对具体产品也明确规定了环氧乙烷残留限量要求,见表1。

(4)可耐受接触限量(TCL)
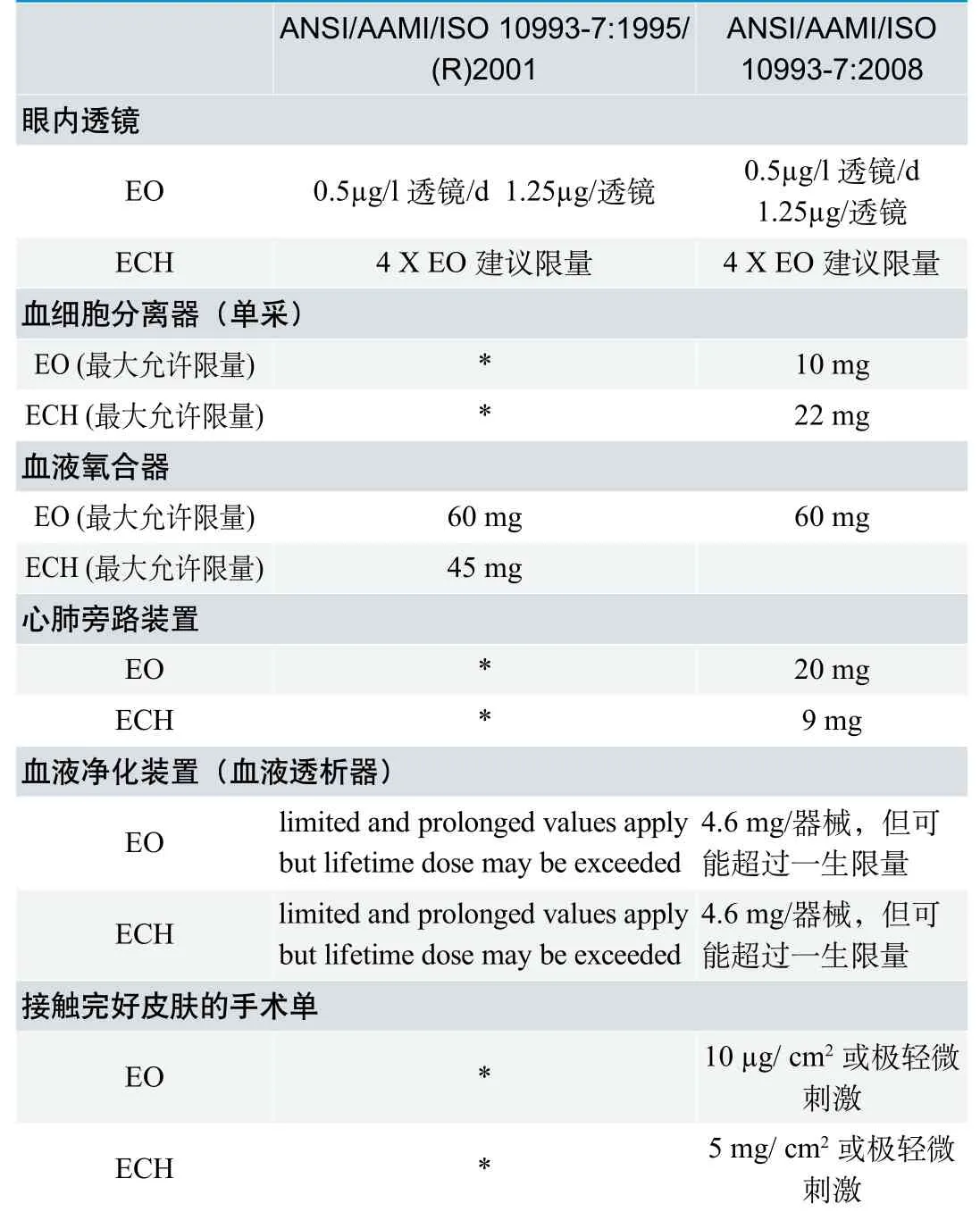
(5)特殊情况
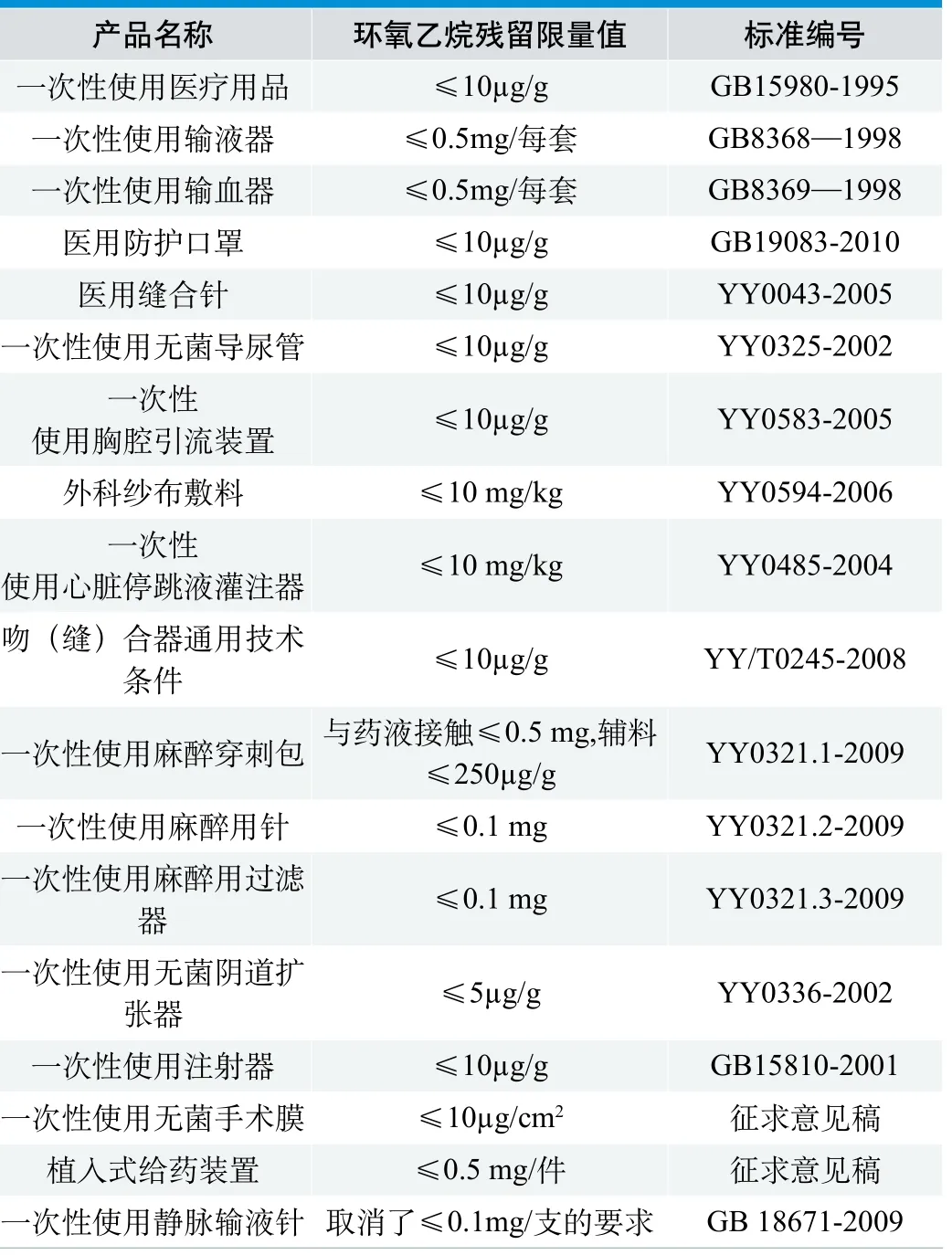
表1 国标、行标中规定的环氧乙烷残留量
3.环氧乙烷灭菌残留的风险控制
医疗器械在生产和设计时应考虑选择合适的材料和灭菌工艺以使残留量降至最低,以保证对患者造成的危害最小。针对种类繁多的医疗器械,在临床使用和人体接触时间和途径方面的差异,针对某一具体器械产品提出合理可行的限量是一个很复杂的问题。
3.1 灭菌对象的适用性
环氧乙烷(EO)可以杀灭大多数病原微生物,包括细菌繁殖体、芽孢、病毒和真菌,在医学消毒和工业灭菌上用途广泛,可以对不耐湿、不耐热物品进行低温气体熏蒸灭菌/消毒。
各种材料吸收、保持和释放EO 的能力有显著差异,当EO 有可能向ECH 转化时,两个由不同材料制成的相似器械,其残留量分布可能会有很大的不同。例如,材料能释放氯离子,便会对形成的ECH 浓度有很大的影响;对于含水产品,环氧化合物会首先与水反应而耗尽,并形成乙二醇。因此,环氧乙烷灭菌不适于食品、液体、油脂类、滑石粉和动物饲料等的灭菌。医用敷料、无纺布、合成医用乳胶手套等橡胶材料等,对环氧乙烷气体有很强的吸附性,吸附在这类产品上的残留量很难彻底解析,所以对此类产品不宜选用环氧乙烷灭菌。
有机物对环氧乙烷的杀菌作用有一定影响,因此,物品被灭菌前需彻底清洁、漂洗除去脓、血或其他有机物,晾干或抹干等除去水滴。
3.2 产品包装材料设计
环氧乙烷(EO)可对包装好的物品进行灭菌。凡经环氧乙烷灭菌的医疗器械产品,采用何种包装材料是很重要的。
多孔性和高分子合成材料比硬质光滑材料吸收量大,且扩散慢。各种包装材料对EO气体和其他可能残留物的透过或扩散能力有显著差
异,可能会影响ECH 残留量,应优先选择透气性、排水性好,细菌阻抗力强,对环氧乙烷吸收低等适合EO气体灭菌的包装材料。
适合于环氧乙烷灭菌的包装材料有纸、复合透析纸、布、无纺布、通气型硬质容器、聚乙烯、聚丙稀等,不能用于环氧乙烷灭菌的包装材料有金属箔、聚氯乙烯、玻璃纸。
目前一次性使用的医疗器械产品中的包装主要有全塑和纸塑两种,全塑包装采用聚丙稀薄膜袋,成本低,但室温下环氧乙烷气体自然挥发时间较长,残留量大;纸塑包装采用聚丙稀薄膜与医用透析纸复合包装,由于透析纸具有良好的透气和阻菌性能,环氧乙烷的灭菌和挥发效果都远胜过全塑包装,使环氧乙烷残留量近乎零,但需要专门的包装设备,一次成本较高。进口产品多采用纸塑包装形式。

包装的密度以及运输容器的密度也会有影响,包装材料还应满足GB/T 19633《最终灭菌医疗器械的包装》的要求。
3.3 环氧乙烷灭菌循环的验证和控制
环氧乙烷的灭菌作用受多种因素影响,只有准确而合理控制各种参数,才能很好地发挥其杀灭微生物作用,达到灭菌效果。如果首次进行灭菌,应该进行一次灭菌验证,改变包装材料也应重新验证,以保证被灭菌物品灭菌的可靠性。
EO 作用于器械的条件将影响残留量的水平,这些条件包括气体浓度、作用时间、温度、循环类型(也就是纯EO 或EO 混合物)、湿度(包括水源质量)、抽真空度与换气次数,以及在灭菌器内产品的装载密度或排列方式。使用剂量越大,材料中的残留量越大;作用温度越高,残留量越高;作用时间越长,残留量越大。
微生物的含水量和灭菌环境的相对湿度,对环氧乙烷的灭菌作用有显著影响,一般情况下,相对湿度应控制在50%~80%之间。环氧乙烷的杀菌作用与温度有密切的关系,应控制在摄氏37℃~55℃之间。在一定温度范围内,环氧乙烷的杀菌作用随浓度增加而加强;然而,在较高的温度下,提高环氧乙烷的浓度,灭菌效果亦不再有显著增加,一般浓度为400~800mg/L。环氧乙烷灭菌的时间是根据相对湿度、温度、浓度等及灭菌器的功能而定的。
经环氧乙烷灭菌的医疗器械必须按规定进行解析,主要有自然通风法、加热通风驱散法、微波驱散法,现代环氧乙烷灭菌器大多采用脉动真空法快速驱散残留环氧乙烷。通常纸塑包装灭菌后解析7天,全塑包装灭菌后解析14天。器械中的EO 残留量还与解析过程的通风温度、装载密度和排列、气流、堆码、被通风产品表面积、通风时间有关。有些材料的通风温度每增加10℃,通风速度可提高约1 倍(通风时间减少一半)。湿度、温度、空气流动等因素,可能会影响ECH 的形成,这取决于从灭菌器里取出产品后其中的EO 含量情况。
3.4 环氧乙烷残留的分析
产品完成灭菌过程后,从灭菌批中抽样进行日常分析。当产品样品或其浸提液被运到远离灭菌地点的分析地点时,宜考虑到样品残留量与剩余批产品残留量之间是否会有误差,并应通过实验确定这些条件之间的关系。
对于由两种不同材料组成的一个器械,为使分析精确,须从两种材料上取有代表性样本进行分析。在考虑模拟产品正常使用时,器械的组成和体积尤为重要。
GB 18279 中规定了灭菌过程参数,但要正确分析在EO 作用后器械的残留量,有必要确认这些影响残留量的参数。可以通过分析有代表性的“最坏情况”,经EO 动力学研究来掌握一组相似的产品。一组相似产品的确定(是指在尺寸及用途、材料组成、包装、EO 作用、含水量以及暴露于环境条件等情况相似的产品)可以排除对产品系列每一种产品进行分析的必要性。
4.小结
限制环氧乙烷残留量对公众健康具有重要意义。对环氧乙烷残留的控制及风险管理仍需要监管部门和生产企业的高度重视,并需要对下列问题进行研讨:
(1)我国目前对环氧乙烷残留量规定执行GB/T16886.7-2001《医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量》(等同采用ISO 10993-7-1995)的原则,通常不大于10µg/g。新版ISO 10993-7:2008较ISO 10993-7-1995,对残留量限值进行了更严格的限制。目前国内对新版标准的转化正在进行中,新标准的采用将对国内各类产品的标准和灭菌控制提出更严格的要求。
(2)国标、行标中对产品用相对含量来表示EO残留量,与ISO10993.7表示方法有较大差异。ISO10993.7是用每天每人可接受限值的表达方法。相对含量适用于表示未知浓度的试液体,产品应选用绝对含量表示。
(3)在国内除注输器具生产企业强制要求有灭菌设备外,很多采用环氧乙烷灭菌企业,采取委托第三方灭菌的方式进行,因此,应当由有资格的人员负责设备维护灭菌的确认和常规控制及产品放行工作。
(4)包装材料成本和灭菌成本的权衡是企业要考虑的一个重要方面,体积越大,环氧乙烷含量绝对值越高。
[1]GB/T16886.7-2001《医疗器械生物学评价 第7 部分: 环氧乙烷灭菌残留量》ISO 10993-7:1995 Biological evaluation of medical devices -- Part 7: Ethylene oxide sterilization residuals
[2]ISO 10993-7:2008 Biological evaluation of medical devices -- Part 7: Ethylene oxide sterilization residuals
[3]GB 18279《医疗器械环氧乙烷灭菌确认和常规控制》
[4]GB/T 19633《最终灭菌医疗器械的包装》

