美国兽药产品不良反应事件管理
温 芳,刘艳华,杨永嘉,吴好庭,王在时
(中国兽医药品监察所,北京 海淀 100081)
兽药(注:本文兽药如非特别指明均指化学药品)不良反应事件管理是兽药风险管理的重要组成内容,对兽药不良反应事件的分析、汇总和评价有利于指导和规范兽药产品临床合理用药、有利于鼓励创新兽药的研究与发展,并且为兽药再评价和兽药使用说明书修订等提供科学依据,也对兽用药物流行学研究具有重要的价值和意义。
美国经过多年发展,已形成一套较为完善的兽药产品不良反应事件管理机制,发布并实施3个兽药不良反应事件管理行业指南,由畜主、兽医和兽药生产商报告不良反应事件,美国食品药品管理局(FDA)兽药中心(CVM)对报告的不良反应事件进行收集、分析和评价并将评价结果反馈给生产商等;而我国虽然目前在《兽药管理条例》和兽药企业GMP中均规定要建立兽药产品不良反应报告制度,并报告当地兽医行政管理部门[1-2],但对于如何管理却缺乏相关技术以及法规支持,也没有形成部门间协调和反馈机制[3]。本文通过对美国兽药产品不良反应事件管理机制的研究,旨在为我国开展相关工作提供参考和借鉴。
1 概述
美国兽药产品不良反应事件由FDA管理,FDA兽药中心依据药品风险管理行业指导原则《良好药物警戒性规范和药物流行病学评估的行业指南》中相关要求起草了兽药产品不良事件管理的3个行业指导原则,经国际兽药产品注册技术要求合作和协调委员会批准于2010年6月最终全部发布并实施。
FDA兽药中心发布兽药不良反应报告表格(1932、1932a),规定了兽药不良反应事件提交要求和方式,建立不良反应事件提交追踪和报告系统(STARS),由CVM的监督和服从部门对兽药不良反应事件进行分析、汇总和评价,以期对可能需要的兽药安全性和有效性特性进行调整。
2 行业指导原则
依据《良好药物警戒性规范和药物流行病学评估的行业指南》相关原则要求,CVM制定并颁布了3个兽药产品药物警戒性-不良反应事件报告管理、不良反应事件报告条款目录控制和不良反应事件提交数据要素3个行业指导原则,这3个指导原则文件最终由VICH批准,被成员国和一些观察员国家采用,并于2010年6月起正式实施。这3个指南文件对不良事件报告的管理、提交程序和提交数据元素等方面进行了标准化规定。具体简介如下。
2.1 不良事件报告管理(GL24VICH) 这一指南中的术语和定义倾向于协调一致先前使用的相同概念术语,并对指南范围内的术语或行为进行定义,规定了不良事件报告的提交程序。该指南仅适用于市场化使用后的兽药产品自然发生的不良反应事件。
2.2 术语控制列表(GL30VICH) 管理当局和行业合作制定了控制术语列表和它的维护程序,为将来发展需要,这一列表提供了一个足够记录、搜索和分类的列表目录,并规范了术语分组、分组大小以满足标准化的输入和分析。这个术语列表通过VICH秘书处网站和RA网站可以获得,并依据维护程序要求保持在线更新。详细描述了提交AER所要求的强制性数据元素和非强制性数据元素,并对数据元素描述内容和格式进行标准化要求。
2.3 不良事件报告提交数据元素(GL42VICH) 当收到遵守VICH指导原则的电子报告,所有的系统必须能输入和储存所有的报告信息包括标准术语和代码,没有信息缺失。在特定情况下,对提交一些不完整的不受控制内容条款有一些规定,这些数据元素足够全面覆盖来自大多数原始资料、不同的设置和传送方式或要求的复杂报告。
3 不良反应事件报告的提交
FDA鼓励兽医或畜主报告兽药不良事件,通常首先应报告给兽药产品生产商的技术服务兽医,并完成1932表格填写,若为FDA未批准用作动物用药或不希望提交给兽药生产商可直接提交给CVM,并完成1932a表格填写,1932和1932a表格均为CVM设计用于收集不良反应事件,这两个表格均可在FDA网站查询到,填写内容需符合兽药产品不良反应事件3个指导原则对提交信息的要求,标准化的不良反应事件提交元素利于国际间的协调。
“兽药产品药物警戒-不良反应事件报告管理”指导原则中规定不良反应事件报告(AER)信息流转如图1。
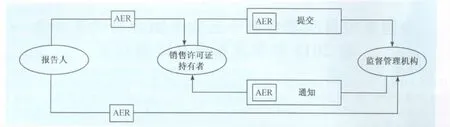
图1 AER信息流转示意图
CVM收到一份AER后,收录到中心资料控制部并设定一个提交编号,交给CVM 监督与服从部处理,CVM安全评价人员(有经验的临床兽医)评价每一个AER,评价人员将所有的相关信息,如年龄、动物种、病史和合并用药等输入Oracle数据库,该数据库的名称为提交追踪和报告系统(STARS),评价人员用Kramer计算方法,对报告的每个临床表现进行评估,药物和临床相关程度评价分值为-9到+7之间。临床表现评价分值≥0被认为是可能的或确切地与药物相关。
4 对不良反应事件报告的分析评估
CVM有专职兽医对兽药不良反应事件进行评价。不良反应事件是指由使用兽药引起的任何不良反应,不良反应事件包括产品的无效、缺陷和与动物药品使用相关的人类安全,收集不良反应报告的目的是进行数据收集,对于新兽药(销售少于3年)不良反应事件的收集是很重要的[4],这些数据用来评估趋势和临床信号出现的相对频率和疗效缺失,评估对最初批准标签的修订、制剂改变、产品包装改变或进一步的临床研究,少数情况下,这些信息可能导致药物从市场退出,并且应用这些数据监控包括野生动物和人类使用的安全关注点标签外用药[5]。CVM通过多种渠道和公众进行相关信息交流包括定期在其网站上发布对不良反应事件的评价和分析[6]。
CVM在网站上发布的药物ProHeart 6不良反应评价案例如下。
1只4岁的阉割杂种狗,身体状况良好,犬恶丝虫检测阴性,接受Proheart 6标签剂量注射,8d后呕吐。标签最初标注的不良反应有呕吐、腹泻、疲倦、体重减轻、惊厥、发烧等;引起呕吐的可能因素有饮食改变、肠内寄生虫、呕吐病史及器官畸形等;有用的信息包括兽医进行的身体检查、用药史、药品的评价、兽医的意见和查询的资料;不完整的信息包括有饮食结构的改变、寄生虫检查阴性、未进行血液检测。结果见表1。
依据Kramer判定标准判定呕吐可能和用药有关。
5 建议和意见
由于每个国家养殖业发展水平及人民饮食结构和习惯的不同导致动物养殖方式和品种不同,所以我们应在参考和借鉴一些国家先进经验的基础上,建立一套适合我国国情的兽药产品不良反应事件管理机制。通过对美国兽药不良反应事件管理的研究,对我国兽药产品不良反应事件管理提出以下几点思考意见和建议。

表1 应用校准后的kramer方法计算得出的评价分数
在管理层面上看,美国形成一套完善的不良反应报告体系。兽医和畜主可将兽药不良反应事件报告给兽药生产商,也可直接报告给CVM,并有专职兽医进行评价,评价信息通过多种渠道反馈给兽药生产商等,并且这些数据可作为兽药再评价的技术资料以及评判兽药从市场退出的依据。而我国虽然在《兽药管理条例》和兽药GMP验收中都要求建立兽药不良反应报告制度,并报告当地兽医行政管理部门,但缺乏完整实施体系,这也是地方兽医行政部门对接受不良反应报告存在的一些困扰。
从技术层面上看,美国发布3个不良反应事件管理指南规定了不良反应报告流程,并对不良反应报告中的要素进行标准化定义,1932表格和1932a表格依据这3个不良反应事件管理指南进行设计,并通过校准后的Kramer计算方法对这些报告的不良反应事件进行分析和评价,为兽药再评价、兽药安全使用以及人类安全保障提供科学依据。我国目前基本未开展相关工作,美国相关工作对我国具有重要借鉴意义。
通过对美国兽药不良反应事件管理研究可以看出,因其侧重从单个报告的临床症状进行判断,所以对兽药安全性评价也有其局限性,美国已有兽医流行病学家参与到不良反应事件评价工作之中,所以我国在开展兽药不良反应事件管理的同时,也应开展药物流行病学研究,运用药物流行病学的病历对照的方法来鉴别不良反应事件在用药和非用药动物中出现的频率,以期对兽药的安全性使用做出一个更客观和科学的评价;另外我国养殖动物品种较多包括有一些特种经济动物等,而很少有专用于这些动物的兽药,所以尽快在我国开展兽药不良反应事件管理,也可指导使用者在一些特种经济动物方面更加安全有效的使用兽药,也可更好地促进我国养殖业的健康稳定发展。
[1]中华人民共和国国务院.兽药管理条例[Z].中华人民共和国国务院令第404号.2004.
[2]中华人民共和国农业部.兽药生产质量管理规范[Z].中华人民共和国农业部令第11号.2002.
[3]冯忠武.试论兽药管理法规的立法原则[J].北京:中国兽药杂志,2002,36(12):3-5.
[4]Hampshire V A,Doddy F M,Post L O,et al.Adverse drug event reports at the United States Food and Drug Administration Center for Veterinary Medicine[J].J Am Vet Med Assoc,2004,224(2):177.
[5]Keller W C,Bataller N,Oeller D S.Processing and evaluation of adverse drug experience reports at the Food and Drug Administration Center for Veterinary Medicine[J].J Am Vet Med Assoc,1998,213(2):208-211.
[6]Bataller N,Keller W C.Monitoring adverse reactions to veterinary drugs.Pharmacovigilance[J].Vet Clin North Am Food Anim Pract,1999,15(1):13-30,vii-viii.

