黄瓜矮化突变体膨胀素Cs-EXPA2基因的克隆与表达分析
王多佳 黄莎莎 李凤兰 李金阳 胡宝忠
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
黄瓜矮化突变体膨胀素Cs-EXPA2基因的克隆与表达分析
王多佳 黄莎莎 李凤兰 李金阳 胡宝忠*
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
采用RT-PCR的方法克隆了黄瓜矮化突变体中膨胀素Cs-EXPA2基因,并对其苗期88 h内生长过程中 mRNA水平表达量的差异进行了研究,探讨膨胀素基因对矮化的影响与作用。结果显示,Cs-EXPA2在黄瓜矮化突变体的下胚轴、根、子叶中均有不同程度的表达,利用Real-time PCR分析得出Cs-EXPA2的表达量随时空变化,Cs-EXPA2在下胚轴中的表达模式为“低-高-低”,在根中的表达模式为“高-低-高”。
黄瓜矮化突变体;膨胀素;Cs-EXPA2;克隆;Real-time PCR
致谢:本试验得到东北农业大学园艺学院秦智伟教授的支持,在此对园艺学院黄瓜课题组一并表示感谢。
黄瓜(Cucumis sativus L.)为我国和世界广泛栽培的蔬菜品种之一,但大多数黄瓜品种都为蔓生品种,田间栽培占地面积大,土地利用效率低。本试验选用的黄瓜矮化突变体 D0462,其表型为植株矮小(只有30 cm高),节间缩短,几乎不分枝,同时在苗期就表现出下胚轴极度缩短(仅2~3 cm)的明显矮化性状(孟婧 等,2009)。利用矮化突变体是选育黄瓜矮化品种的有效途径,利用这一资源,可以选育适宜机械化操作的品种,增加种植面积,提高生产效率。
自 McQueen-Mason等(1992)从黄瓜下胚轴发现膨胀素蛋白(Expansin)以来,人们对膨胀素在植物生长中的作用进行了大量研究。研究结果表明,Expansin参与多个器官组织如叶(Fleming et al.,1997)、花(Cosgrove,2000;Pezzotti et al.,2002)、果实(Rose et al.,1997)、根(Wu & Cosgrove,2000)的生长发育过程,并对细胞壁降解、种子的生长和萌发、干旱胁迫处理等产生反应(Cho & Cosgrove,2002)。但膨胀素对植物矮化发育的直接影响报道甚少。本试验克隆了黄瓜矮化突变体与正常株高品种苗期的下胚轴、根、子叶中的膨胀素基因Cs-EXPA2,并且通过Real-time PCR的方法分析了Cs-EXPA2基因的组织表达差异和时空表达量差异,探讨膨胀素基因在矮化黄瓜生长发育中的作用。
1 材料与方法
1.1 材料
黄瓜矮化突变体 D0462,对照为正常株高品种129,均由东北农业大学园艺学院黄瓜课题组提供。2009年9月15日于东北农业大学生命科学学院植物组织培养室内培养箱中培养,28 ℃光照16 h,20 ℃黑暗8 h,分别在破土后16、24、40、48、64、72、88 h剪取D0462和129的下胚轴、根和子叶作为试验材料,剪取的组织迅速置于液氮中,-80 ℃保存备用。
1.2 RNA的提取、cDNA的合成及黄瓜Cs-EXPA2基因的克隆
用Trizol法(Invitrigen公司)提取各取样时间点各器官的总RNA,cDNA第1链合成按照Takara公司的PrimeScriptTMRT-PCR Kit反转录试剂盒说明书进行。根据Genebank中Cs-EXPA2(登录号为U30460.1),使用Primer Premier5.0软件在CDS两侧设计特异引物,得到1对能有效扩增 Cs-EXPA2编码区的引物(FP:5′-TCTGCTCCATCCTTACTTCTTCATCATC-3′;RP:5′-CACCCCTAAACCCACGATCCTAGAC-3′)。以第1链cDNA为模板进行中间片段扩增,反应条件为94 ℃5 min,94 ℃30 s,56 ℃30 s,72 ℃30 s,共35个循环,最后72 ℃延伸10 min。反应产物经1 %琼脂糖凝胶检测后回收,克隆入pMD18-T载体,转化大肠杆菌DH5α,提取质粒鉴定后由华大基因公司测序。测序结果用DNAMAN软件分析,并利用NCBI(http://ncbi.nlm.nih.gov/)的BLAST在线分析工具对Genbank的核算数据库序列进行比对分析。
1.3 Real-time PCR分析
TaqMan探针法测定Cs-EXPA2基因的不同时空表达量,利用Primer Express2.0设计荧光定量探针引物,在检测探针所在靶序列的两端设计普通引物(FP:5′-GGTGGTGTAACCCTCCGCTT-3′;RP:5′-CCCTGTAAATGCCGATCTTCTG-3′;探针:FAM-AGCATTTCGACATGGCTCAGCCTGCBHQ),扩增200~500 bp片段作为阳性克隆基因。以黄瓜β-actin基因(登录号为AB010922)为内参,设计探针内参(FP:5′-GTGTGAGTCACACTGTTCCCATC-3′;RP:5′-AGCAAGGTCCAAACGGAGAA-3′;内参探针:FAM-AGGGTTACGCCCTCCCTCATGCC-BHQ1)。引物与探针均由南京博仕公司合成。应用ABI PRISM7500实时定量PCR仪,以各个取样时间点的cDNA为模板,按照试验手册进行PCR扩增。反应程序为:预变性95 ℃30 s,PCR反应40个循环,95 ℃5 s,60 ℃34 s。反应结束后分析扩增曲线。每个反应3次重复,Ct值取平均值。根据2-△△ct法(Kenneth et al.,2001)测定基因的相对表达量,每样品3次重复。
2 结果与分析
2.1 Cs-EXPA2基因的克隆与分析
将黄瓜下胚轴RNA反转录后经PCR扩增得到一条大约950 bp的条带(图1),将PCR产物与 T载体连接,转化DH5α后,经蓝白斑筛选得到的阳性克隆进行测序。测序结果经 DNAMAN软件分析表明于该基因有完整的ORF区,利用NCBI的BLAST在线分析工具与Genbank的核酸数据库序列进行比对分析,二者同源性达到99 %以上,表明Cs-EXPA2克隆成功。
2.2 Cs-EXPA2的时空表达分析
Cs-EXPA2基因在矮化突变体 D0462和正常株高品种129下胚轴中的表达量都呈先增加后降低的趋势,在破土88 h内都有峰值出现,但矮化突变体较正常株高品种出现峰值的时间晚大约24 h,同时矮化突变体的峰值(破土后48 h)较正常株高品种(破土后24 h)高,但之后迅速降低,甚至降到低于正常株高品种的水平(图2-a)。
矮化突变体D0462与正常株高品种129根中Cs-EXPA2的表达量在破土16 h内几乎相等,但之后两者的表达量都迅速下降,到破土48 h时矮化突变体Cs-EXPA2的表达量超过正常株高品种,但随后两者的表达量又都逐渐增加,正常株高品种中Cs-EXPA2的表达量增幅明显大于矮化突变体,并始终高于矮化突变体(图2-b)。
矮化突变体D0462子叶中Cs-EXPA2基因的表达量呈增加—降低—增加—降低的模式,破土64 h后表达量基本保持不变,而正常株高品种129则在破土64 h以前表现为下降,64 h以后快速上升,72 h达到峰值随后又迅速下降到与矮化突变体D0462几乎一致的水平(图2-c)。
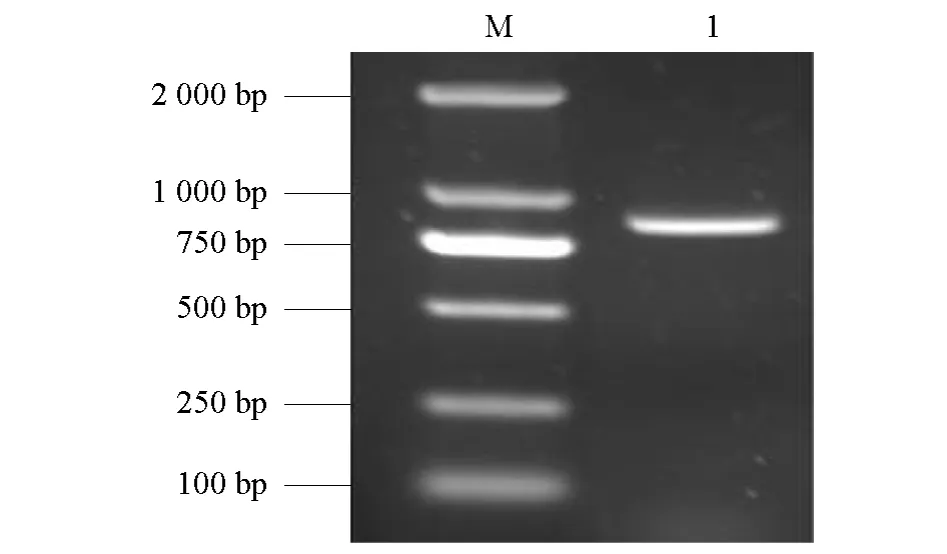
图1 Cs-EXPA2基因的扩增结果M,DL2000kb;1,D0462。
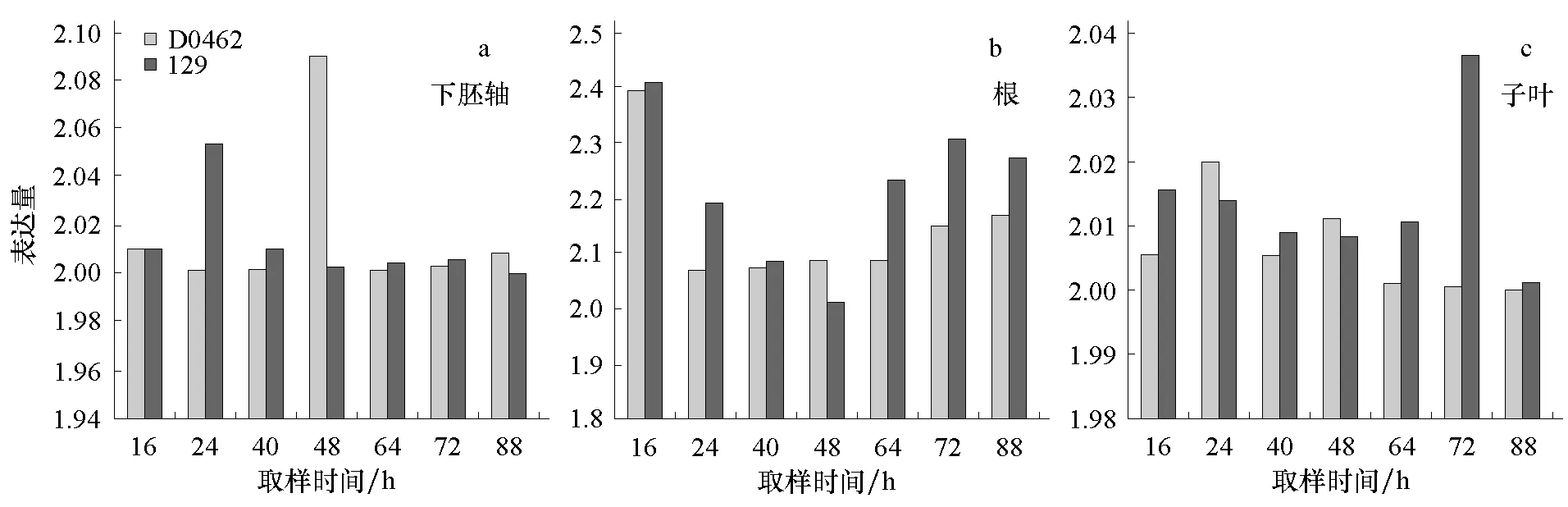
图2 Cs-EXPA2在黄瓜下胚轴、根、子叶中的表达
Cs-EXPA2在矮化突变体子叶中的表达量与正常株高品种在破土64 h前差异不明显,但在破土后64~72 h正常株高品种Cs-EXPA2的表达量要明显大于矮化突变体,可以认为子叶在破土后64~72 h细胞生长膨胀的速度最快。
3 结论与讨论
膨胀素含量的增加或减少会影响植物生长,已经证实膨胀素基因的过量表达会加快转基因植物的生长(陈爱国和陈进红,2003;孙涌栋 等,2008)。而膨胀素基因的表达量也确实对植株的生长有一定的作用,本试验中黄瓜矮化突变体Cs-EXPA2基因在大多时间的表达量都小于正常株高品种,而在相同时间内,矮化突变体的下胚轴也始终短于正常株高品种129,此结果与孟婧等(2009)的研究结果一致。
膨胀素基因的表达具有时空差异,在不同组织或同一组织不同生长时期的表达量各不相同(Cosgrove & Li,1993)。Harrison等(2001)在研究果实发育机理时发现,不同的膨胀素基因在果实发育过程中存在高-低-高,低-高-低和逐渐增加等3种不同的表达模式,孙涌栋等(2006)在黄瓜果实中克隆得到的CsExp10基因的表达模式为“低-高-低”。Cs-EXPA2基因在矮化突变体D0462与正常株高品种129的下胚轴中的表达模式均为“低-高-低”,而在根中的表达模式为“高-低-高”,子叶中的表达模式大体为“低-高-低”。但D0462与129下胚轴和子叶中Cs-EXPA2表达量峰值出现的时间不同,根中Cs-EXPA2表达量峰值出现的时间却相同。这可能是由于基因的时空表达差异导致了材料表型上的差异,但Cs-EXPA2到底起到了何种作用还有待进一步的试验。
已有研究证明,黄瓜植株株高是由单基因体系和多基因体系共同决定的(孙小镭 等,1990),膨胀素基因是一个多基因家族,包括EXPA、EXPB、EXLA和EXLB,每个家族又有多个亚家族,其中EXPA家族含有12个亚家族(Sampedro et al.,2006)。家族中不同成员可能参与了不同的生长发育过程(Shin et al.,2005),此前对Cs-EXPA2同一亚家族的Cs-EXPA1的研究发现,Cs-EXPA1在不同组织的表达量与本试验中 Cs-EXPA2并不完全相同,其时空表达量也有一些差异(另文待发表),这也说明了即使同一亚家族的成员其功能也会有差异。由此推断Cs-EXPA2单个基因的影响不能决定植物的矮化,应该是家族成员共同协作的结果。单纯一个基因的缺失或者表达量的降低并不是植物矮化的决定因素,但可能起到了某种积极的作用。
陈爱国,陈进红.2003.Expansin 的研究进展.植物学通报,20(6):752-758.
孟婧,李凤兰,孙莉莉,李成雁,胡宝忠.2009.矮化黄瓜幼苗对外源GA处理的生理反应.东北农业大学学报,40(11):60-64.
孙小镭,邬树桐,宋绪峨.1990.中国矮生刺黄瓜品系特性研究初报.园艺学报,17(1):59-64.
孙涌栋,张兴国,杜小兵,苏成刚,毕喜红.2006.黄瓜扩张蛋白基因CsEXP10的克隆与表达.植物生理与分子生物学学报,32(3):375-380.
孙涌栋,张兴国,罗未蓉,李新峥,刘遵春.2008.黄瓜果实扩张蛋白基因克隆与分析.西北植物学报,28(2):233-236.Cho H T,Cosgrove D J.2002.Regulation of root hair initiation and expansin gene.The Plant Cell,14:3237-3253.
Cosgrove D J,Li Z C.1993.Role of expansin in cell enlargement of oat coleoptiles.Plant Physiology,103:1321-1328.
Cosgrove D J.2000.Loosening of plant cell walls by expansins.Nature,407:321-326.
Fleming A J,McQueen-Mason S,Mandel T.1997.Induction of leaf primordial by the cell wall protein expansin.Science,276:1415-1418.
Harrison E P,McQueen-Mason S,Manning K.2001.Expression of six expansin genes in relation to extension activity in developing strawberry fruit.Journal of Experimental of Botany,52(360):1437-1446.
Kenneth J,Livak,Thomas D,Schmittgen.2001.Analysis of relative gene expression data using Real-time quantitative PCR and the2-△△ctmethod.Methods,25:402-408.
McQueen-Mason S J,Durachko D M,Cosgrove D J.1992.Two endogenous proteins that induce cell expansin in plant.Plant Cell,4:1425-1433.
Pezzotti M,Feron R,Mariani C.2002.Pollination modulates expression of the PPAL gene,a pistil-specific β-expansin.Plant Mol Biol,
49(2):187-197.
Rose J K,Lee K C,Bennett H H.1997.Expression of a divergent expansin gene is fruit-specific and ripening-regulated.Proc Natl Acad Sci,94(11):5955-5960.
Sampedro J,Carey R E,Cosgrove D J.2006.Genome histories clarify evolution of the expansin superfamily:new insights from the poplar genome and pine ESTs.Journal of Plant Research,119:11-21.
Shin J H,Jeong D H,Park M C,An G.2005.Characterization and transcriptional expression of the α-expansin gene family in rice.Molecules and Cells,20:210-218.
Wu Y J,Cosgrove D J.2000.Adaptation of roots to low water potentials by changes in cell wall extensibility and cell wall proteins.J Exp Bot,
51:1543-1553.
Cloning and Expression Analysis of Expansion Cs-EXPA2 Gene in Dwarf Cucumber
WANG Duo-jia, HUANG Sha-sha, LI Feng-lan, LI Jin-yang, HU Bao-zhong*
(Life Science College of Northeast Agricultural University, Harbin150030, Heilongjiang, China)
In this study, we cloned an expansion gene Cs-EXPA2 from dwarf cucumber(Cucumis sativus L.)D0462 by RT-PCR. We quantitatively detected its expression in hypocotyls, roots and cotyledons within88 h during cucumber seedling stage by Real-time PCR. The result shows that the level of its expression may be related to the state of cell growth and division in these sites, and the expression level shows obvious differences at different growth stages. The express quantity of Cs-EXPA2 changes along with temporal and spatial variation. The expression pattern of Cs-EXPA2 in hypocotyls is‘low-high-low’, and the expression pattern in roots is‘high-low-high’.
Dwarf cucumber; Expansion; Cs-EXPA2; Clone; Real-time PCR
S642.2
A
1000-6346(2011)02-0044-04
2010-07-27;接受日期:2010-09-13
黑龙江省自然科学基金(230340),教育部博士后科研基金(200802240008)资助
王多佳,女,博士研究生,专业方向:植物学,E-mail:wduojia2009@163.com
*通讯作者(Corresponding author):胡宝忠,教授,博士生导师,专业方向:植物学,E-mail:bzhu@neau.edu.cn

