不同浓度血管紧张素Ⅱ对人脐静脉血管内皮细胞衰老和P-选择素表达的影响
王雪妮 刘凌 刘泽 王鲁妮 吴军 王伟 封菊香
血管紧张素Ⅱ(AngⅡ)是肾素-血管紧张素系统中最重要的活性物质,它通过与受体相结合发挥相应的生理、病理作用,如血管平滑肌收缩、动脉血压升高等,可继发性引起动脉粥样硬化。但有研究发现,AngⅡ能刺激血管自由基的产生,促进血管内皮细胞炎症反应和功能障碍,加速血管内皮细胞衰老,参与动脉粥样硬化发生和发展的过程[1],提示AngⅡ参与动脉粥样硬化可能有另外其他的机制。P-选择素属于细胞黏附分子中的选择素家族,是内皮细胞损伤及血小板活化的特异性指标,可能参与动脉硬化的早期阶段[2]。本研究以建立AngⅡ诱导人脐静脉血管内皮细胞(HUVECs)衰老模型,观察AngⅡ对内皮细胞衰老及P-选择素表达的影响,探讨AngⅡ在动脉粥样硬化的发生、发展中所起的作用。
1 材料与方法
1.1 主要材料 人脐静脉血管内皮细胞株HUVEC由广州军区广州总医院医学实验科提供;RPMI1640培养基、胎牛血清购自美国HYCLONE公司;AngⅡ、CCK-8购自美国Sigma公司;Human's P-selectin Platinum ELISA试剂盒购自美国eBioscience公司;细胞周期流式细胞分析试剂盒、细胞衰老特异性β-半乳糖苷酶(β-gal)检测试剂盒购自上海杰美公司;倒置显微镜(Olympus公司,日本),酶标仪(Tecan Genios,瑞士),流式细胞仪(Miltenyi公司,德国)。
1.2 HUVEC的培养 HUVEC细胞株贴壁生长于含10%胎牛血清的RPMI1640培养基中,置于5%CO2、37℃培养箱中培养,每2 d换液1次维持细胞良好生长状态。待细胞长至融合时用0.25%胰蛋白酶消化、传代。HUVEC呈多角形,单层铺路石样紧密排列。
1.3 不同浓度AngⅡ诱导HUVEC衰老 将细胞(2.5×104个/孔)接种于24孔板中,每孔加入普通全培养基1 ml培养过夜。随机分为5组,分别为对照组及不同浓度AngⅡ组(10-8~10-5mmol/L)。待细胞长至亚融合时无血清培养12 h,使细胞达到同步化。弃去原培养液,对照组加入1 ml普通全培养液,药物组分别加入1 ml含不同浓度AngⅡ的全培养基,持续刺激48 h,第12 h和24 h各补充1次AngⅡ,建立AngⅡ诱导的HUVEC衰老模型[3]。
1.4 β-gal检测法检测细胞衰老情况 根据细胞衰老特异性β-gal检测试剂盒操作方法,将原培养板里的培养液弃去,每孔加入500 μl清理液,清洗细胞表面,弃去清理液后加入500 μl固定液室温下孵育5 min,抽去固定液,加入500 μl酸性液清洗细胞表面,再重复清洗1次后,每孔加入400 μl染色工作液,放入37℃培养箱中培养12 h后,在倒置显微镜下观察和计数。
1.5 流式细胞术分析衰老细胞周期变化情况 依据细胞周期流式细胞分析试剂盒说明,用PBS冲洗细胞表面2次,加入0.25%胰蛋白酶溶液消化收集约106个细胞,放入离心机离心5 min,速度为300 g;抽去上清液后,加入1号工作液500 μl轻轻混匀细胞,暗室里室温下孵育60 min后,加入2号工作液500 μl混匀,过筛后立刻上机检测进行细胞流式周期分析。
1.6 CCK-8法检测细胞存活率 细胞以5000个/孔接种于96孔板中,按上述造模方法诱导细胞衰老后,向每孔加入CCK-820 μl培养1 h,酶联免疫检测仪在450 nm下测定各孔OD值,以药物组与对照组OD值百分比代表细胞增殖率。每组设4复孔,重复3次。
1.7 ELISA检测培养基上清中P-选择素含量 将细胞(2.5×104个/孔)接种于24孔板中,每孔加入普通全培养基1 ml培养过夜。随机分为5组,分别为对照组及不同浓度AngⅡ组(10-8~10-5mmol/L),按照上述方法诱导细胞衰老后,取细胞培养液上清离心,再收集上清置于-20℃保存,然后按Human's P-selectin Platinum ELISA试剂盒说明操作,置于酶标仪在450 nm处测定吸光度,每组设3复孔,重复2次。
1.8 统计学分析 采用SPSS 16.0软件进行统计学分析。数据以平均数±标准差(±s)表示,计量资料比较采用单因素ANOVA(方差分析),P<0.05为差异有统计学意义。
2 结果
2.1 衰老相关β-gal活性 β-gal是一种鉴别细胞衰老的生物学标志[4]。β-gal染色结果显示,不同浓度AngⅡ处理HUVEC 48 h后,对照组几乎不表达β-gal(1.02±1.15)%,浓度为10-8~10-5mmol/L药物组细胞β-gal染色阳性百分率分别为(25.94±2.58)%、(51.37±2.76)%、(79.80±2.83)%、(91.81±1.53)%,与对照组相比,细胞衰老的数量随着AngⅡ浓度的增加逐渐增多(P均<0.01)。
2.2 细胞周期分析 流式细胞仪分析显示,HUVEC在不同浓度AngⅡ培养液中孵育48 h后,随着AngⅡ浓度的升高,G0/G1期细胞百分率逐渐增多,S期细胞百分率逐渐减少。与对照组相比,10-8和10-7mmol/L AngⅡ组无明显差异,10-6和10-5mmol/L AngⅡ组有统计学差异(表1)。
表1 不同浓度AngⅡ对细胞周期的影响(±s,%)
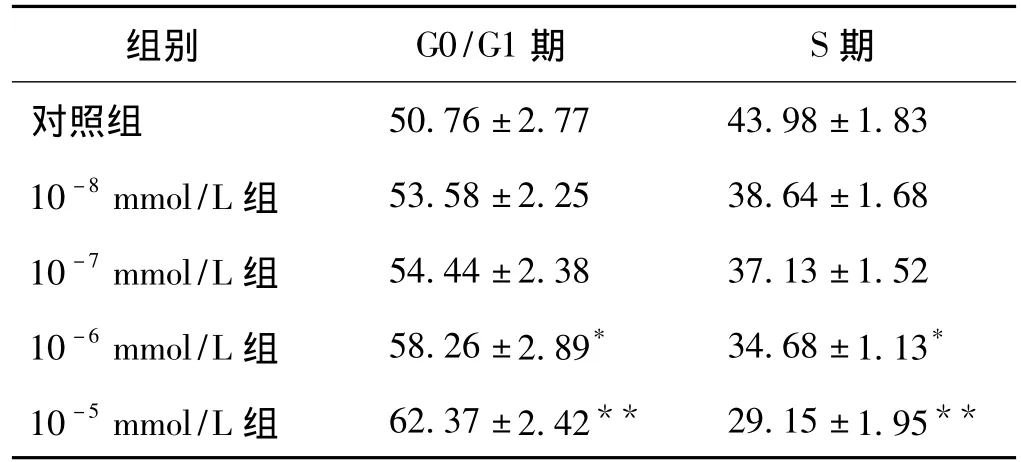
表1 不同浓度AngⅡ对细胞周期的影响(±s,%)
注:与对照组比较,*P<0.05,**P <0.01
组别 G0/G1期 S期对照组**50.76±2.77 43.98±1.8310-8mmol/L组 53.58±2.25 38.64±1.6810-7mmol/L组 54.44±2.38 37.13±1.5210-6mmol/L组 58.26±2.89* 34.68±1.13*10-5mmol/L组 62.37±2.42** 29.15±1.95
2.3 细胞存活率变化情况 经不同浓度AngⅡ培养48 h后,CCK-8法检测表明药物组存活细胞数与对照组相比明显下降(P均<0.01);并随AngⅡ浓度增高,细胞存活率逐渐下降(图1)。
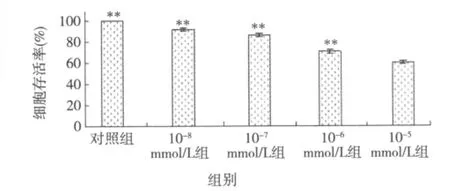
图1 不同浓度AngⅡ培养后存活细胞数
2.4 P-选择素表达含量的变化 对照组的P-选择素表达含量为(2.47±0.06)ng/ml,含不同浓度 AngⅡ(10-8~10-5mmol/L)组P-选择素含量分别为(39.68±0.35)ng/ml、(41.70 ± 0.45)ng/ml、(71.25 ± 0.29)ng/ml、(79.89 ±0.28)ng/ml,与对照组相比,随着 AngⅡ浓度的增加,P-选择素表达含量明显增多(P均<0.01)。
3 讨论
流行病学研究显示,年龄是动脉粥样硬化性疾病的主要危险因素之一,越来越多研究表明血管内皮细胞衰老在动脉硬化疾病的发病中起着重要的作用,衰老的血管内皮细胞会发生形态和功能上的变化,引起内皮功能障碍及血管壁结构的改变,血管内皮功能障碍是动脉粥样硬化的始动因素,导致动脉粥样硬化的发生和发展[5]。有研究显示,在动脉粥样硬化斑块内检测出较强的衰老相关β-gal活性,表明内皮细胞衰老与动脉粥样硬化的发生密切相关。本实验结果显示AngⅡ不同浓度组内皮细胞衰老相关β-gal活性与对照组相比明显增高,且呈浓度依赖性;而细胞周期及存活率的变化随着AngⅡ浓度的变化有逐渐降低的趋势,提示AngⅡ可呈剂量依赖性直接诱导内皮细胞衰老。
P-选择素是一种存在于血小板a颗粒及内皮细胞Weibel-Palade体中细胞表面黏附分子,它能够介导白细胞和血小板在内皮细胞上黏附、聚集、活化并释放炎性递质,参与炎症过程,可作为血小板活化和内皮细胞功能受损的重要分子标志物。本研究发现,AngⅡ作用于内皮细胞后能引起P-选择素的表达。有研究显示,P-选择素可以直接作用于小鼠血管内皮,引起炎症反应或血栓形成,导致血-脑屏障功能障碍及动脉粥样硬化,最终导致心脑血管疾病的发生[6]。本实验中AngⅡ不同浓度组的P-选择素的表达与对照组相比明显增加,并随着AngⅡ浓度的增加,P-选择素的表达逐渐增加,AngⅡ(10-5mmol/L)组作用于内皮细胞后P-选择素的表达达到高峰并维持在较高水平。这些结果提示AngⅡ可以通过增强P-选择素的表达调节血管壁的炎症反应参与动脉粥样硬化的发生。
有研究发现,AngⅡ通过氧化应激和激活凋亡信号能明显减少内皮祖细胞的数量、阻碍受损细胞集落形成和影响细胞迁移,与本实验结果特点相符,表明AngⅡ能直接诱导血管内皮细胞衰老及P-选择素的表达并呈剂量依赖性,但其作用机制仍需进一步研究证实。
[1]Kunieda T,Minamino T,Nishi J,et al.AngiotensinⅡ induces premature senescence of vascular smooth muscle cells and accelerates the development of atherosclerosis via a p21-dependent pathway[J].Circulation,2006,114(9):953-960.
[2]Blake GJ,Ridker PM.Novel clinical markers of vascular wall inflammation [J].Circ Res,2001,89(9):763-771.
[3]单海燕,白小涓,刘强,等.血管紧张素II诱导血管内皮细胞衰老的形态学研究[J].中国动脉硬化杂志,2007,15(3):161-164.
[4]Dimri GP,Lee X,Basile G,et al.A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J].Proc Natl Acad Sci USA,1995,92(20):9363-9367.
[5]Minamino T,Komuro I.Vascular cell senescence contribution to atherosclerosis[J].Circ Res,2007,100(1):15-26.
[6]Kisucka J,Chauhan AK,Zhao BQ,et al.Elevated levels of soluble P-selectin in mice alter blood-brain barrier function,exacerbate stroke,and promote atherosclerosis[J].Blood,2009,113(23):6016-6022.

