HPLC法测定丹参清解口服液中原儿茶醛和黄芩苷
吴丽红, 储忠英, 刘惠军
(上海市松江食品药品检验所,上海201600)
丹参清解口服液是复旦大学附属华山医院生产的医院制剂[1],由丹参、黄芩、白芷、桑白皮、麦饭石五味药材组成,其中丹参和黄芩是主药,具有清热解毒,活血化瘀之功效,在方中起着重要治疗作用。原制剂质量标准只有丹参和黄芩的定性鉴别和口服剂项下规定的检查项目,为了能更有效地控制该制剂质量,本实验采用HPLC法对制剂中所含原儿茶醛和黄芩苷同时进行定量测定。
1 仪器与试药
1.1 仪器 Agilent HP1100高效液相色谱仪(自动进样器,二极管阵列检测器,四元泵);万分之一电子分析天平(METTLER AG135);超声波清洗器(昆山市超声仪器有限公司)。
1.2 试剂 甲醇(色谱纯,德国默克),水为超纯水;其余试剂均为分析纯。
1.3 对照品 原儿茶醛对照品(110810-200506)、黄芩苷对照品(110715-200514)供定量测定用,均购自中国药品生物制品检定所。
1.4 样品 丹参清解口服液(复旦大学附属华山医院生产,规格为 10 mL/支,批号 20100708、20100904、20101118)。
2 方法与结果
2.1 色谱条件 色谱柱[2-4]:Eclipse XDB-C18(250 mm ×4.6 mm,5 μm);流动相[5]:甲醇为流动相 A,以1%醋酸溶液为流动相B,按表1中的规定进行梯度洗脱[2,5-8];检测波长[2,8-12]280 nm,体积流量 1.0 mL/min;进样量10μL,理论板数按原儿茶醛计算应不低于4 000。
2.2 对照品溶液的制备 分别精密称取原儿茶醛对照品和黄芩苷对照品适量,加50%甲醇制成每1 mL含原儿茶醛10μg、黄芩苷20μg的混合溶液。
2.3 供试品溶液的制备 精密吸取本品1 mL,置5 mL量瓶中,加 50% 甲醇适量[6-7],超声处理 30 min[11],放冷,加 50% 甲醇至刻度,摇匀,滤过,取续滤液作为测定原儿茶醛的供试品溶液;精密量取上述续滤液1 mL,置100 mL量瓶中,并稀释至刻度,摇匀,滤过,取续滤液作为测定黄芩苷的供试品溶液。
2.4 阴性空白样品溶液的制备 按处方组成,分别制备不含丹参和不含黄芩的两种阴性模拟制剂,照上述供试品溶液的制备方法制成空白溶液。
2.5 系统适用性实验 取供试品溶液、对照品溶液和两种阴性空白样品溶液,在上述色谱条件下进样10μL,记录色谱图,结果见图1~5。由色谱图知,理论板数按原儿茶醛峰计算不低于4 000,原儿茶醛的保留时间约12.4 min,黄芩苷峰的保留时间约26.0 min,阴性对照溶液在原儿茶醛峰和黄芩苷峰位置均无干扰峰。原儿茶醛、黄芩苷与其他组分可完全分离。
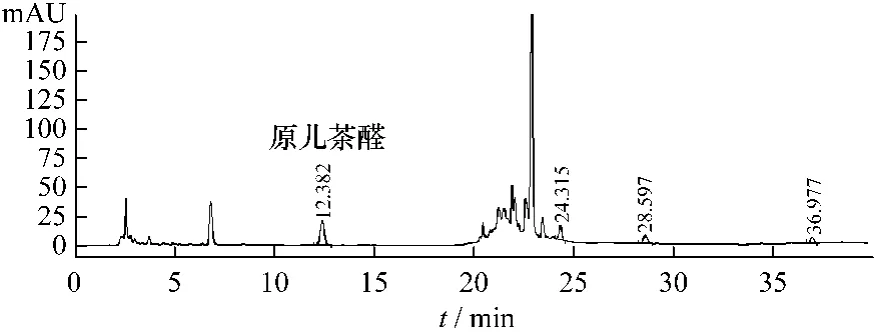
图2 不含黄芩阴性对照溶液HPLC色谱图Fig.2 HPLC chromatogram of negative sam p le w ithout Scutellariae Radix
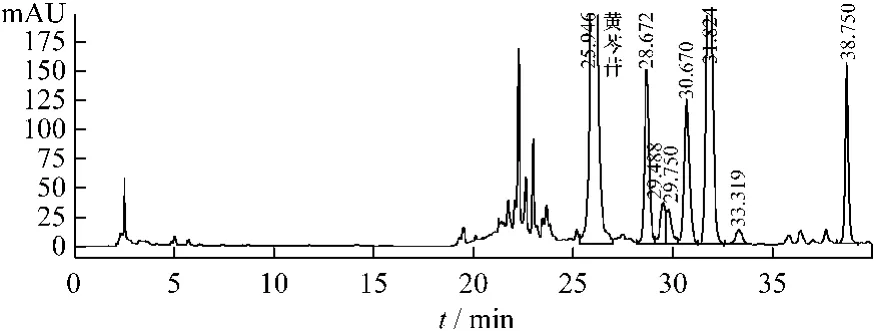
图3 不含丹参阴性对照溶液HPLC色谱图Fig.3 HPLC chromatogram of negative sam ple w ithout Salviaemiltiorrhizae Radix et Rhizoma
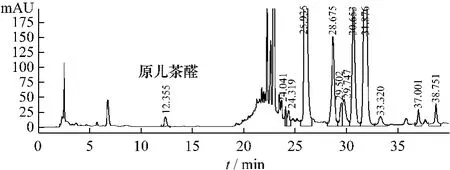
图4 原儿茶醛供试品溶液HPLC色谱图Fig.4 HPLC chromatogram of sam ple for protocatechuic aldehyde
2.6 线性范围

图5 黄芩苷供试品溶液HPLC色谱图Fig.5 HPLC chromatogram of samp le for baicalin
2.6.1 原儿茶醛线性 取原儿茶醛对照品配制成质量浓度分别为2.460、4.920、9.840、19.68、24.60、29.52 μg/mL 的系列溶液,分别进样 10 μL在上述色谱条件下测定峰面积,以质量浓度为横坐标,峰面积为纵坐标,测得回归方程:Y=44.700 83X-1.300 52,r=0.999 99,表明原儿茶醛在 2.460 ~29.52μg/mL范围内线性关系良好。
2.6.2 黄芩苷线性 取黄芩苷对照品配制成质量浓度分别为 4.844、9.688、19.376、38.752、48.440、58.126μg/mL的系列溶液,分别进样10μL在上述色谱条件下测定峰面积,以质量浓度为横坐标,峰面积为纵坐标,测得回归方程:Y=34.927 47X-1.492 65,r=1.000 00,表明黄芩苷在4.843 8 ~58.126 0μg/mL范围内线性关系良好。
样品测定时以外标法两点法计算原儿茶醛和黄芩苷的量。
2.7 精密度实验 分别精密吸取原儿茶醛、黄芩苷同一供试品溶液,连续重复进样6次,每次进样10 μL,测定原儿茶醛和黄芩苷峰面积积分值,结果原儿茶醛相对标准偏差RSD为0.18%(n=6);黄芩苷相对标准偏差RSD为0.24%(n=6)。
2.8 稳定性实验 分别精密吸取原儿茶醛、黄芩苷同一供试品溶液,分别于 0、2、4、6、8、10、24 h,精密吸取10μL注入液相色谱仪,测定原儿茶醛和黄芩苷峰面积积分值,结果原儿茶醛相对标准偏差RSD为0.13%;黄芩苷相对标准偏差RSD为0.11%。
2.9 重复性实验 取同一批供试品,分别平行制备6份供试液,分别精密吸取10μL,注入液相色谱仪,测定含量,原儿茶醛相对标准偏差RSD为1.27%(n=6),黄芩苷相对标准偏差RSD为1.08%(n=6),说明方法重复性好。
2.10 回收率实验 采用加样回收法,精密吸取已知量的样品(批号20100708)0.5 mL,精密加入原儿茶醛对照品溶液(质量浓度为0.024 6 mg/mL)和黄芩苷对照品溶液(质量浓度为4.843 8 mg/mL)各0.8 mL、1.0 mL、1.2 mL,按供试品溶液制备方法操作,制成原儿茶醛加样供试品溶液。精密吸取上述续滤液1 mL,按供试品溶液制备方法操作,制成黄芩苷加样供试品溶液。精密吸取上述加样供试品溶液10μL,注入液相色谱仪,按上述方法测定加样供试品溶液中原儿茶醛和黄芩苷的量,计算回收率,结果原儿茶醛平均回收率为100.5%,RSD为0.95%(n=6);黄芩苷平均回收率为100.5%,RSD为0.80%(n=6),结果见表2,3。

表2 原儿茶醛回收率实验Tab.2 Results of recovery test of protocatechuic aldehyde

表3 黄芩苷回收率实验Tab.3 Results of recovery test of baicalin
2.11 样品测定 按2.2项和2.3项制备成供试品溶液和对照品溶液,精密吸取供试品溶液及对照品溶液各10μL,注入液相色谱仪,依法测定,以外标法两点法计算原儿茶醛和黄芩苷的量,即得。结果样品批号为 20100708、20100904、20101118中原儿茶醛的质量浓度分别为 50.98 μg/mL、47.65 μg/mL、30.52 μg/mL;黄芩苷的质量浓度分别为 10.14 mg/mL、9.41 mg/mL、8.60 mg/mL,具体见表 4。

表4 样品测定结果(n=3)Tab.4 Determ ination results of sam ple(n=3)
3 讨论
3.1 检测波长的选择 因为是在一个系统中同时检测原儿茶醛和黄芩苷,所以找到他们共同的最大吸收波长尤为重要,取上述两种对照品加50%甲醇溶液于紫外扫描仪上绘制紫外吸收光谱,波长范围200~400 nm,结果原儿茶醛和黄芩苷均在(280±2)nm有最大吸收波长。
3.2 供试品提取方法的确定 在供试品的提取中,分别采取超声(20 min、30 min和60 min)、乙醚振摇提取[6](3、4、5 次)和加热回流(30 min、60 min、120 min)3种方法进行试验,结果发现原儿茶醛在超声30 min提取测得量最高,黄芩苷在上述各种提取方法中测定量结果相差不大,故选用超声30 min作为本实验供试品提取方法。
3.3 流动相比例确认 通过文献查找,发现测定原儿茶醛的流动相甲醇-1%冰醋酸(13∶87)较多,而测定黄芩苷的流动相甲醇-1%冰醋酸(45∶55)较多,两者流动相比例相差较大,本实验曾用甲醇-1%冰醋酸不同比例等度进行调节测试,均不能满意同时检测到两种成分,后经摸索采用梯度洗脱调节流动相比例能得到很好的峰形,分离完全,杂峰干扰少,理论塔板数高达10 000多。
3.4 丹参测定成分的选择 丹参有效成分较多,可分为脂溶性和水溶性两部分。脂溶性成分主要为丹参酮IIA,水溶性成分包括丹酚酸B、丹参素、原儿茶醛等。本制剂的制法是水煎法,脂溶性成分丹参酮IIA量很低,难以检测。同时由于中药复方中成分复杂,在实验条件下,水溶性成分丹酚酸B、丹参素与相邻峰不能分离,不符合定量测定要求。因此,本实验选择参考《中国药典》2010版丹红化瘀口服液的含量测定项,选择丹参有效成分原儿茶醛为测定指标成分。
3.5 测定方法 样品定量测定中每批所含的原儿茶醛和黄芩苷的量各不相同,可能是每批所用原药材含量不同所致,因此很有必要对原儿茶醛和黄芩苷的量作相应的控制。本方为复方制剂,药味虽不多,但成分复杂,经多次试验,结果表明本方法的色谱条件柱效最高,分离度大,精密度高,重复性好,无干扰,且配制简单,能有效地控制该制剂的内在质量。
[1]SYZ-ZF-003-2004.上海市食品药品监督管理局医疗机构制剂质量标准[S].
[2]卫生部颁药品标准:中药成方制剂第十七册[S].1998:174.
[3]吕文海,谭 鹏,宋 磊,等.山东临沂不同加工方法丹参饮片中原儿茶醛含量测定[J].中国中药杂志,2006,31(21):1825-1826.
[4]汲臣杰,李雪松.HPLC法测定丹参口服液中原儿茶醛的含量[J].黑龙江医药,2006,19(5):336-337.
[5]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:579.
[6]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:611.
[7]国家药品标准(新药转正标准)中药第39册[S].15.
[8]马家燕.对不同品种,不同产地丹参药材中原儿茶醛及丹参素含量的比较分析[J].中国乡村医药,2000,7(11):28-29.
[9]张玲莉,彭 燕,涂 毅.高效液相色谱法测定黄芩口服液中黄芩苷的含量[J],中国药师,2005(5):388-389.
[10]张 玲,徐新刚.9种含丹参中成药中原儿茶醛的含量测定[J].药物分析杂志,1997,17(4):253-255.
[11]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:401.
[12]徐德然,王康才,王峥涛,等.丹参中丹参素、原儿茶醛来源的初步研究[J].中国天然药物,2005,3(3):148-150.

