丹参红色素的离子稳定性及抑癌性研究
于纯淼,刘晓艳,张丽影,孟丹,国立东,于栋华
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.东北农业大学,黑龙江 哈尔滨150030;2.黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040)
天然绿色植物色素安全无毒,并且具有特有的营养价值和生理活性。丹参红色素作为一种天然色素,是从传统中药丹参中提取出来的脂溶性有效成分,为黄至深红色混合物质[1]。丹参红色素包括丹参酮Ⅰ、丹参酮ⅡA、丹参酮ⅡB、隐丹参酮、二氢丹参酮等,均含有邻醌或对醌的结构[2],在生物体内参与电子传递、机体的多种生物化学反应,对某些生化反应起促进或干扰作用,表现出抗癌[3]、抗菌[4]、抗病毒等多种药理作用。其中丹参酮ⅡA具有天然抗氧化作用,临床心血管药理作用表现在抗动脉粥样硬化、缩小心肌梗死面积、降低心肌耗氧量,对血栓形成以及血小板聚集功能有抑制作用,对多种肿瘤细胞具有杀伤、诱导分化和凋亡作用,并调节多种肿瘤相关基因的表达[5]。胃癌是我国常见恶性肿瘤之一,发病率、死亡率在各种恶性肿瘤中居首位。丹参红色素对人胃癌细胞作用的研究国内外尚未见报道。我们在研究丹参红色素金属离子稳定性的同时,以人胃癌细胞株SGC7901为观察对象,研究丹参红色素体外对胃癌细胞株SGC7901的抑制作用,以探讨丹参红色素的金属离子稳定性及其对人胃癌细胞SGC7901增殖的影响。
1 材料与方法
1.1 材料与试剂
丹参根茎(购于宝丰医药有限公司);丹参酮IIA标准品由中国药品生物制品检定所提供;蒸馏水;无水乙醇、乙酸乙酯均为分析纯。
1.2 仪器与设备
万能粉碎机(天津泰斯特仪器有限公司);RE-52型旋转蒸发仪(上海博通仪器设备有限公司);SHZ-3循环水多用真空泵(郑州杜甫仪器厂);AL-104型精密电子天平(上海梅特勒-托利多仪器设备有限公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);UVmini-1240紫外可见分光光度计(日本岛津);1640培养液(美国Hyclone);DMSO(天津市永大化学试剂开发中心);CO2细胞培养箱(上海博迅实业有限公司);IMT-413倒置荧光显微镜(日本OLYMPUS IMT-413);细胞培养瓶(Becton Dickinson);酶联免疫检测仪(美国BIO-RAD)。
1.3 实验方法
1.3.1 色素试样制备[6]
丹参→干燥→粉碎→溶剂提取→抽滤→滤液→减压浓缩→浸膏→溶剂萃取→脂层→回收溶剂→重结晶→色素成品。
1.3.2 色素紫外可见吸收光谱及最大吸收波长的测定
将色素试样配制成一定浓度的乙醇溶液,在300~700nm波长范围内进行光谱扫描,以确认丹参红色素的最大吸收波长。
1.3.3 丹参红色素的金属离子稳定性研究[5,7]
精确称取一定质量的丹参色素成品溶于50%乙醇中,配成一定浓度的色素溶液备用。按1∶3的比例将配制好的不同浓度的 Na+、K+、Mg2+、Ca2+、Cu2+及Fe3+溶液加入备用色素溶液中,隔2天于最大吸收波长处测定吸光值。其中 Na+、K+离子浓度为0.05mol/L、0.1mol/L、0.15mol/L 及0.2mol/L;Mg2+浓度为 0.05mol/L、0.1mol/L、0.15mol/L;Ca2+浓度为1mmol/L、5mmol/L、10mmol/L、20mmol/L;Fe3+的浓度为 0.05mmol/L、0.1mmol/L、1mmol/L;Cu2+浓度为1mmol/L、5mmol/L、10mmol/L。
1.3.4 丹参红色素的抑癌性研究
采用四唑盐(MTT)比色法测定细胞生长[8-9]:取对数生长期SGC7901细胞,调整细胞浓度为1×105个/ml接种于96孔培养板,每孔补足RP-MI1640培养液至180μl。37℃、5%CO2、饱和湿度下培养。待细胞贴壁后换新培养基,实验孔依次加入不同浓度丹参红色素药液各 20μl,药物终浓度分别为 5、10、15、20μg/ml;对照孔中无水乙醇终浓度为2%;实验组及对照组均设5个复孔。分别检测丹参红色素作用48h后对细胞生长的影响。于培养结束前4h,各培养孔加入10μl MTT,37℃继续培养4h后,小心吸弃孔内培养液,每孔内加入150μl DMSO,振荡15min使结晶充分溶解[8]。于酶标仪上读取各孔光吸收值(A),测量波长λ=492nm,参考波长 λ=620nm,按下式计算抑制率。
抑制率(%)=(1-实验孔A均值/对照孔A均值)×100
2 结果与分析
2.1 丹参红色素最大吸收波长的确定
将结晶纯化后的丹参红色素溶于无水乙醇中,配成一定浓度的丹参红色素溶液,于紫外可见分光光度计上在300~700nm范围内进行扫描,以确定丹参红色素-乙醇溶液的最大吸收波长。经扫描,色素-乙醇溶液的最大吸收波长为450nm。
2.2 Na+对丹参红色素稳定性的影响
不同浓度Na+对丹参红色素稳定性影响结果如图1所示。图1表明,添加了Na+的色素溶液放置18天之内,与对照CK相比,Na+对丹参红色素稳定性影响不大。当色素溶液中Na+的浓度低于0.15mol/L时,色素溶液的吸光值低于对照CK,但随着色素溶液中的的浓度由0.05mol/L增加到0.15mol/L时,色素吸光值有所增加;当色素溶液中Na+的浓度大于0.15mol/L时,色素的吸光值大于对照CK。由此可见,较高浓度的Na+对丹参红色素具有一定的护色作用,而低浓度的Na+对丹参红色素有一定的不良影响,原因有待进一步研究。

图1 不同浓度Na+对色素稳定性的影响Fig.1 Effects of Na+on the stability of the Salvia red pigment
2.3 K+对丹参红色素稳定性的影响
不同浓度K+对丹参红色素稳定性的影响如图2所示。由图2可以看出,添加K+的色素溶液从开始即明显高于对照CK。在放置18天之内,添加K+的丹参红色素溶液吸光度变化趋势与对照CK相似,且随着溶液中K+浓度的升高,色素溶液的吸光值就越大。由此可见,K+对丹参红色素具有一定的增色作用,且K+浓度越高,增色作用越明显。

图2 不同浓度的K+对丹参红色素稳定性的影响Fig.2 Effects of K+on the stability of the Salvia red pigment
2.4 Mg2+对丹参红色素稳定性的影响
不同浓度Mg2+对丹参红色素稳定性的影响如图3所示。由图3可以看出,刚加入Mg2+时,色素的吸光值明显增大。随着Mg2+浓度的增加,色素吸光值增加幅度也增大,但当浓度超过0.10mol/L时,色素溶液的吸光值又有所降低。从图3还可以看出,添加Mg2+的丹参红色素溶液在放置18天之内,吸光值明显大于对照CK。在0~12天时,对照CK和添加了Mg2+的色素溶液吸光值均呈现减小趋势,添加了Mg2+的色素溶液吸光值降幅大于CK;在12~18天时,色素溶液吸光值又有所增加,可能是由于丹参红色素中的一些单体结构发生了变化或相互发生了转化[10]。
2.5 Ca2+对丹参红色素稳定性的影响
不同浓度Ca2+对丹参红色素稳定性的影响如图4所示。由图4可以看出,添加了Ca2+的丹参红色素溶液在放置18天之内,其吸光值明显高于对照CK,这说明Ca2+对丹参红色素具有一定的增色作用。在0~9天、12~18天,添加了Ca2+的丹参红色素溶液其吸光值与CK呈现出了相反的变化趋势;9~12天时吸光值变化趋势相似。
2.6 Fe3+对丹参红色素稳定性的影响
不同浓度Fe3+对丹参红色素稳定性的影响如图5所示。刚开始向色素溶液中加入Fe3+后,色素溶液色泽发生了变化,且随着Fe3+浓度的增加,色素颜色逐渐由樱红色变成黑褐色,当浓度达到1mmol/L时,色素溶液还产生了黑色絮状沉淀。由图5可以看出,添加3种不同浓度的Fe3+-丹参红色素溶液在放置18天之内,其吸光度降幅均大于CK,且随着Fe3+浓度的增加,色素溶液的吸光值越小。同时,随着存放时间的延长,添加Fe3+的色素溶液的絮状沉淀也逐渐增多。研究还发现,在0~6天,添加Fe3+的色素溶液吸光值下降,可能是由于Fe3+对色素的破坏作用;9~18天时色素溶液吸光值有所增加,可能是沉淀增加的原因。由此可见,Fe3+对丹参红色素有不良影响。

图3 不同浓度的Mg2+对丹参红色素稳定性的影响Fig.3 Effects of Mg2+on the stability of the Salvia red pigment

图4 不同浓度的Ca2+对色素稳定性的影响Fig.4 Effects of Ca2+on the stability of the Salvia red pigment

图5 不同浓度的Fe3+对色素稳定性的影响Fig.5 Effects of Fe3+on the stability of the Salvia red pigment
2.7 Cu2+对丹参红色素稳定性的影响
不同浓度Cu2+对丹参红色素稳定性的影响如图6所示。从图6可以看出,当向丹参红色素溶液中加入Cu2+后,溶液吸光值在逐渐增大,且Cu2+浓度越大,溶液的吸光值也越大。但在研究中发现,色素溶液在储藏12天后,添加了10mmol/L Cu2+的色素溶液开始产生少量黑色沉淀;当色素溶液储藏15天后,添加了5mmol/L Cu2+的色素溶液也开始出现少量黑色沉淀。由此可见,Cu2+对丹参红色素有一定的不良影响。

图6 不同浓度的Cu2+对色素稳定性的影响Fig.6 Effects of Cu2+on the stability of the Salvia red pigment
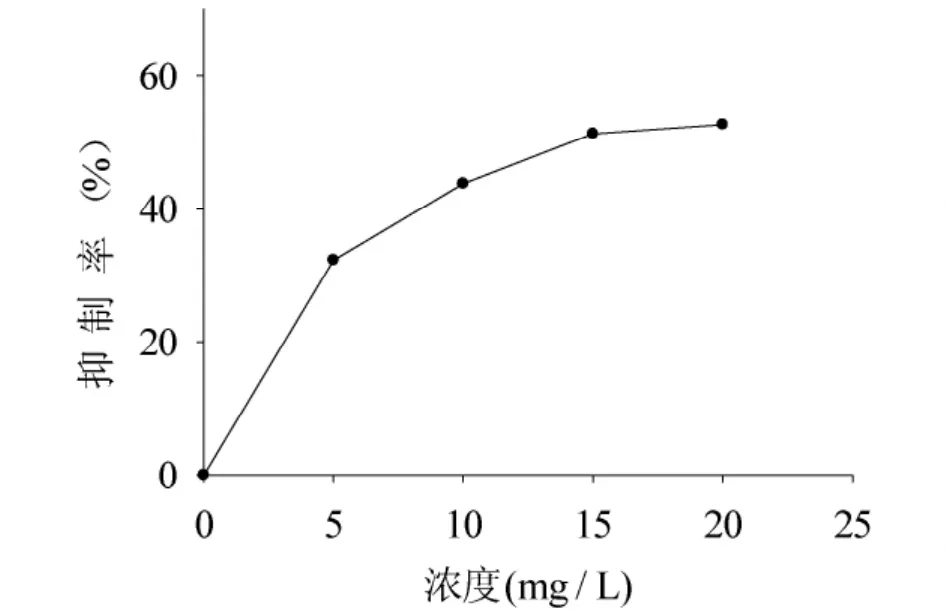
图7 MTT比色法测定在48h后不同浓度丹参红色素对细胞生长的抑制效应Fig.7 Inhibitory effect on the growth of cells in vitro measured by MTT colorimetric assay at different concentrations of the Salvia red pigment after 48h
2.8 丹参红色素对SGC7901细胞增殖的影响[11-12]
不同浓度丹参红色素对人胃癌细胞SGC7901细胞作用48h后的抑制效应如图7所示。从图7可以看出,当丹参红色素浓度为5mg/L时,对细胞抑制率约为32.3%;当丹参红色素浓度为15mg/L时,对细胞的抑制率达到了51.3%,抑制率相对增加了60%。由此可见,丹参红色素对SGC7901具有极强的生长抑制作用,且随色素浓度的提高,对细胞的抑制作用增强。当20mg/L丹参红色素处理SGC7901细胞48h后,对细胞增殖抑制率达52.17%,相对浓度为15mg/L处理的细胞增殖抑制率仅增加了约2%。这说明,当丹参红色素浓度达到一定值时,随色素浓度的提高,对细胞增殖抑制率的增加并不明显,因此我们在实际应用中以15mg/L为佳。此外,丹参红色素对SGC7901的增殖作用具有剂量依赖性,但是否具有时间依赖性还有待进一步研究。
3 结论
通过对丹参红色素金属离子稳定性和抑癌性研究结果表明:1)常见金属离子对丹参红色素稳定性影响不大。其中,K+、Ca2+和Mg2+在所研究的浓度范围内具有较好的增色或护色作用;而对于Na+来说,当Na+浓度在0.05~0.15mol/L范围内时,对色素稳定性影响不大;当浓度达到0.2mol/L时,Na+对色素有增色作用。2)在所研究的浓度范围内,Cu2+虽也使色素溶液吸光值有所增加,但在储藏一段时间后开始有黑色絮状沉淀产生,这说明Cu2+对色素也具有一定的不良影响。3)当Fe3+与色素溶液混合时,色素溶液由红色变为褐色,且随着溶液中Fe3+浓度的增大,溶液褐色加深并伴有黑色絮状沉淀产生,由此可见,Fe3+对色素具有较强的破坏作用。4)MTT结果显示:5、10、15、20mg/L对人胃癌细胞SGC7901具有生长抑制作用,且呈现良好的剂量 -效应关系;但丹参红色素对SGC7901是否具有时间依赖性还有待进一步研究。
[1] 王以群,王斌贵.油溶性丹参抗氧化色素的研制[J].中国粮油学报,1993,8(4):41 -44.
[2] 柳丽,张洪泉.丹参活性成分的现代中药药理研究进展[J].中国野生植物资源,2003,2(6):1.
[3] Wang X,Wei Y,Yuan S,et al.Potential anticancer activity of tanshinone IIA against human breast cancer[J].Int J Cancer,2005,116(5):799-807.
[4] Wang AM,Sha SH,Lesniak W,et al.Tanshinone(Salviae miltiorrhizae extract)preparations attenuate aminogly coside-induced free radical formation in vitro and ototoxicity in vivo[J].Antimicrob Agents Chemother,2003,47(6):1836 -1841.
[5] 李颖畅,孟宪军.金属离子和食品添加剂对蓝莓花色苷稳定性的影响[J].食品科学,2009,30(9):80 -81.
[6] 于纯淼,于栋华,于国萍.丹参酮的提取工艺研究[J].中国中医药科技,2006,13(3):194.
[7] 赵慧芳,李维林.食品添加剂和金属离子对黑莓色素稳定性的影响[J].食品研究与开发,2009,30(11):14 -17.
[8] 董晓荣,伍钢.丹参酮ⅡA对MKN245细胞生长的影响[J].肿瘤防治杂志,2005,12(19):1465 -1468.
[9] 杨琼,叶再元,叶平.丹参酮ⅡA对人胃癌MKN245细胞增殖及基质金属蛋白酶-2表达的影响[J].实验研究论著,2009,33(3):311.
[10] SHI Ling,YU Hong - shan,JIN Feng - xie.Study on Tanshinone Extracted from Salvia miltiorrhiza Bge.Dregs[J].Agricultural Science& Technology,2010,11(1):103 -106.
[11] 王旭,颉玉欣,单保恩.丹参酮ⅡA对人胃癌BGC-823细胞增殖及凋亡的影响[J].肿瘤防治,2007,20(1):56 -59.
[12] 陈坚,钟良.丹参酮ⅡA诱导SGC7901胃癌细胞凋亡及机制[J].复旦学报,2007,34(1):57 -59.

