铜离子对海参精氨酸激酶活力与结构的影响
刘陶陶, 王希成,2
(1. 清华大学 生命科学院, 北京 100084; 2. 清华大学生命科学院 蛋白质科学教育部重点实验室, 北京 100084)
铜离子对海参精氨酸激酶活力与结构的影响
刘陶陶1, 王希成1,2
(1. 清华大学 生命科学院, 北京 100084; 2. 清华大学生命科学院 蛋白质科学教育部重点实验室, 北京 100084)
精氨酸激酶(Arginine kinase, EC2.7.3.3)是无脊椎动物能量代谢所必需的重要的酶。海参精氨酸激酶是一种特殊的双亚基精氨酸激酶。本文研究了在二价铜离子作用下, 海参精氨酸激酶催化活性与结构的变化。结果表明, 一定浓度的铜离子, 可以抑制精氨酸激酶的活力, 并引起酶二级结构与三级结构的变化, 引起疏水面暴露, 并导致酶的聚集。铜离子对精氨酸激酶的抑制作用与镁离子等其他二价金属离子有明显不同。
精氨酸激酶(Arginine kinase, EC2.7.3.3); Cu2+; 聚沉; 去折叠
磷酸原激酶是一大类酶, 能够催化 ATP与生物体内天然存在的一些胍基底物之间可逆的转磷酰基反应, 分别生成相应的磷酸胍基化合物用以储存ATP上高能磷酸键的能量, 多位于动物能量消耗和能量波动比较大的部位[1]。精氨酸激酶(Arginine kinase, EC2.7.3.3)是磷酸原激酶家族的成员之一, 精氨酸激酶是无脊椎动物中最为广泛存在的一种磷酸原激酶, 催化ATP与精氨酸之间γ-磷酸基团的可逆性交换, 生成ADP和磷酸精氨酸。在组织的ATP供应充足时, 可将能量存储在磷酸精氨酸的高能磷酸键中, 当组织消耗大量能量时, 为及时补充能量则催化磷酸精氨酸分解, 用以补偿 ATP浓度的剧烈变化[2]。精氨酸激酶主要以分子质量约为40 ku的单体形式存在, 某些棘皮动物如海参、海胆中的精氨酸激酶为特殊的双体结构, 分子质量约 80 ku, 由两个相同的亚基构成[3]。在磷酸原激酶家族中, 对于其他物种来源的单体精氨酸激酶和存在于脊椎动物中的肌酸激酶(Creatine kinase) 研究的较为详尽, 而对于双亚基海参精氨酸激酶的研究比较少。
以往对磷酸原激酶家族的研究中, 已经证实锌离子和铜离子等重金属离子可以影响肌酸激酶的催化功能与结构, 并影响酶的折叠过程[4-5]。铜是生物体发挥正常生理功能所必须的微量元素, 但过量的铜离子对于机体具有毒性, 由于铜离子的氧化还原活性, 推测过量的铜对机体的损害可能有: 引起生物大分子的氧化, 导致蛋白质或 DNA的损伤, 催化ROS(reactive oxygen species)的形成, 结合于蛋白质上引起蛋白聚集等[6-8]。精氨酸激酶是海参能量代谢所必需的酶, 将它作为模式蛋白, 从生物化学的角度研究过量的铜离子对酶的抑制作用, 对于阐明酶的结构与功能的关系具有重要的意义。
1 材料与方法
1.1 材料
实验所用质粒pET21b与大肠杆菌BL21/DE3,购于Novagen公司; ATP、精氨酸、Tris、isopropylβ-D-thiogalactopyranoside (IPTG)、1-anilinonaphtalene-8-sulfonate(ANS), 购自 sigma公司;亲和层析镍柱 Ni2+-NTA, 购自上海申能博彩公司; 实验所用二价铜离子标准溶液用CuCl2配制, 购自Fluka;用超纯水配制 30 mmol的铜离子标准储液, 采用容量瓶定容, 在实验中稀释到相应的终浓度。其他试剂都为国产分析纯。
1.2 方法
1.2.1 酶的表达纯化
编码海参精氨酸激酶的基因已经由本实验室克隆到质粒pET21b上, 构建了pET21b-AK载体, 可在大肠杆菌BL21/DE3中可溶性表达[9]。为了便于表达纯化, 在 C末端加上 His-tag。挑取单菌落在含50µg/mL 氨苄青霉素的新鲜 LB培养基中经 37℃过夜培养, 二次培养转接至同样的LB培养基中待OD值达到0.6左右, 加入0.4 mmol 的IPTG (isopropylβ-D-thiogalactopyranoside) , 在25℃的条件下培养14 h,以诱导重组蛋白的表达。使用Ni2+-NTA镍柱进行酶的分离纯化, 根据说明书进行操作。收集菌体破碎细胞, 离心取上清液, 与镍柱结合, 用含有梯度浓度咪唑的缓冲液洗脱蛋白。纯化的蛋白经 SDS-PAGE电泳鉴定为均一的一条带。从大肠杆菌的海参精氨酸激酶, 比活与电泳迁移率都与从海参肌肉中提取的精氨酸激酶基本一致[9]。
1.2.2 酶浓度的测定
酶浓度的测定采用 Bradford考马斯亮蓝 G-250法, 以牛血清蛋白(BSA)为标准蛋白做标准曲线。
1.2.3 酶活力的测定
采用改进的 pH比色法[10]测定精氨酸激酶的活性, 反应体系中含有5.7 mmol精氨酸, 4.8 mmol ATP,6.6 mmol乙酸镁, 复合酸碱指示剂(麝香草酚蓝-甲基红), 20 mmol Tris-乙酸, pH 8.0。测定活力时, 1 mL反应液加入光径1 cm的塑料比色杯中, 加入10 µL的精氨酸激酶启动反应, 测定 575 nm 处光吸收值在30 s之内的变化。活力测定在Specord 200 UV Vis分光光度计(Jena, 德国)上进行。
失活动力学常数的计算采用半对数作图法[11],若为一级反应, 失活速率常数k可由速率方程lnA=−kt求得, 其中A代表酶活,t是失活时间。
1.2.4 光谱实验
远紫外CD光谱测定是在Jasco –J500C型圆二色性色谱仪上进行, 测定波长范围为190~260 nm, 吸收池光径为1 mm, 每个样品扫描3次取平均值。
荧光光谱都通过荧光仪Hitachi 850 spectrofluorimeter测得。内源荧光的激发波长为295 nm。扫描范围设定300~400 nm。用ANS作为外源荧光探针,测定实验中样品的疏水表面暴露情况, 将样品与ANS按照1 : 50的摩尔比在室温下避光作用30 min后, 进行400~600 nm处的荧光扫描。激发波长设定为380 nm。
1.2.5 聚沉实验
聚集实验是用Specord 200 UV Vis分光光度计(Jena, 德国)于室温下通过监测 400 nm处吸光度的变化来反映该过程中浊度的变化。
实验中除特别注明, 一般酶的终浓度为10µmol/L, 缓冲液为 20 mmol/L Tris-Ac (pH 8.0), 温度为25℃, 反应时间1 h。
2 结果
2.1 海参精氨酸激酶剩余活力的变化
将海参精氨酸激酶与不同浓度的 Cu2+,在 25 ℃作用1 h后测定精氨酸激酶的剩余活力。如图1所示,低浓度的 Cu2+即可导致精氨酸激酶活力的迅速下降。在0~1 mmol/L浓度范围之间, 随着Cu2+浓度的增加, 精氨酸激酶的活力出现迅速的降低。当 Cu2+的浓度增加到1 mmol/L时, 精氨酸激酶的剩余活力减少到只有天然状态的 32%。当 Cu2+浓度增加到4 mmol/L时, 精氨酸激酶活力继续缓慢降低到低于天然状态的2%, 仅有极少部分活力。从不同浓度的Cu2+对于精氨酸激酶活力影响结果可见, 二价铜离子对精氨酸激酶有明显的活力抑制作用。而在同样条件下同等浓度的 Mg2+、Ca2+、Mn2+等二价金属离子则不会使精氨酸激酶出现失活(数据未提供)。进一步改变不同的铜离子浓度, 监测精氨酸激酶活力随时间的变化过程, 可以发现, 精氨酸激酶在 Cu2+作用下, 随着 Cu2+浓度的升高, 精氨酸激酶失活的速度也会加快。通过不同时刻取样, 测量酶的剩余活力,将剩余活力取对数对反应时间作图, 结果见图2。由内插图可以判断该反应为一级动力学双相反应, 该过程分为快相与慢相两部分, 分别对快相部分和慢相部分进行线性拟合, 根据斜率可求出慢相部分的失活常数k2, 用快相减去慢相的变化可得到扣除慢相反应后快相的失活常数k1。其中k1随Cu2+浓度增加而增大, 而k2变化不明显, 结果如表1所示。

图1 不同浓度Cu2+对精氨酸激酶活力的影响Fig. 1 Effect of Cu2+on the residual activity of AK

图2 加入Cu2+后精氨酸激酶失活随时间变化的曲线Fig. 2 Kinetic course of AK inactivation induced by Cu2+
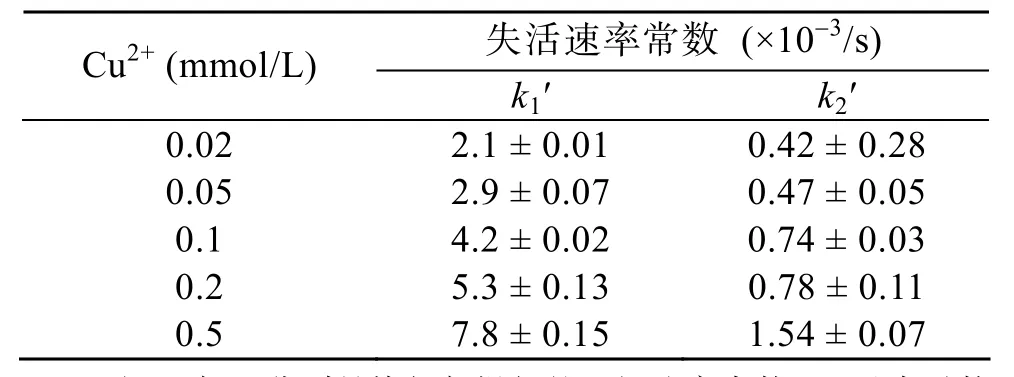
表1 Cu2+处理精氨酸激酶的失活动力学Tab. 1 Inactivation rate constants of AK in the presence of Cu2+
2.2 海参精氨酸激酶二级结构的变化
利用远紫外 CD光谱可以反映蛋白质二级结构的变化。将不同浓度的铜离子与精氨酸激酶反应1h,然后测CD光谱。如图3所示, 在0~3 mmol/L浓度范围内, 随着Cu2+浓度的增加, 222 nm和208 nm处的两个负峰, 峰值有一定程度的下降。说明Cu2+对精氨酸激酶的二级结构有一定的影响。
内源荧光光谱的结果(图4)表明, 在 Cu2+的作用下, 精氨酸激酶的荧光最大发射波长出现了轻微的红移, 从天然状态的329 nm红移至332.5 nm。表明Cu2+对精氨酸激酶的三级结构有一定程度的影响,使精氨酸激酶的结构变得略微松散。同时, 随着Cu2+浓度的增加, 内源荧光的强度也随之降低, Cu2+对精氨酸激酶的结合可能导致荧光生色基团的疏水微环境发生了变化, 而使得荧光强度有所降低。
图5是用0~3 mmol/L不同浓度的Cu2+处理精氨酸激酶。结果显示精氨酸激酶的 ANS外源荧光强度明显增高, 最大荧光发射峰位蓝移, 表明在 Cu2+的作用下精氨酸激酶的疏水面暴露程度增加了, 并且随着Cu2+的浓度增加而加大。
图6比较了用同浓度的 Cu2+和其他几种不同的二价金属离子处理精氨酸激酶之后, 疏水表面的暴露程度。从图中结果可以看出, 室温下3 mmol/L的Cu2+的作用使得精氨酸激酶的ANS荧光强度大大增强, 而同样浓度的 Mg2+、Ca2+、Mn2+则没有引起精氨酸激酶疏水面的明显暴露。

图3 精氨酸激酶的圆二色光谱Fig. 3 Far-ultraviolet CD spectra of AK
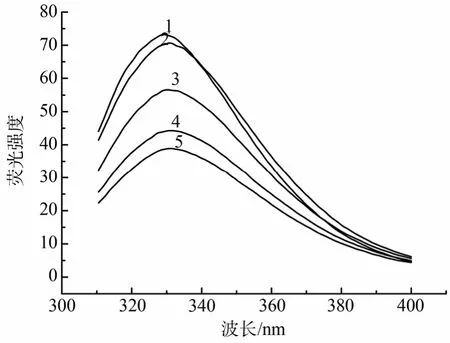
图4 精氨酸激酶的内源荧光光谱Fig. 4 Intrinsic fluorescence emission spectra of AK.曲线1-5 Cu2+浓度与图3相同
2.3 聚沉的结果
通过400 nm处浊度的变化来检测Cu2+对精氨酸激酶的聚集作用。图7是常温下用不同浓度的Cu2+处理酶之后, 精氨酸激酶的聚集变化。结果显示,Cu2+可以使精氨酸激酶出现明显的聚集, 低于1mmol/L的 Cu2+对精氨酸激酶的聚集速度比较慢,A400nm浊度缓慢增加。高于1 mmol/L的Cu2+对精氨酸激酶的聚集作用非常显著, 且聚集的程度随着Cu2+浓度的增加而加剧。Cu2+对精氨酸激酶的聚集也是有浓度依赖性的, 如图8所示, 随着Cu2+浓度的增加精氨酸激酶聚集的更为明显。而在同样条件下同等浓度的 Mg2+、Ca2+、Mn2+等二价金属离子则不会使精氨酸激酶出现聚集现象(数据未提供)。

图5 精氨酸激酶的ANS荧光光谱Fig. 5 ANS-binding fluorescence spectra of AK

图6 几种不同的二价金属离子对精氨酸激酶作用的ANS荧光光谱Fig. 6 ANS-binding fluorescence spectra of AK for different divalent ions.
3 讨论
在生物学的研究中, 关于蛋白质结构与功能的关系的研究一直是一个重要的核心问题。对于酶来说, 构象的完整性以及折叠的正确与否是其发挥生理功能的基础。以往对于酶的研究中, 利用胍、脲等变性剂对酶进行折叠与去折叠已经做了很多工作,但是关于金属离子对蛋白质结构和稳定性的影响这方面的研究还不是很多。

图7 不同浓度Cu2+对精氨酸激酶的聚集影响Fig. 7 Aggregation time course of AK induced by Cu2+at different concentrations.

图8 5 mmol/L Cu2+对不同浓度精氨酸激酶的聚集影响Fig. 8 Aggregation time course of AK induced by 5 mmol/LCu2+at different concentrations of enzyme
从实验结果可知, 常温下低浓度的 Cu2+即可引起精氨酸激酶的活力迅速降低, 并随着 Cu2+浓度的增加而持续降低, 增加 Cu2+的浓度会导致精氨酸激酶失活的速率也有所增加。动力学结果表明 Cu2+对精氨酸激酶的失活是双相过程, 分为快相和慢相两部分。CD光谱结果显示, 随着Cu2+浓度的增加, 峰值出现一定程度的下降, 证明二级结构在 Cu2+的诱导下发生了变化,α-螺旋含量减少。与Cu2+对精氨酸激酶作用后剩余活力的结果相比, 在该浓度范围内,精氨酸激酶的活力也是迅速降低的, 提示精氨酸激酶催化活力的降低是由于结构的改变。内源荧光的结果表明, 在 Cu2+的诱导下, 精氨酸激酶的三级结构也发生了细微的变化, 最大荧光发射波长出现了一定程度的红移, 并伴随着荧光强度的降低。说明在Cu2+的作用下, 精氨酸激酶的三级结构变得有些疏松, 荧光生色基团所处的疏水微环境发生了变化而导致酶的内源荧光强度下降。CD和荧光的结果暗示Cu2+对精氨酸激酶的作用可能导致了其的部分去折叠。
ANS是一种疏水探针, 可与蛋白质中的疏水区域结合导致荧光产率的大大增加。这一特性可以用来检测蛋白疏水表面的暴露情况。ANS的荧光强度变化表明, 在 Cu2+的作用下, 精氨酸激酶表面的疏水面暴露增加, 而疏水相互作用是在蛋白折叠和再折叠过程中诱导聚集的主要原因。疏水面的暴露可能是导致Cu2+诱导精氨酸激酶聚集的主要原因。
在聚集的实验中, 在一定浓度 Cu2+作用下, 结果显示 Cu2+诱导精氨酸激酶的聚集趋势是随着Cu2+浓度的增加而增加, 并且是酶浓度依赖性的。在无其他变性条件下, Cu2+即可导致精氨酸激酶出现疏水面的暴露, 导致聚集的发生。而其他几种二价金属离子在同样条件下不会引起精氨酸激酶的聚集, 作为重金属离子的 Cu2+对精氨酸激酶的抑制和诱导聚集的现象, 和 Mg2+、Ca2+、Mn2+等其他二价金属离子不同, 这可能与Cu2+特殊的化学性质有关。
本研究结果表明, 过量的 Cu2+对海参精氨酸激酶有明显的抑制作用, 可导致蛋白的失活与聚集, 并干扰酶的折叠过程, 具体的机制还需要进一步研究。
[1] Ellington W R. Phosphocreatine represents a thermodynamic and functional improvement over other muscle phosphagens [J]. J Exp Biol, 1989, 143: 177-194.
[2] Newsholme E A, Beis I, Leech A R, et al. The role of creatine kinase and arginine kinase in muscle [J]. Biochem J, 1978, 172: 533-537.
[3] Suzuki T, Kawasaki Y, Furukohri T. Evolution of phosphagen kinase. Isolation, characterization and cDNA-derived amino acid sequence of two-domain arginine kinase from the sea anemone Anthopleura japonicus [J]. Biochem J, 1997, 328 (Pt 1): 301-306.
[4] Tong X F, Zeng X G, Zhou H M. Effects of Zinc on Creatine Kinase: Activity Changes, Conformational Changes, and Aggregation [J]. Journal of Protein Chemistry, 2000, 19(7): 553-562.
[5] Feng S, Xu Z, Yan Y B. Blocking creatine kinase refolding by trace amounts of copper ions[J]. J Inorg Biochem, 2008, 102(4): 928-935.
[6] Gaetke L M, Chow C K. Copper toxicity, oxidative stress, and antioxidant nutrients [J]. Toxicology, 2003,189(1-2): 147-163.
[7] Millhauser G L, Copper binding in the prion protein [J].Acc Chem Res, 2004, 37(2): 79-85.
[8] Bush A I. The metallobiology of Alzheimer’s disease[J]. Trends Neurosci, 2003, 26(4): 207-214.
[9] Guo S Y, Guo Z, Guo Q, et al. Expression, purification,and characterization of arginine kinase from the sea cucumber Stichopus japonicus [J]. Protein Exp Purif,2003, 29, 230-234.
[10] Yu Z, Pan J C, Zhou H M. A direct continuous ph-spectrophotometric assay for arginine kinase activity [J]. Protein Pept Lett, 2002, 9, 545-552.
[11] Mu H, Lü Z R, Park D, et al.Kinetics of Zn2+-induced brain type creatine kinase unfolding and aggregation[J].Appl Biochem Biotechnol, 2010, 160, 1 309-1 320.
Received: Jun., 25, 2010
Key words:Arginine kinase; Cu2+; aggregation; unfolding
Abstract:Arginine kinase (AK) plays an important role in the cellular energy metabolism of invertebrate. AK from sea cucumberStichopus japonicusis dimeric. The effects of Cu2+on AK were studied by measuring activity changes, kinetic time course of inactivity, far-UV circular dichroism spectra, fluorescence spectra, and turbidity changes at 400nm. These results suggested that Cu2+caused AK inactivation accompanied by conformational change, exposure of hydrophobic surface, and aggregation. The effects of Cu2+on AK are distinctive compared with other metal divalent ions.
(本文编辑:康亦兼)
Effects of Cu2+on Arginine kinase: activity changes, conformational changes, and aggregation
LIU Tao-tao1, WANG Xi-cheng1,2
(1. School of Life Sciences, Tsinghua University, Beijing 100084, China; 2. Protein Science Laboratory of the Ministry of Education, School of Life Sciences, Tsinghua University, Beijing 100084, China)
Q518.4
A
1000-3096(2011)01-0017-05
2010-06-25;
2010-09-07
刘陶陶(1973-), 女, 山东济南人, 博士研究生, 主要从事生物化学与分子生物学研究, 电话: 010-62783958, E-mail: liutaotao@tsinghua.org.cn; 王希成, 通信作者, 电话: 010-62783958, E-mail:wangxic@mail.tsinghua.edu.cn

