飞秒激光诱变微生物技术及其机理的研究进展
李海伟,陈云琳,黄 笛,闻建平
(1北京交通大学理学院,北京 100044;2天津大学化工学院,天津 300072)
进展与述评
飞秒激光诱变微生物技术及其机理的研究进展
李海伟1,陈云琳1,黄 笛2,闻建平2
(1北京交通大学理学院,北京 100044;2天津大学化工学院,天津 300072)
飞秒激光诱变微生物是一项崭新的技术。本文针对传统低功率 He-Ne激光诱变微生物的优点和缺点,结合飞秒激光光束脉冲持续时间短、瞬时功率大、聚焦尺寸小的优点,简要概括了国内外对飞秒激光诱变微生物技术的研究。同时对飞秒激光辐射微生物过程中多光子吸收、形成等离子体、产生生物活性氧、DNA损伤自身修复等一系列的机理研究进行了总结。最后,对飞秒激光诱变微生物技术及其机理研究进行了展望并提出了建议:结合关键酶活性测定和动力学参数测定来选择飞秒激光诱变的技术参数。
飞秒激光;诱变;微生物;机理
Abstract:Femtosecond laser induced micro-organisms mutation has become a new microbial technology,because of its characteristics of ultrafast pulse,high peak power and focusing on a small size. In this paper,compared to the advantages and disadvantages of the traditional low-power He-Ne laser irradiation,the technology of femtosecond laser induced micro-organisms mutation is discussed. Meanwhile,compared to traditional laser mutation mechanism of micro-organisms,the mechanisms of multi-photon absorption,formation of plasma,formation of reactive oxygen species,DNA damage and self-repair are summarized. Finally,the prospect for technology of femtosecond laser induced micro-organisms mutation is given,and the combination of key-enzyme activity measurement and dynamics parameters determination is important in choosing the technological parameters of femtosecond laser induced micro-organisms mutation.
Key words:femtosecond laser;inducing;micro-organism;mechanism
目前,微生物在解决人类的粮食、能源、健康、资源和环境保护等问题中正发挥着越来越重要且不可代替的独特作用,也为人类带来了巨大的社会效益和经济效益[1]。为了获得高产、低耗、优质的菌种,人们常常通过外界物理、化学、生物因子等因素的改变诱发基因突变,其中激光诱变以其处理安全、设备简单、操作方便、辐射损伤轻、诱变当代即可变异等优点[2]越来越受到研究者的青睐,且应用此方法人们已经得到了大量的高产优质菌种[3-7]。但是,传统低功率长脉冲He-Ne激光诱变方法存在易损伤细胞活性、突变效率低、突变无方向性、育种周期长等缺陷,易造成细胞活性损伤致死[8]、后续筛菌工作量大、菌种退化[9]等。
飞秒激光由于其脉冲持续时间短(10−15s)、瞬时功率大(1012W)、聚焦尺寸小(约200 nm)的特点,迅速成为激光诱变微生物获得优质菌株的一种新技术,具有潜在的、诱人的诱变效果,且人们已经应用飞秒激光诱变微生物得到了变异优质菌种[10]。由于飞秒脉冲时间与微观生物化学反应过程时间相同,所以依靠超快过程能够彻底了解生物化学反应过程[11]。该新技术利用飞秒激光高峰值功率、聚焦尺寸小的特点,能避免光学衍射极限,辐照微生物细胞时可以实现直接照射细胞靶点进行染色体定点切割[12]和单细胞显微操作[10]等。另外,由于生物大分子和水几乎不吸收近红外光,应用近红外飞秒激光技术对微生物菌种进行诱变作用,可以在不损伤细胞活性的前提下,对微生物菌株进行飞秒激光诱变技术的研究[13]。在飞秒激光诱变微生物机理研究方面,人们提出了许多不同的解释,虽然各自针对的生物化学过程不同,机理解释也有差别,但也形成了一些各不相同的、较成熟的机理解释,比如生物分子多光子吸收[14]、形成等离子体[15]、产生生物活性氧[16]、微生物细胞自身修复[17]等理论解释,但是缺乏唯一的、可信的飞秒激光诱变机理解释。
本文结合飞秒激光的特点和飞秒激光诱变微生物技术优势,围绕飞秒激光诱变微生物实验技术应用和机理的研究展开评述,并对该领域的研究进行了展望。
1 飞秒激光诱变微生物实验技术
1.1 飞秒激光光束特点
1981年,美国贝尔实验室的Fork等报道了脉冲碰撞锁模激光器的实验结果,将激光脉冲宽度推进到飞秒量级。20世纪90年代以后,随着飞秒钛宝石(Ti∶Al2O3)激光器的研制成功,人们获得了峰值功率高、脉冲极短的飞秒激光,新一代光子晶体光纤飞秒激光研究也于2000年后蓬勃发展起来。随着飞秒激光技术的发展,近红外飞秒激光在生物学上的应用日益增多[18]。飞秒激光光束的特点主要有脉冲宽度短、瞬时功率大、聚焦尺寸小等,具体见表1所示。
1.2 飞秒激光诱变微生物技术优势
飞秒激光光束有着与其它激光光束不同的特点,从而使其在微生物诱变方面有着独特的优势。

表1 飞秒激光光束的主要特点
(1)脉冲时间与生物化学反应时间相同 飞秒(10-15s)超短的时间范围正好是基本的化学反应和分子内电子和原子核运动的时间范围,如化学反应中化学键的形成或断裂,分子重排形成新分子,能量从一个分子传递到另一个分子等过程。随着Zewail[11]最早利用飞秒激光研究化学反应的动力学过程而被授予1999年的诺贝尔化学奖,人们已经在飞秒化学生物领域有了较大进步[19],尤其飞秒技术已经被用于研究 DNA中电荷传递及质子传递过程[20]。所以超短飞秒脉冲辐射微生物细胞时能从微观角度影响到生物新陈代谢过程中各种生物化学反应,从而促进变异概率的提高。
(2)高能光子与生物组织作用强烈 飞秒激光由于其高峰值功率,在与微生物细胞相互作用时引起细胞器或细胞内分子对激光能量的非线性吸收,这种非线性吸收在焦点处产生高激发的等离子体[15]。由于在等离子体产生的过程中会产生活性自由基,它们易与细胞内的蛋白质、酶和DNA发生化学反应,影响生物代谢,从而增强了变异的效果。
(3)DNA定点切除 近红外飞秒激光系统(重复频率为80 MHz,波长为800 nm,能量2 nJ)已被用于破坏人类染色体上的高浓缩的DNA和单个伸展的DNA分子的染色体组[18]。对于微生物(尤其原核生物)来说,由于DNA分子只有一条或者几条,又由于飞秒激光聚焦小,在显微镜下可以对微生物的DNA进行飞秒激光定点切除、移植等操作[12,21]。此种方法针对性强、精确度高,使突变更有目的性,避免了目前大多激光诱变“黑箱子操作”的盲目性,能够有效的减少后续高通量筛选高产优质菌株的工作量。
(4)细胞损伤小 大多数细胞在700~1100 nm波长范围内吸收系数小,散射系数小,因而几乎是透明的,因此近红外飞秒激光对细胞的穿透深。并且当飞秒激光聚焦于微生物细胞时,聚焦处的光强非常高,足以引起非线性吸收,但聚焦处附近的热影响非常小,飞秒激光对邻近细胞几乎没有损害(温度升高小于10-5K)[22],且不影响细胞活性,而紫外和可见光不仅穿透深度小,且对活细胞的损坏严重。
1.3 飞秒激光诱变微生物实验技术
虽然飞秒激光在微生物诱变领域有很大的优势,但是,由于飞秒激光价格昂贵,实验环境及实验操作要求严格等因素,国内外关于飞秒激光诱变微生物获得高产优质菌株的实验技术还很少。目前,据文献报道,飞秒激光诱变技术主要有以下成果。
(1)飞秒激光诱导细胞融合技术 20世纪80年代中期,美国贝尔实验室的Ashkin等[23]发现,高度汇聚的高斯激光束能捕获单细胞,后来被发展为用于操作细胞和细胞器的工具——激光镊子。飞秒激光具有极高的时间(10-15s)和空间(约200 nm)分辨率,并可以高精度地控制能量与时间,巩继贤等[10,24]利用飞秒激光作为光源实现了集光镊与细胞手术为一体的飞秒激光单细胞显微操作系统,利用55 mW的飞秒激光(中心波长为810 nm,脉冲重复频率100 MHz,脉冲宽度为40 fs)作用0.25秒,使两株红发夫酵母(P.rhodozyma)原生质体(P-EUN-I-19和P-EUN-D-08)发生融合,得到的融合体菌株(P-S-Ⅱ-19)发酵产量比 P-EUN-I-19红发夫酵母菌株提高了64%[25]。图1为两株红发夫酵母原生质体飞秒激光诱导后的融合过程[10]。图1(a)所示为采用功率为50~100 mW的飞秒光束,照射细胞膜紧密接触区域67.5~250 ms后两个细胞开始融合,23 min后,明显看到细胞融合的现象[图1(b)],90 min后,观察不到两个细胞的边缘[图1(c)],细胞呈哑铃状,160 min后,两个细胞融合为一个细胞[图 1(d)]。该技术成果有望成为单细胞操作实现高效细胞融合的技术手段,将两株近亲细胞杂交得到优良品种,同时不损伤细胞活性。超短脉冲飞秒激光诱导细胞融合具有选择性好、融合率高、可视操作、无需进行融合子检出操作等优势[25]。
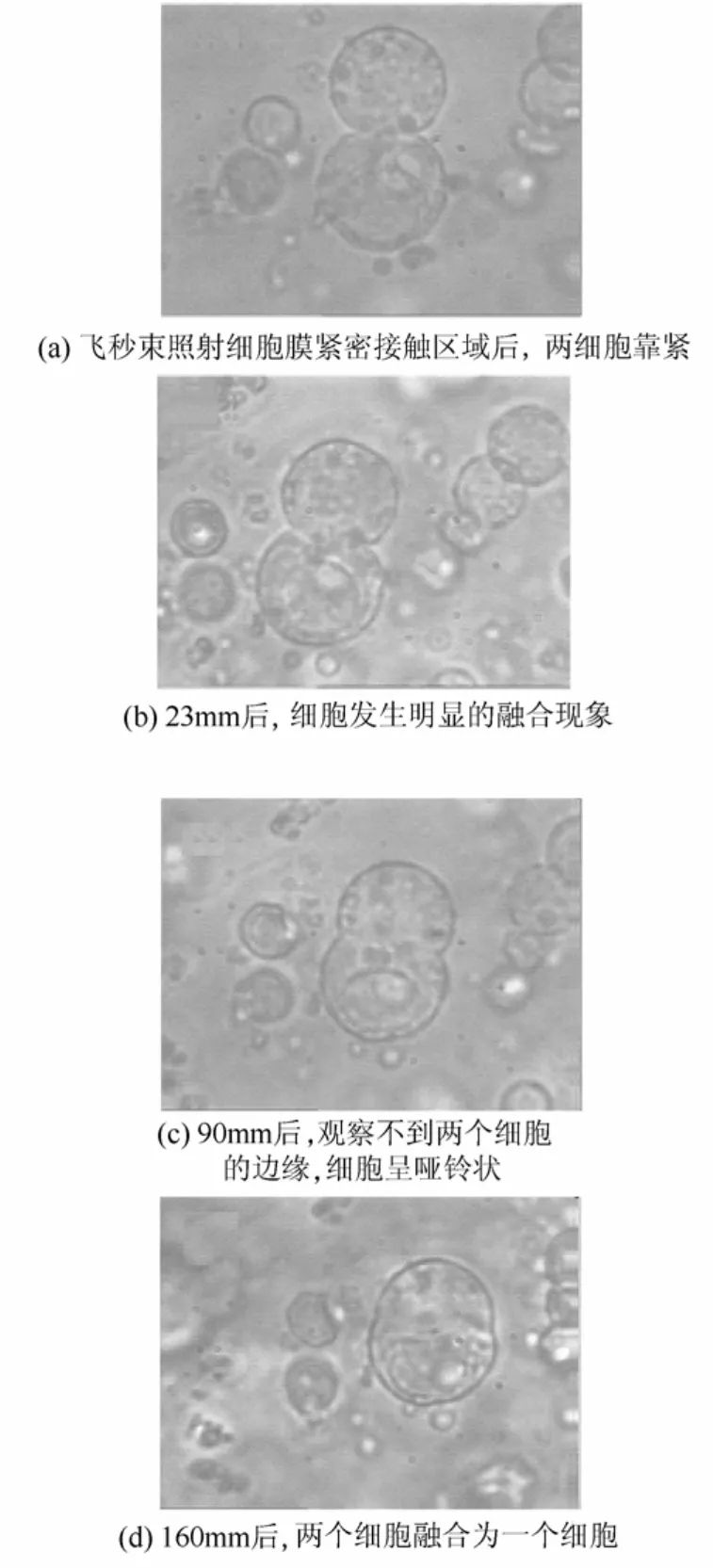
图1 细胞原生质体融合过程[10]
(2)飞秒激光转染技术 UdayK Tirlapur[26]和用钛蓝宝石飞秒激光器在细胞膜上产生单个的、特定位置的、瞬时的、可逆的穿孔,它允许 DNA通过,并能保持细胞的完整性,而后UdayK Tirlapur用飞秒激光在中国鼠的卵巢(CHO)和袋鼠的肾上皮细胞(PtK2)内进行DNA转染。Zeira等[27]利用钛蓝宝石飞秒激光脉冲将裸 DNA传递到啮齿动物的肌肉组织。但是目前没有飞秒激光诱导微生物DNA转染技术的报道。这种技术不仅转染效率高,可以同时观察到外源基因的整合和表达,具有高精确度,高效性的优点,必将成为研究热点之一。
(3)DNA基因定点切除技术 飞秒激光光束聚焦斑点半径可达 100 nm,峰值功率密度可达1018~1020W/cm2,光强大到足以产生等离子体,将聚焦处的生物组织气化,所以激光切割的孔可以在目标物100 nm以下的尺寸内产生。Halbhuber[12]和Karsten König等[28]用飞秒激光进行了人体染色体切割实验,切割尺度分别为100 nm 和85 nm。该技术成果表明,应用飞秒激光在显微镜下可以针对染色体上某处基因位点进行切割、移植等操作,得到所需的微生物变异体;同时,将某处基因切除后有利于研究DNA该段碱基的生物功能,研究DNA损伤与修复的机理。
目前,飞秒激光主要应用于医学领域,利用飞秒光镊与飞秒光刀进行生物细胞微加工、线粒体切割[29]、生物标记物成像[30]、生物细胞三维高分辨率显示[31]、生物化学反应微观过程[32]、眼睛角膜矫正手术[33]等。但是,目前国内外激光诱变均是用连续或长脉冲激光对细胞群体进行照射,应用飞秒激光辐照微生物使其发生变异的文献报道甚少。由于飞秒激光高峰值功率的特点,用飞秒激光进行微生物细胞的诱变操作,其效果要比传统的连续或长脉冲激光作用于细胞群体更加剧烈、有效,所以飞秒激光诱变微生物实验的开展必将填补国内外该领域的空白。
2 飞秒激光诱变微生物机理
一般认为,激光对遗传物质的影响主要分为直接作用和间接作用[34]。直接作用是指激光能引起染色体产生缺失、重复、倒位和异位等结构;间接作用是指激光光子使能量在染色体及 DNA分子周围聚集,引起分子加剧运动和变化,从而使 DNA分子产生突变。但是此种解释只是从直观的实验数据结果出发,提出实验解释,缺乏微观的、更深层次的理论研究。
激光诱变育种的机理后来从物理与数学角度作了研究,用量子理论、非线性理论研究了激光与DNA作用。周凌云等[35-37]在一维蛋白质分子链模型的基础上,用量子力学及非线性理论,分析了激光与生物分子系统的相互作用效应,提出分子激光遗传诱变的孤立子——混沌机理[38],激光对生物分子作用效应的分形理论[39],并对一些具体实验结果作了理论解释。但是,此模型完全是从物理角度出发,用经典量子力学的方法解释生物学现象,忽略了微生物细胞系统的复杂性,并不能完全解释生物诱变过程。
总之,对于激光诱变微生物的机理研究,由于生物细胞内部各系统的复杂性,人们研究机理时研究对象、研究方法、研究目的、研究层次的不同,导致了目前并没有形成统一的理论解释,每种机理都不能很好解释诱变机理。主要是因为没有对诱变过程中发生的微观机理过程做深入的研究,没有对微生物新陈代谢过程中生物化学反应的微观变化过程做深入的研究。由于飞秒激光脉冲宽度短、瞬时功率大、聚焦尺寸小的特点在与生物组织相互作用时所体现出来的优势,尤其是飞秒脉冲时间和生物化学反应的时间相同,影响到了新陈代谢本质运动,所以飞秒激光诱变机理的解释更具有彻底性和本质性。国内外关于飞秒激光诱变机理的研究报道还相对较少,但是人们在飞秒诱变机理方面也取得一些进展,主要有以下几个方面。
(1)多光子吸收机理 DNA吸收多个飞秒激光光子后,或者直接被离子化,或者发生能量堆积,产生电子迁移(Electron Transfer,ET)效应后,最终导致DNA单链或者双链的损伤与断裂[14,40-42]。最近有很多文献总结报道了多光子诱导碱基突变机理[43-45],此项研究对 DNA的损伤及修复机理研究具有重要意义[46]。
(2)等离子体的形成机理 高峰值功率密度的飞秒激光光束与微生物细胞内生物大分子作用时,处于基态的原子吸收光子后能量跃迁到高能级,形成主要由电子、离子、激发态的原子、分子和自由基等组成的低温等离子体,等离子体效应可使生物大分子的化学键发生改变[15],导致突变的发生。等离子体的产生过程如图2所示。等离子体的产生最初是通过光致电离形成的,光致电离包括隧道电离(图2中①过程所示)和多光子电离(图2中②过程所示),一旦介质中产生一个自由电子,该电子以逆向轫致辐射的方式吸收光子,通过一系列逆向轫致辐射吸收后,电子动能大到在碰撞电离中足以产生另外一个自由电子(图2中③过程所示)。这时就产生了两个低动能的自由电子,它们再以逆向轫致辐射方式获得动能,再与大的粒子(离子或原子核)碰撞,产生4个低动能的自由电子,以此方式循环下去,导致雪崩电离(图2中④过程所示),形成等离子体。等离子体化学过程比较丰富,各种强场效应比较显著,通过能量沉积、动量传递、质量沉积以及电荷的中和与交换等4种生物效应导致细胞变异。

图2 在等离子体形成过程中光致电离、逆轫致辐射吸收和撞击电离的相互作用[15]
(3)生物活性氧产生机理 飞秒激光能激发细胞产生活性氧,即自由基,如过氧化氢、羟自由基和单线态氧等,而自由基的存在会导致DNA单链断裂和碱基损伤[46]。曹恩华等[16]认为当用激光辐照时,细胞或组织内的内源性色素充当光敏剂角色,吸收光子后,使生物体膜脂质上的不饱和脂肪酸发生过氧化链式反应,产生活性氧自由基。当脂质过氧化发生在核膜上时,自由基将优先与DNA作用,引起DNA的损伤。
(4)DNA损伤自身修复机理 DNA损伤主要包括DNA双链断裂、碱基损伤、单链断裂等类型,每种损伤类型都与细胞死亡、基因突变甚至细胞恶性转化有密切联系[17]。在细胞内,DNA修复酶始终监视染色体,一旦发现物理、化学、生物等因素产生的核苷酸残基,就会启动细胞自身修复机制[47]。DNA损伤修复是一种生物细胞内的自发的代谢反应过程,而其中 γ-H2AX(一种组蛋白)与DNA发生双链断裂修复是一个重要过程[48]。DNA发生双链断裂后最早反应之一是位于断裂点附近的组蛋白H2AX的C末端丝氨酸残基发生磷酸化。磷酸化的γ-H2AX快速转导DNA损伤信号,导致下游分子磷酸化的激活,引发一系列的生物级联反应和细胞学反应。随着DNA损伤逐渐修复,γ-H2AX发生去磷酸化(半衰期约为2 h),直至DNA修复完成,γ-H2AX也即消失,而在DNA修复的过程中便会发生大量的突变。
高能飞秒激光光子辐射到微生物细胞上,通过多光子强烈吸收导致了生物分子离子化,或者发生能量堆积,造成DNA等生物大分子损伤。在这个过程中就会形成由电子、离子、激发态的原子、分子和自由基等组成的低温等离子体,扰乱生物细胞自身的代谢过程,其中生物活性氧直接与 DNA作用,引起DNA损伤。由于细胞的修复系统启动,细胞通过一系列生物化学反应将 DNA修复,保证遗传信息的完整性,从而将细胞自身的代谢调整到正常状态,在这个过程中就会产生大量的突变。相比较于传统激光的诱变机理,飞秒激光的诱变机理更具有本质性和微观性,结合了物理过程和生物化学反应过程,更具有全面性和系统性。
3 展 望
对于飞秒辐射微生物变异的技术,目前人们还没有进行系统的研究,可以结合关键酶活性测定和动力学参数测定,开展飞秒激光诱变微生物菌株的激光波长、能量密度、功率密度、辐射时间和辐射样品区的光斑尺寸等激光参数对飞秒激光诱变微生物菌株效果的影响,针对菌种代谢网络,选择适当的筛选高产菌种的方法,获得高产菌株。
对于飞秒诱变机理的研究,Popp等[49]和Gu等[50-51]已经在生物光子辐射方面做了很多的工作。他们基于分子生物学中关于激基复合物(exciplex)形成的实验结果和量子光学中的Dicke模型,建立了生物光子辐射理论,从理论上研究了光子与生物分子相作用的整个生物物理过程。故可从生物细胞DNA组、转录组、翻译组、酶促反应组等系统生物学角度出发,研究飞秒激光诱发生物细胞内DNA的大分子的基态、激发态的形成,结合目前多光子吸收、形成等离子体、产生生物活性氧、DNA损伤自身修复等一系列的机理,重点研究光子与DNA分子相互作用的微观生物化学过程,包括DNA损伤、DNA修复过程,最终得到飞秒激光诱变微生物可信的、统一的微观量子生物物理机理模型。此机理模型的研究必将为生物突变研究工作的进一步发展提供重要的理论和实验基础。
[1] 中国遗传学会.第八届全国激光生物学学术会议暨《激光生物学报》创刊十周年庆祝会会议纪要[J].激光生物学报,2002,11(6):465-470.
[2] 陈云琳,刘小娟,闻建平.激光诱变微生物技术的研究进展[J].生物物理学报,2003,19(4):353-358.
[3] 卢文玉,闻建平,范晶华,等. 激光诱变玫瑰孢链霉菌结合链霉素抗性筛选法选育达托霉素高产菌株[J].微生物学通报,2006,33(3):114-117.
[4] Jiang Yan,Wen Jianping,Jia Xiaoqiang,et al. Mutation of Candidatropicalis by irradiation with a He-Ne laser to increase its ability to degrade phenol[J].Applied And Environmental Microbiology,2007,73(1):226-231.
[5] 王卫卫,任鹏康,阎明,等.He-Ne激光对γ-亚麻酸产生菌少根根霉的诱变作用[J].光子学报,2002,31(2):157-161.
[6] 张智维,王旭,刘金平.He-Ne激光诱变选育双乙酰生成量低的啤酒酵母[J].激光技术,2005,29(5):541-542.
[7] 李佳,刘鑫,刘克武,等.CO2激光辐射总状毛霉发酵产蛋白酶优化条件[J].激光技术,2004,28(2):128-130.
[8] Boudaïffa B, Cloutier P, Hunting D,et al.Resonant formation of DNA strand breaks by low energy(3to20eV)electrons[J]. Science,2000,287:1658-1660.
[9] 顾秋亚. β-胡萝卜素高产菌株的选育及代谢调控的初步研究[D].无锡:江南大学,2008.
[10] Gong Jixian,Zhao Xueming,Xing Qirong,et al.Femtosecond laser-induced cell fusion[J],Applied Physics Letters,2008,92:093901.
[11] Zewail A H.Femtochemistry past,present,and future[J].Pure Applied Chemistry,2000,72(12):2219-2231.
[12] Halbhuber K J,König K.Modern laser scanning microscopy in biology,biotechnology and medicine[J]. Annals of Anatomy,2003,185:1-20.
[13] 狄建科,周明,杨海峰,等.飞秒激光与生物细胞作用机理及应用[J].激光生物学报,2008,17(2):270-277.
[14] Meldrum R A,Botchway S W,Wharton C W,et al.Nanoscale spatial induction of ultraviolet photoproducts in cellular DNA by three-photon near-infrared absorption [J].EMBO Reports,2003,4(12):1144-1149.
[15] Vogel A,Noack J,Huttmann G,et a1.Mechanisms of femtosecond laser nanosurgery of cells and tissues[J].Applied Physics B,2005,81:1015-1047.
[16] Sun Xueguang,Cao Enhua,Zhang Xiaoyan,et al.The divalent cation-induced DNA condensation studied by atomic force microscopy and spectra analysis[J]. Inorganic Chemistry Communications,2002(5):181-186.
[17] 宾萍,郑玉新.γ-H2AX与DNA双链断裂关系的研究进展[J].卫生研究,2007,36(4):520-522.
[18] 王丽,邱建荣.飞秒激光在生物学领域的应用[J].激光与光电子学进展,2010,47:011701.
[19] 赵珂,王佩琳.飞秒激光在超快过程中的应用研究[J].量子电子学报,2001,18(2):97-102.
[20] 马国宏,郭立俊,钱士雄.飞秒物理、飞秒化学和飞秒生物学[J].物理,2001,30(6):349-355.
[21] Shen N,Datta D,Schaffer C B,et al.Ablation of cytoskeletal filaments and mitochondria in live cells using a femtosecond laser nanoscissor[J].Mech. Chem. Biosyst.,2005,2(1):17-25.
[22] Langford V S, McKinley A J, Quickenden T I,et al. Temperature dependence of the visible-near-infrared absorption spectrum of liquid water[J].J. Phys. Chem. A,2001,105(39):8916-8921.
[23] Ashkin A,Dziedzic J M.Optical trapping and manipulation of viruses and bacteria[J].Science,1987,235:1517-1520.
[24] 李寰宇,巩继贤,邢岐荣,等.飞秒激光诱导细胞融合技术的实验研究[J].中国激光,2006,33(12):1642.
[25] 巩继贤.飞秒激光显微操作进行单细胞水平巅峰虾青素生物合成研究[D].天津:天津大学化工学院,2007.
[26] Tirlapur U K,König K.Targeted transfection by femtosecond laser[J].Nature,2002,418:290-291.
[27] Zeira E,Manevitch A,Khatchatouriants A, et al. Femtosecond infrared laser-an efficient and safe in vivo gene delivery system for prolonged expression[J].Molecular. Therapy.,2003,8(2):342-350.
[28] König K,Riemann I,Fritzsche W. Nanodissection of human chromosomes with near-infrared femtosecond laser pulses[J].Optics Letters,2001,26(11):819-821.
[29] Wataru Watanabe,Sachihiro Matsunaga,Tomoko Shimada,et al. Femtosecond laser disruption of mito-chondria in living cells[J].Medical Laser Application,2005,20(3):185-191.
[30] Layland K S,Riemann I,Stock U A,et al. Imaging of cardiovascular structures using near-infrared femtosecond multiphoton laser scanning microscopy[J].J. Biomed. Opt.,2005,10(2):024017.
[31] Guehring T,Urban J P,Cui Z F,et al. Noninvasive 3D vital imaging and characterization of notochordal cells of the intervertebral disc by femtosecond near-infrared two-photon laser scanning microscopy and spatial-volume rendering[J].Microscopy Research Technique,2008,71(4):298-304.
[32] Fiebig T,Wan C Z,Zewail A H. Femtosecond charge transfer dynamics of a modified DNA base:2-aminopurine in complexes with nucleotides[J].Chemphyschem,2002,3(9):781-788.
[33] Binder P S,Sarayba M,Ignacio T,et al.Characterization of submicrojoule femtosecond laser corneal tissue dissection [J]. Journal of Cataract and Refractive Surgery,2008,34(1):146-152.
[34] 陈恒雷,徐辉,吕长武,等.激光诱变育种的研究概况[J].激光生物学报,2006,15(4):436-440.
[35] 吴光敏,周凌云.α螺旋蛋白质螺旋链模型的双孤立子效应[J].数学物理学报,1997,17(1):18-24.
[36] Zhou Lingyun, Zhang Canbang,Yiying Zhou,et al.Derivation of the modification heatingconduction equation of the a king of laser thermal effect by quantum mechanics[J].Chinese Optics Letters,2003,l(7):411-413.
[37] Zhou Lingyun,Zhang Canbang,Zhou Yiying,et al.Solutions of the modification heating conduction equations of a kind of laser thermal effect[J].Chinese Optics Letters,2003,l(10):597-600.
[38] Feng Guolin,Shao Yaochun,Sun Yaodong.Study on the stochastic Chaos in laser-DNA interactive system[J].J. Infrared Millim. Waves,2000,19(3):169-173.
[39] 周凌云,段良和,雷玉明,等.激光对生物分子的热作用效应的分形理论分析[J].光电子:激光,1997,8(6):462-465.
[40] Trautlein D,Deibler M,Leitenstorfer A,et al.Specific local induction of DNA strand breaks by infrared multi-photon absorption[J].Nucleic Acids Research,2010,38(3):14-16.
[41] Shafirovich V, Dourandin A, Luneva N P,et al. Multiphoton near-infrared femtosecond laser pulse-induced DNA damage with and without the photosensitizer proflavine[J].Photochemistry and Photobiology,1999,69(3):265-274.
[42] Gomez-Godinez V,Wakida N M,Dvornikov A S,et al.Recruitment of DNA damage recognition and repair pathway proteins following near-IR femtosecond laser irradiation of cells[J].JBO Letters,2007,12(2):020505.
[43] König K,Riemanna I,Strackea F,et al.Nanoprocessing with nanojoule near-infrared femtosecond laser pulses nanobearbeitung mit nanojoule nahinfrarot femtosekunden laserpulsen[J].Medical Laser Application,2005,20(3):169-184.
[44] Grigaravicius P,Greulich K O,Monajembashi S.Laser microbeams and optical tweezers in ageing research[J]. Chem. Phys. Chem.,2009,10(1):79-85.
[45] Dinant C,Jager J M,Essers J,et al. Activation of multiple DNA repair pathways by sub-nuclear damage induction methods[J].Journal of Cell Science,2007,120:2731-2740.
[46] Botchway S W, Reynolds P,Parker A W,et al.Use of near infrared femtosecond lasers as sub-micron radiation microbeam for cell DNA damage and repair studies[J].Mutation Research/Reviews in Mutation Research,2010,704:38-44.
[47] 朱守民,夏昭林.DNA损伤修复基本方式的研究进展[J].国外医学分子生物学分册,2003,25(5):270-272.
[48] 王会平.组蛋白H2AX与DNA损伤的分子感应[J].癌变,畸变,突变,2006,18(4):334-336.
[49] Popp F A,Li K H,Gu Q.Recent Advances in Biophoton Research and its Applications[M].USA,Singapore:World Scientific,1992:113-152.
[50] Gu Q,Popp F A.Nonlinear response of biophoton emission to external perturbations[J].Cellular and Molecular Life Sciences,1992,48(11-12):1069-1082.
[51] Popp F A,Gu Q,Li K H.Biophoton emission:Experimental background and theoretical approaches [J].Modern Physics Letters B,1994,8(21-22):1269-1296.
Research progress of technology and mechanism of femtosecond laser induced micro-organisms mutation
LI Haiwei1,CHEN Yunlin1,HUANG Di2,WEN Jianping2
(1College of Science,Beijing Jiaotong University,Beijing 100044,China;
2School of Chemical Engineering & Technology,Tianjin University,Tianjin 300072,China)
Q 631
A
1000–6613(2011)04–0824–07
;2010-09-25;修改稿日期;2010-10-25。
国家自然科学基金资助项目(21076022)。
李海伟(1985—),男,硕士研究生。E-mail 09122190@ bjtu.edu.cn。联系人:陈云琳,女,教授,博士生导师。E-mail ylchen@bjtu.edu.cn。

