透性化酒精酵母细胞产海藻糖发酵培养基的优化
张 建 双, 于 爽, 郭 晓 兵, 郭 继 强
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
海藻糖[1]由两分子的吡喃葡萄糖单体以α-1,1糖苷键连接而成,许多报道[2]表明当酵母细胞处于长时间的饥饿、高渗、热激以及孢子萌发等时,细胞内海藻糖的含量会发生显著变化。因此海藻糖不仅可以作为碳源和能源,还具有保护生物细胞和生物活性物质在脱水、干旱、高温、冷冻、高渗透压及有毒试剂等不良环境条件下活性免遭破坏的功能[3]。我国主要通过酵母法进行工业化生产[4]。酵母中的海藻糖合成酶[5]属胞内酶,通常需先将细胞破碎,经分离纯化[6]后才可使用,酶活损失较大,制约了酶法生产的工业化应用。采用渗透处理细胞技术可省去海藻糖合成酶的分离及纯化,整个透性化细胞可视为一个固定化酶。
透性化处理可使细胞内合成的目标产物释放到细胞外,从而减少产物积累造成的产物反馈抑制现象[7]。作者以透性化酒精酵母细胞为研究对象,采用响应面法对其发酵培养基进行优化,从而使海藻糖最大限度的积累。
1 实 验
1.1 菌 种
酒精酵母,大连工业大学生物工程学院微生物菌种保藏中心。
1.2 培养基及试剂
1.2.1 培养基
发酵培养基(g/L):葡萄糖20,硫酸镁 0.5,磷酸氢二钾10,氯化钠20,酵母膏10。
1.2.2 试 剂
葡萄糖、酵母膏、硫酸镁、磷酸氢二钾、蔗糖、吐温-60、无水乙醇、蒽酮、浓硫酸等。
1.3 方 法
1.3.1 培养条件
发酵培养:250 mL的三角瓶装液80 mL,透性化细胞1 g,30 ℃、160 r/min培养48 h。
1.3.2 酵母细胞渗透处理
取1 g湿酵母细胞悬浮于15 mL体积分数为0.5% 的吐温60溶液中,于30 ℃下振荡反应45 min,离心,收集菌体。菌体再用50 mmol/L、pH 7.0的磷酸缓冲液重复洗涤2次,离心,最终收集的菌体即为透性化酵母细胞。
1.3.3 生物合成海藻糖
将透性化细胞加入发酵培养基中培养。
1.3.4 海藻糖质量浓度的测定
用0.5 mol/L的三氯乙酸冰浴提取胞内海藻糖1 h[8],提取2次,提取液用蒽酮比色法测定海藻糖质量浓度,并测出对应的菌体生物量。每组实验平行3次,结果取平均值。
1.3.5 菌体生物量的测定
取发酵液10 mL于4 000 r/min离心15 min,沉淀,用去离子水洗涤2次,在干燥箱中80 ℃下烘干至恒重,称量菌体干重。
1.4 发酵培养基的优化
1.4.1 透性化酒精酵母培养基最适碳源的确定
改变“1.2.1”中发酵培养基中碳源的种类,分别以葡萄糖、蔗糖、乳糖、果糖作为碳源,添加量为20 g/L,其他成分不变。30 ℃摇床振荡培养48 h,离心收集菌体,测定海藻糖质量浓度及菌体干重。
1.4.2 透性化酒精酵母培养基最适氮源的确定
以30 g/L的蔗糖为碳源,选用有机氮源(牛肉膏、酵母膏、蛋白胨)、无机氮源(硫酸铵、尿素)单一或复合物作为氮源,添加量为10 g/L,其他成分不变,30 ℃摇床振荡培养48 h,离心收集菌体,测定海藻糖质量浓度及菌体干重。
1.4.3 透性化酒精酵母培养基最适盐浓度的确定
以30 g/L蔗糖为碳源,15 g/L酵母膏为碳源,分别添加10、20、30、40、50 g/L的氯化钠和氯化钾[9],其他成分不变,30 ℃摇床振荡培养48 h,离心收集菌体,测定海藻糖质量浓度及菌体干重。
1.4.4 响应面法对海藻糖产生培养基的优化
在单因素实验的基础上,通过Box-Behnken设计进一步确定单因素的最佳添加量。以蔗糖、酵母膏、氯化钠为自变量,以海藻糖质量浓度为考察指标,运用Minitab15数据处理软件进行响应面分析,对培养基组成进行优化。
2 结果与讨论
2.1 最佳碳源及其质量分数的确定
由图1可以看出,不同碳源对酵母细胞的生长及海藻糖的积累影响较大。当以蔗糖为碳源时,海藻糖质量浓度和菌体干重均较高,且分别达到0.739和5.73 g/L。
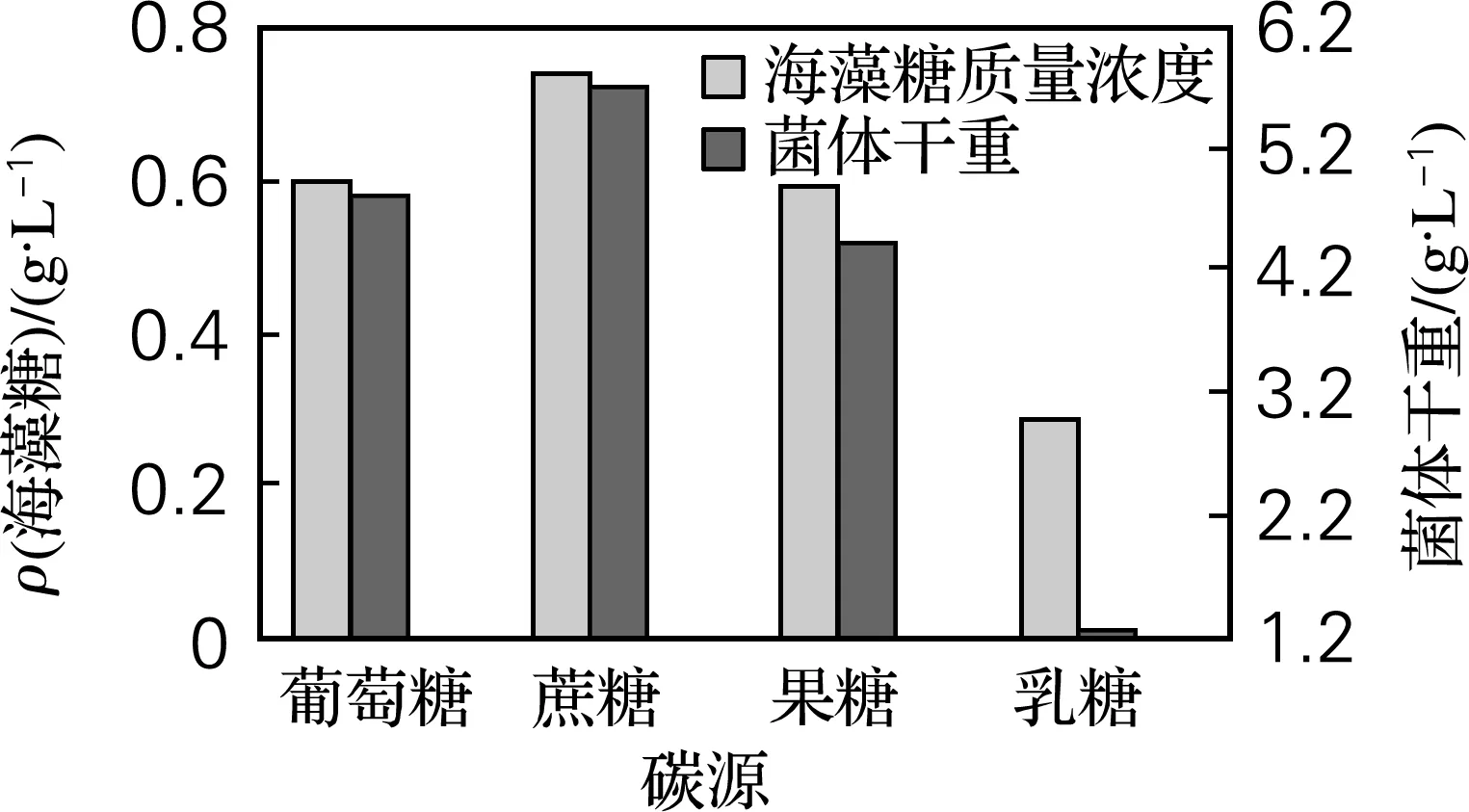
图1 不同碳源对海藻糖产量的影响
进一步考察最适的蔗糖质量分数,结果见图2。由图2可知,蔗糖的浓度对海藻糖的积累具有较为显著的影响,当蔗糖质量浓度为30 g/L时海藻糖质量浓度达到最大值0.831 g/L,菌体干重为6.73 g/L。浓度继续增加,海藻糖质量浓度开始降低,故蔗糖的量取30 g/L。
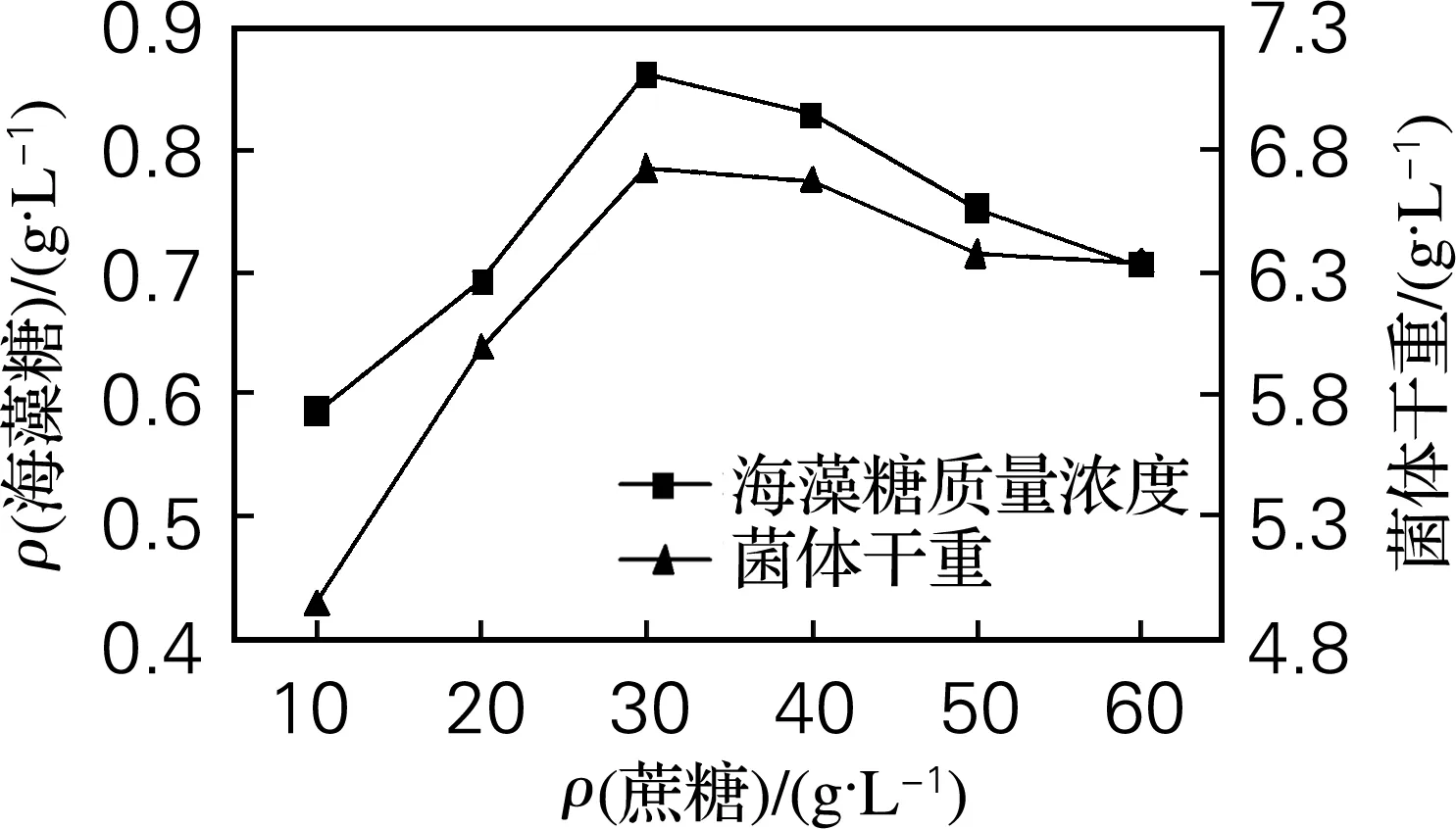
图2 蔗糖对海藻糖产量的影响
2.2 最佳氮源及其质量分数的确定
由图3可知,培养基中的不同碳源对酵母细胞海藻糖的积累及菌体的生长情况影响较大。总体看来,有机氮源的效果较好,其中酵母膏为氮源时效果最好,此时海藻糖质量浓度为0.833 g/L,菌体干重为6.56 g/L。
进一步考察最适酵母膏用量,结果见图4。由图4可知,不同浓度的酵母膏对海藻糖产量的影响较大。酵母膏浓度过低,菌体生长较差,产海藻糖能力低;当酵母膏添加量大于15 g/L时,菌体干重及海藻糖量增加不明显。因此选择15 g/L的酵母膏为最适添加量,海藻糖质量浓度为0.864 g/L,菌体干重为6.49 g/L。
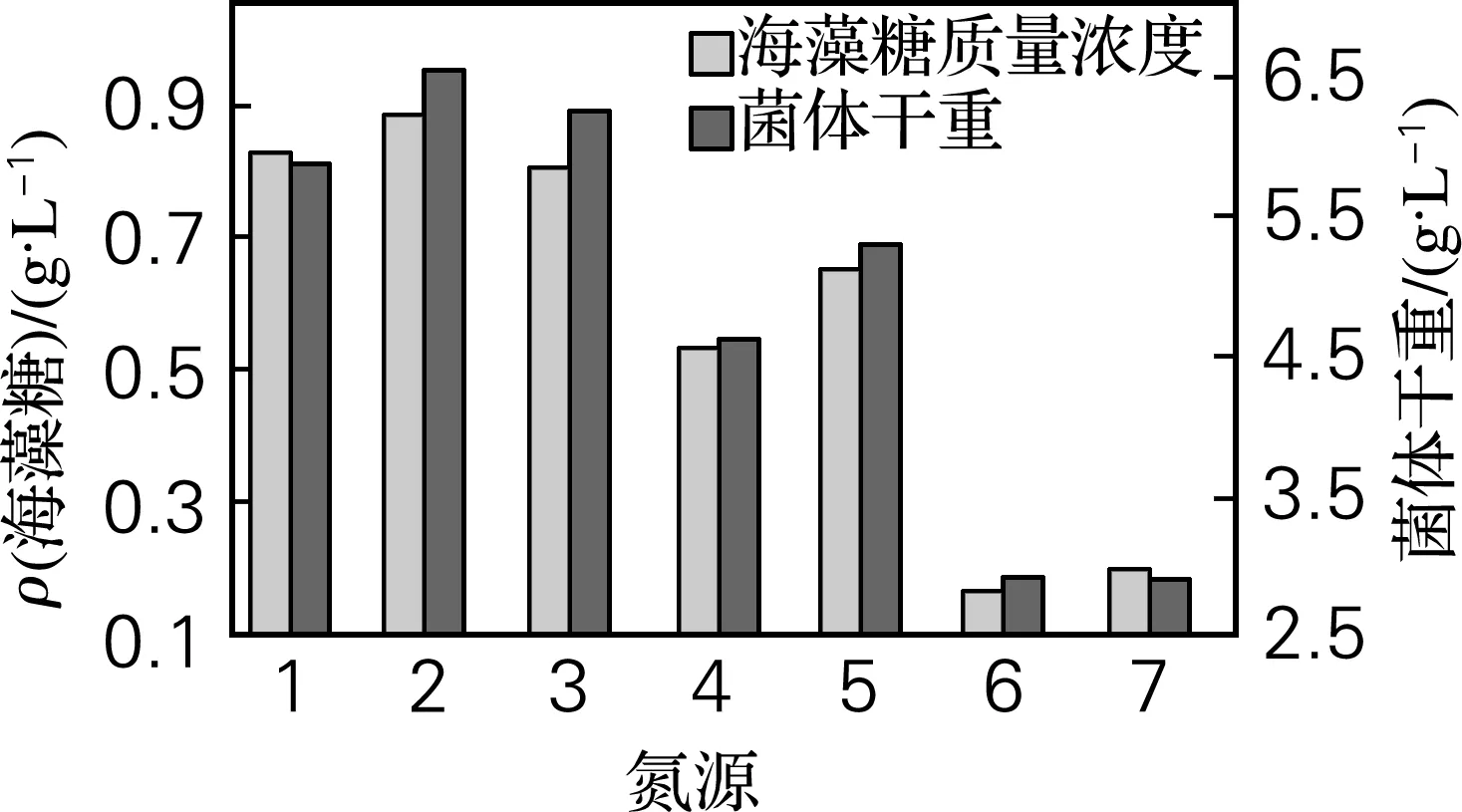
1,牛肉膏10 g/L; 2,酵母膏10 g/L; 3,蛋白胨10 g/L; 4,牛肉膏5 g/L+硫酸铵5 g/L; 5,酵母膏5 g/L+硫酸铵5 g/L; 6,硫酸铵10 g/L; 7,尿素10 g/L
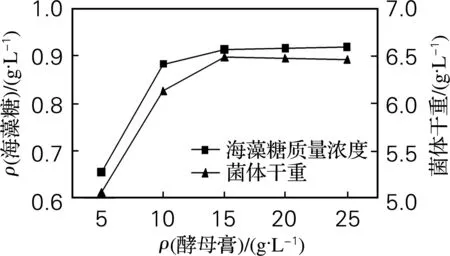
图4 酵母膏对海藻糖产量的影响
2.3 最佳盐及其质量分数的确定
由图5、6可知,适当浓度的氯化钠和氯化钾均有利于海藻糖的积累,但两者比较之后,可以看出添加氯化钠得到的海藻糖质量浓度及菌体干重均较大,因此选择添加30 g/L的氯化钠,此时海藻糖质量浓度为0.910 g/L,菌体干重为6.44 g/L。
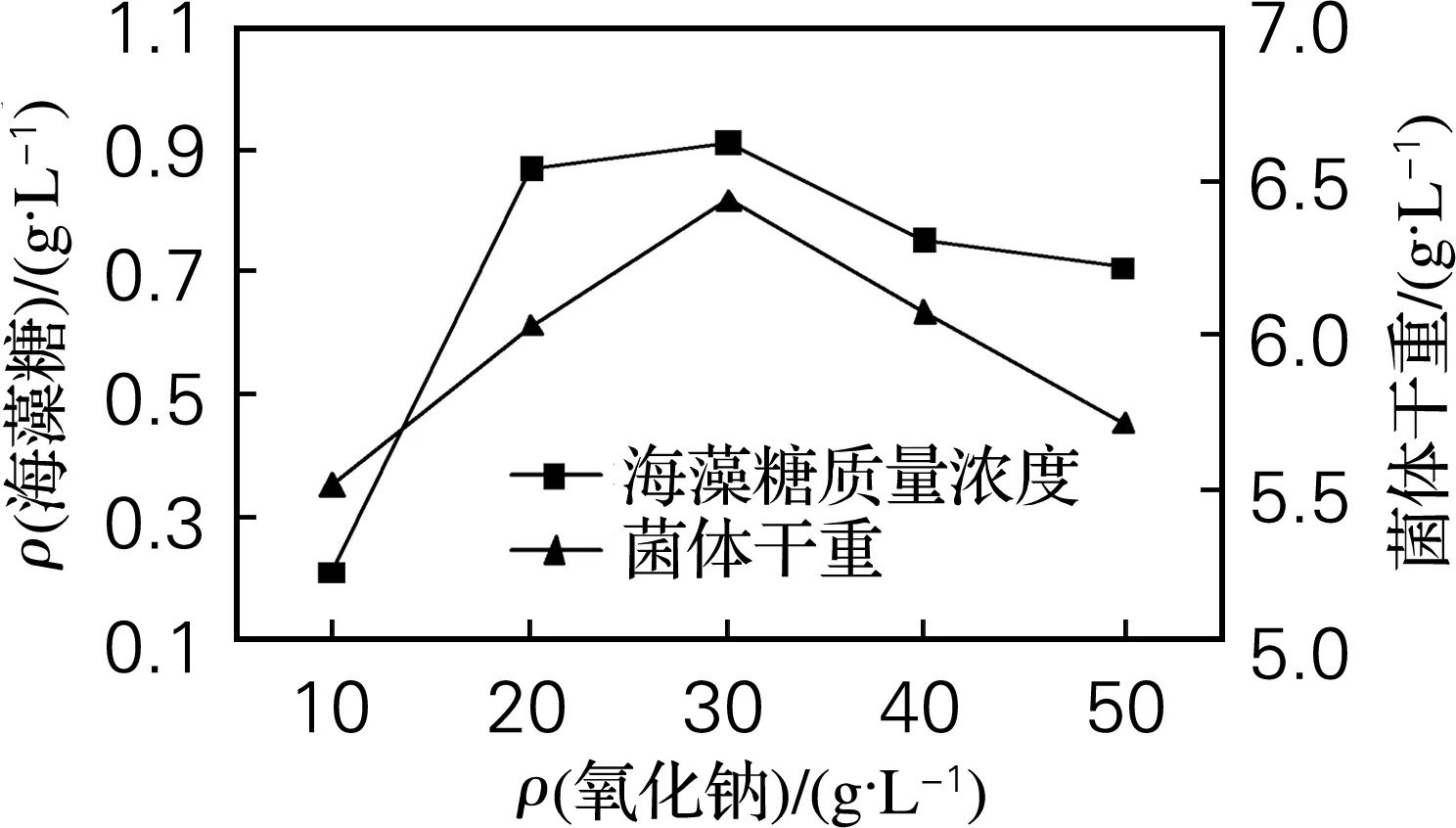
图5 氯化钠对海藻糖产量的影响
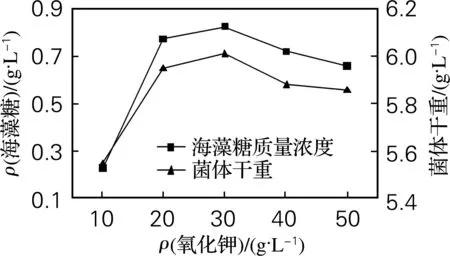
图6 氯化钾对海藻糖产量的影响
2.4 响应面法对海藻糖产生培养基的优化
在单因素实验结果的基础上,进行Box-Behnken响应曲面设计,以海藻糖质量浓度为考察指标,因素水平编码见表1。对实验数据进行多项式拟合回归,以海藻糖质量浓度(Y)为因变量,以酵母膏(X1)、蔗糖(X2)、氯化钠(X3)质量浓度为自变量建立回归方程:
Y=0.915 67-0.020 13X1-0.073 66X2-
0.006 5X1X3-0.002 075X2X3

表1 响应面设计因素与水平
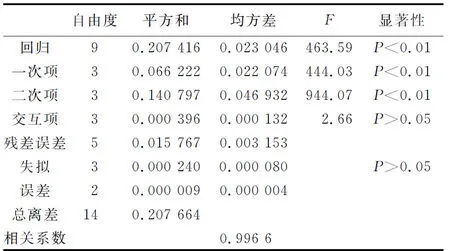
从表2可知,海藻糖质量浓度与实验3个因素的回归方程的F值为463.59,方程显著。回归方程的一次项、二次项的均方差和系数比较大,且P<0.01,说明显著;而交互项比较小,所以,响应面分析所选的3个因素(酵母膏、蔗糖和氯化钠质量浓度)之间的交互效应比较小,且P>0.05。因此各项因素与海藻糖质量浓度之间是相对较为简单的线性关系,失拟项P>0.05表明该方程可以接受,可以用此模型对发酵液的海藻糖质量浓度进行预测。
利用Minitab15数据处理软件对回归模型进行响应面分析,得到响应面以及对应等高线图,见图7。由图7可以直观地看出各个自变量对响应值的变化趋势,而且回归模型存在最大值,同时可以看出3个因素对海藻糖积累的影响显著性为:酵母膏>蔗糖>氯化钠。
根据拟合方程对方程求导,得到最佳因素编码:X1=-0.062 3,X2=-0.245 4,X3=-0.256 6,即最适培养基组成为:酵母膏14.7 g/L,蔗糖32.5 g/L,氯化钠27.4 g/L。由回归方程可以确定海藻糖最大质量浓度为 0.931 9 g/L。
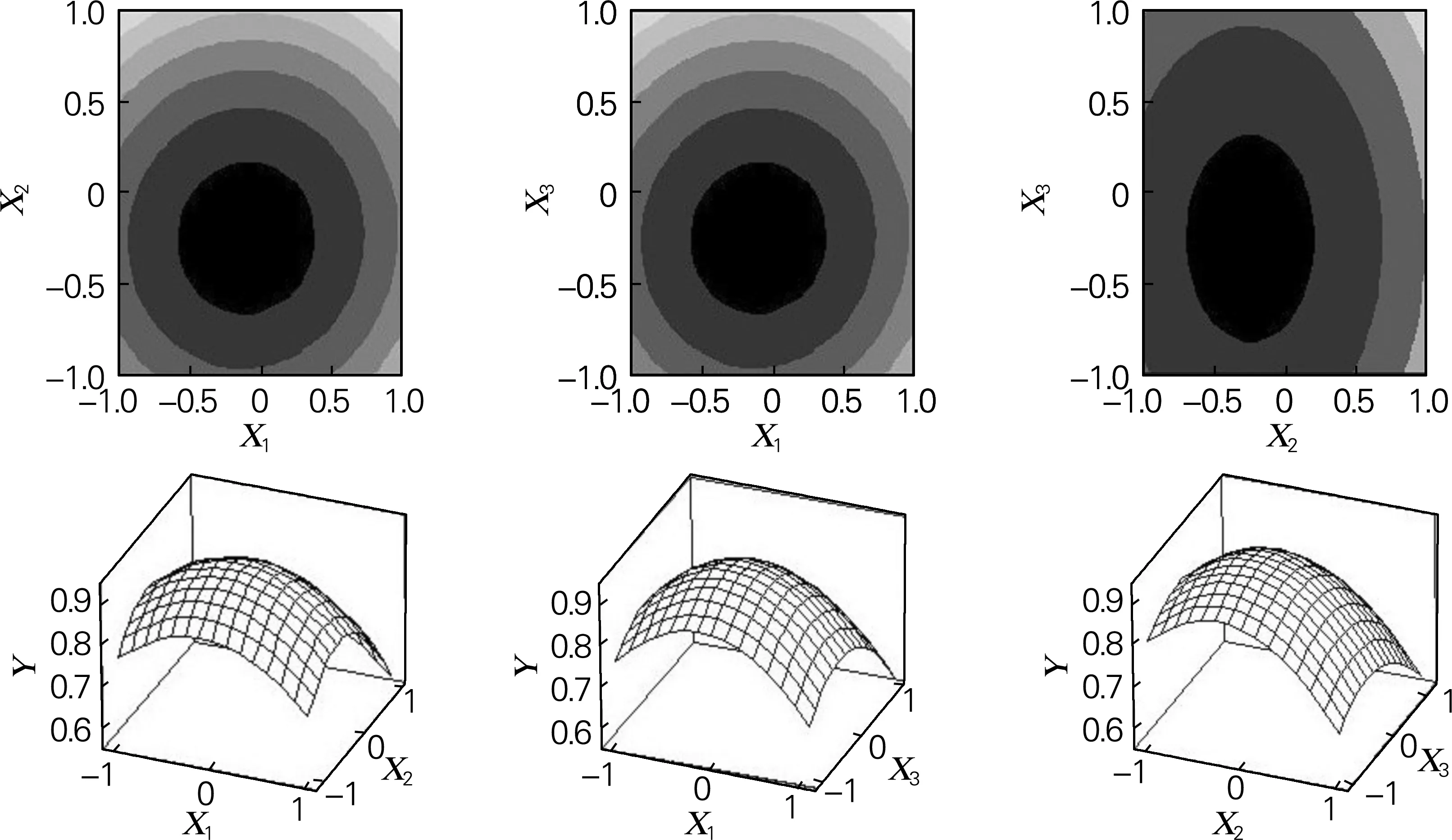
图7 响应面三维图和对应的等高线图
2.5 验证性实验
为了检验模型的准确性,根据以上优化实验所得的各因素优化值,进行透性化酒精酵母培养实验,经优化后其海藻糖的产量可以达到0.921 0 g/L,与预测值0.931 9 g/L接近,可见该模型能较好地预测实际发酵情况。
3 结 论
通过响应面法对透性化酒精酵母细胞发酵培养基组成的研究,得出最佳培养基组成为:酵母膏14.7 g/L,蔗糖32.5 g/L,氯化钠27.4 g/L,此时海藻糖质量浓度达到0.931 9 g/L。
[1] 涂国云. 海藻糖的性质、生产及应用[J]. 山西食品工业, 2003(3):33-36.
[2] 池振明,梁丽琨,朱开玲,等. 酵母海藻糖的代谢与调控研究进展[J]. 中国海洋大学学报, 2006, 36(2):209-214.
[3] 马莺,刘巧红. 海藻糖的生物合成及相关酶系[J]. 中国甜菜糖业, 2008(1):24-28.
[4] 姚汝华,王克勤,王周亮,等. FDP生物合成中啤酒酵母细胞透性处理方法的研究[J]. 广州食品工业科技, 1994(3):23-25.
[5] SHARON L H, GEORGE M W. Enzyme-catalyzed organic synthesis of sucrose and trehalose with in situ regeneration of UDP-glucose[J]. Applied Biochemistry and Biotechnology, 1990, 23(6):155-158.
[6] STREETER J G, GOMEZ M L. Three enzymes for trehalose synthesis inBradyrhizobiumcultured bacteria and in bacteroids from soybean nodules[J]. Applied and Environmental Microbiology, 2006, 72(6):4250-4255.
[7] 陈小林,周立平,王兰. 吐温80、甲苯、乙醚对红曲菌GM011液态发酵的影响[J]. 现代食品科技, 2007(23):14-16.
[8] 刘传斌,云战友. 海藻糖的分析方法[J]. 食品与发酵工业, 1998, 24(5):40-42.
[9] 高梅莹,莫新迎,王宁. 响应面法优化酒精酵母产海藻糖发酵培养基[J]. 中国酿造, 2009(10):117-120.

