分离于酸性矿坑水的疑似钩端螺旋菌的鉴定及重金属对其铁氧化能力影响的评估
高 健, 丁建南, 康 健, 吴学玲, 邱冠周
(1. 湖南科技大学 生命科学学院,湘潭 411201;2. 中南大学 资源加工与生物工程学院,长沙 410083)
分离于酸性矿坑水的疑似钩端螺旋菌的鉴定及重金属对其铁氧化能力影响的评估
高 健1, 丁建南2, 康 健1, 吴学玲2, 邱冠周2
(1. 湖南科技大学 生命科学学院,湘潭 411201;2. 中南大学 资源加工与生物工程学院,长沙 410083)
采用稀释分离法,从山西中条山铜矿的酸性矿坑水中分离出一株铁氧化细菌,命名为ZTS菌株。该菌株为革兰氏阴性细菌,螺旋状或弧状,最适生长温度为30 ℃,最适生长pH值为2.5,对低浓度的酵母浸出物较敏感。形态学和生理学分析表明,ZTS菌株可能属于钩端螺旋菌属的成员;16S rDNA序列的系统发育分析表明,该菌株与氧化亚铁钩端螺旋菌典型菌株ATCC 49879位于系统发育树的同一分支,相似度为100%,从而证实ZTS菌株属于氧化亚铁钩端螺旋菌。考虑到当前的商业利益,考察了Cu2+、Co2+和Ni2+对ZTS菌株氧化亚铁能力的影响。结果表明:3种金属对ZTS菌株的毒性强弱依次为Co2+>Cu2+>Ni2+。就Ni2+抗性能力而言,ZTS菌株能够耐受Ni2+的浓度高达160 mmol/L,这比已报道的氧化亚铁钩端螺旋菌的Ni2+抗性能力要强得多,这种能力可能与它的遗传特性有关。
酸性矿坑水;氧化亚铁钩端螺旋菌;铁氧化能力;重金属抗性
嗜酸细菌,如硫杆菌属的嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌[1]以及钩端螺旋菌属的氧化亚铁钩端螺旋菌等,在低品位硫化矿的生物浸出过程中扮演了极为重要的角色[2−3]。在这个浸出过程中,亚铁离子的生物氧化被证明是非常关键的一个环节[4]。然而,在浸矿细菌的亚铁离子氧化能力与它们能够耐受浸矿体系中可溶性金属离子浓度的水平之间存在某种必然的联系。随着硫化矿的生物浸出过程的进行,诸如铜、锌和镍等金属离子不断积累到浸矿溶液中,当它们超过一定的浓度时,必然会对浸矿细菌产生毒性,从而影响浸出速率[5]。因此,深入了解浸矿细菌对各种从硫化矿中释放的金属离子的抗性能力十分必要。
以前的研究主要集中在嗜酸氧化亚铁硫杆菌[5−10]、嗜酸氧化硫硫杆菌[11−13]、布氏酸菌[14]、嗜酸热硫化叶菌[15]和喜温硫杆菌[16]等浸矿细菌或古生菌的亚铁氧化能力或金属抗性方面。但对钩端螺旋属的成员的亚铁氧化能力或金属抗性方面的研究只有较少的一些报道[2,17−18],其原因主要在于钩端螺旋菌分离纯化的困难。已有的研究证实,在温度高于40 ℃、pH小于1.4时,钩端螺旋菌在工业连续流生物反应槽中属于主要的铁氧化细菌。因此,在过去的几年里,我们团队主要围绕钩端螺旋菌,尤其是嗜铁钩端螺旋菌的分离纯化做了大量的工作,并建立了一种高效的选择性分离方法[19]。目前,我们在以前的工作基础上,通过改进原有的方法,开展对钩端螺旋菌属的另一个种,即氧化亚铁钩端螺旋菌的分离工作。最近采用改良的方法从山西省中条山铜矿酸性矿坑水中分离出一株疑似钩端螺旋菌的菌株,将其命名为ZTS菌株。为确切了解该菌株的分类地位以及对重金属离子耐受能力,本文作者在本研究中有两个目的:一是从形态、生理和分子水平对疑似为钩端螺旋菌的ZTS菌株进行鉴定;二是基于商业利益,考察铜、钴和镍3种金属离子对ZTS菌株亚铁氧化能力的影响,以期为进一步的基础应用提供试验依据。
1 实验
1.1 菌种来源
菌株分离于山西中条山铜矿的矿坑水,取样时矿坑水温度为16 ℃,pH为2.0。液体样品的元素分析采用电感耦合等离子体发射光谱仪(ICP-AES),液体样品主要的元素浓度见表1。
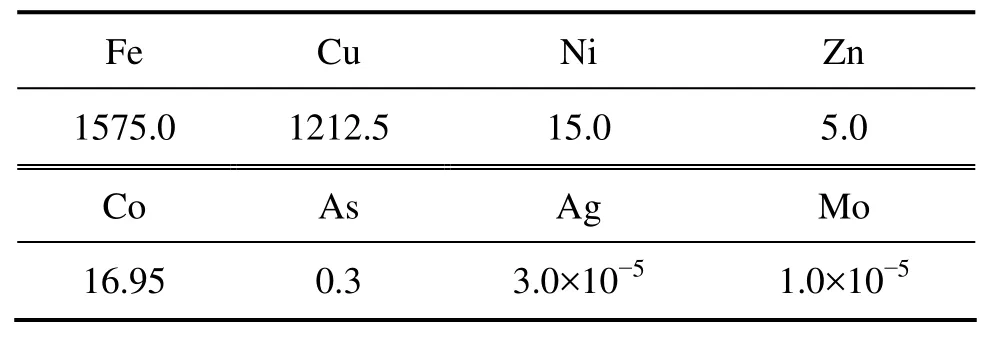
表1 AMD样品中主要的元素Table 1 Main elements in AMD sample(mg/L)
1.2 菌种的富集分离
1.2.1 培养基
1) 9 K培养基(g/L): (NH4)2SO4, 3.00;KCl, 0.10;K2HPO4, 0.50;MgSO4·7H2O,0.50;Ca (NO3)2, 0.01;FeSO4·7H2O, 44.2。用5 mol/L的硫酸调节pH到2.5即可。
2) 改良的9 K培养基(g/L): (NH4)2SO4, 3.00; KCl, 0.10; K2HPO4, 0.30;MgSO4·7H2O,0.40;FeSO4·7H2O, 56.0;Fe2(SO4)3·XH2O(终浓度为10 mmol/L),Al2(SO4)3·18H2O(终浓度为1 mmol/L),用5 mol/L的硫酸调节pH到1.6即可。
1.2.2分离纯化
将样品接种到已经湿热灭菌的盛有液体9 K培养基的三角瓶中(培养基的pH为2.5、Fe2+浓度为20~30 g/L),将其置于30 ℃空气浴摇床中振荡,摇床转速为180 r/min,当培养基颜色变成红色时,即获得第一代富集培养物。镜检、观察到螺旋状细菌后,将适量第一代富集培养物按照上述方法接种,除了培养基中的Fe2+浓度改变为40~60 g/L外,其他培养条件不变,当培养基颜色变成红色时,即获得第二代富集培养物。镜检、观察到螺旋状细菌后,将适量第二代富集培养物仍然按照上述方法接种,除了pH为1.6、温度为37℃和加入终浓度为10 mmol/L的Fe3+外,其他培养条件与获得第二代富集物的条件相同,当培养基颜色变成红色时,即获得第三代富集培养物。镜检、观察到螺旋状细菌后,将适量第三代富集培养物仍然按照上述方法接种,除了加入1 mmol/L的Al3+外,其他培养条件与获得第三代富集物的条件相同,当培养基颜色变成红色时,即获得第四代富集培养物。将第四步重复3次,然后,将最终的富集培养物采用稀释分离法进行纯化。稀释纯化时,富集物分别按10−1、10−2、10−3、10−4、10−5、10−6、10−7、10−8和10−9稀释度接种到未改良的液体9 K培养基中培养,即未加Fe3+和Al3+,其他基本培养条件不变,最高稀释度条件下获得的培养物被命名为ZTS菌株。
1.3 菌株的形态学观察
离心收集培养至对数期的菌体,用pH为1.5的稀硫酸洗涤几次以去除Fe3+,再用灭菌蒸馏水洗涤几次。一方面取适量菌体进行革兰氏染色后在光学显微镜下观察,另一方面取适量菌体用4%的戊二醛固定处理后在透射电子显微镜下观察其形态。
1.4 菌株最适生长温度和最适生长pH的测定
将离心收集的菌体洗涤后,重新悬浮在不含Fe2+的9K基本培养基中(浓度约为1×109个细胞/mL)作为种子待用。在摇床转速为180 r/mim、接种量为5%( v/v)的条件下,采用重铬酸钾滴定法[20]测定菌株在不同温度、不同pH条件下的氧化Fe2+能力。按照文献[4]描述的方法,定时测定Fe2+的浓度和用无菌蒸馏水补充因蒸发损失的水分。试验设两个平行样,所得结果为两者的平均值。
1.5 酵母提取物对ZTS菌株氧化亚铁影响的评估
基于上述测定的最适生长温度和pH,在摇床转速为180 r/mim、接种量为5%(v/v)的条件下,采用重铬酸钾滴定法测定不同浓度的酵母提取物对ZTS菌株的Fe2+氧化能力。定时测定Fe2+的浓度和用无菌蒸馏水补充因蒸发损失的水分。试验设两个平行样,所得结果为两者的平均值。
1.6 菌株基因组DNA的提取和16S rDNA PCR扩增、克隆与测序
离心收集适量菌体, 用pH为1.5的硫酸溶液洗涤3次后,采用上海生工公司生产的UNIQ-10 柱式基因组DNA 抽提试剂盒提取基因组DNA。
16S rRNA 基因的PCR扩增采用通用引物对[21]:27f(5′- CAGAGTTTGATCGTGGCTCAG -3′) 和1506f (5′-CGGGTACCTTGTTACGACTT-3′)。PCR反应体系(50 µL):10×PCR缓冲液,5.0 µL;Mg2+(25 mmol/L), 3.0 µl;dNTP(各5 mmol/L),2.0 µL;引物(20 µmol/L)各1.0 µL;Taq DNA聚合酶(1 U/µL,MBI),l.0 µL;模板2.0 µL约20 ng;去离子水35 µL。扩增程序为:94℃预变性3 min,然后,94 ℃, 30 s;52 ℃,30 s;72 ℃,1.0 min;30个循环后72 ℃ 10 min。PCR产物用Omega公司生产的E.Z.N.ATM凝胶回收试剂盒纯化;纯化的PCR产物用Invitrogen公司生产的TA克隆试剂盒克隆,其载体为pCR@2.1。具体操作均参照有关说明书进行。克隆产物的测序工作由北京三博生物技术有限公司完成。
1.7 系统发育分析
根据供试菌株的16S rDNA序列(基因库登陆号:EF025338),运用BLAST程序在GenBank数据库中分别进行同源序列搜索。根据同源序列搜索结果,下载相关菌种的16S rDNA序列,与供试菌株的序列放在一起,用MEGA4.0 软件[22]的升级版4.1进行匹配排列,然后采用邻接法(Neighbor-Joining)[23]进行系统树的构建。
1.8 重金属对ZTS菌株氧化亚铁影响的评估
在容量为250 mL的三角瓶中接入1.0 mL 种子于分别装有各种不同浓度的金属离子的99 mL 9 K培养基中, 根据上面的结果,调节培养液的pH和温度为最适,在摇床转速为180 r/min 条件下连续培养10 d, 然后采用重铬酸钾滴定法定时测定培养液中Fe2+的浓度,因蒸发失去的水分用无菌蒸馏水补充。试验设两个平行样,所得结果为两者的平均值。试验采用的金属盐均为硫酸盐,购自中国医药(集团)上海化学试剂公司。
2 结果与讨论
2.1 菌株的形态学特征
革兰氏染色结果表明,ZTS菌株为革兰氏阴性。其透射电子显微镜显示(见图1),该菌株为弧状或螺旋状。菌株的来源以及形态学分析结果表明,该菌株可能属于钩端螺旋菌属的成员。

图1 ZTS菌株的TEM像Fig.1 TEM image of strain ZTS
2.2 菌株的最适生长温度
在9 K液体培养基中培养ZTS菌株,Fe2+(浓度为40 g/L)作为唯一的能源,初始温度为15~45 ℃,pH为2.0,接种时间为72 h。细菌生长通过测定Fe2+的氧化量来确定。图2所示为温度对ZTS菌株氧化Fe2+的影响。从图2可知, ZTS菌株能够在15~40 ℃范围内生长,但15 ℃下生长非常缓慢,45 ℃下菌株的生长完全被抑制,其最适生长温度为30 ℃左右。据文献[24−26]报道,在钩端螺旋菌属的4个种,即氧化亚铁钩端螺旋菌、嗜热氧化亚铁钩端螺旋菌、嗜铁钩端螺旋菌和固氮氧化亚铁钩端螺旋菌当中,仅嗜热氧化亚铁钩端螺旋菌和嗜铁钩端螺旋菌的某些成员能够在45 ℃生长,因此,ZTS菌株只可能属于氧化亚铁钩端螺旋菌、固氮氧化亚铁钩端螺旋菌和嗜铁钩端螺旋菌3个种当中的某一成员。

图2 温度对生长3 d后ZTS菌株氧化Fe2+的影响Fig.2 Effect of temperature on Fe2+oxidation of strain ZTS grown for 3 d
2.3 菌株的最适生长pH
在9K液体培养基中培养ZTS菌株,Fe2+(浓度为40 g/L)作为唯一的能源,初始pH值为1.0~4.0,培养温度为上述最适生长温度,接种时间为72 h,其他培养条件同上。细菌生长通过测定Fe2+的氧化量来确定。图3所示为pH对ZTS菌株氧化Fe2+的影响。从图3可知,菌株适宜生长pH为1.5~3.5,ZTS菌株最适生长的pH为2.5;pH为1.0时,细菌生长受到强烈的抑制。这一结果与文献[24−26]报道的氧化亚铁钩端螺旋菌的适宜生长pH范围相一致。

图3 pH对ZTS菌株氧化Fe2+的影响Fig.3 Effect of initial pH values on Fe2+oxidation of by strain ZTS
2.4 酵母提取物对ZTS菌株氧化亚铁的影响
通常认为,自养细菌,特别是专性化能铁氧化自养细菌对有机物都非常敏感。据此,本研究考察了不同浓度的酵母提取物对ZTS菌株氧化Fe2+活性的影响。图4所示为酵母提取物对ZTS菌株氧化Fe2+的影响。从图4可看出,当培养基中酵母提取物的浓度低于0.03%(w/v)时,ZTS菌株的氧化Fe2+活性所受影响较小;当酵母提取物浓度为0.09%时, ZTS菌株的氧化Fe2+活性被明显抑制;而当酵母提取物浓度为0.18%时,ZTS菌株的氧化Fe2+活性被完全抑制。ZTS菌株对低浓度酵母提取物的敏感性与VARDANYAN和AKOPYAN在2003年报道的两株类钩端螺旋菌的特性相一致[27]。
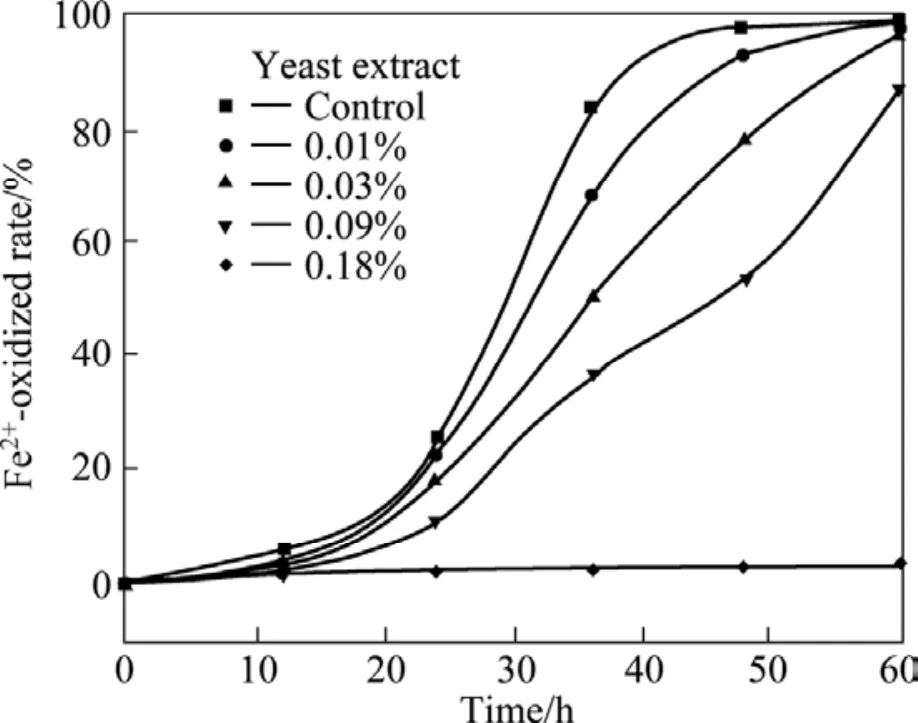
图4 酵母提取物对ZTS菌株氧化Fe2+的影响Fig.4 Effect of yeast extract on Fe2+oxidation of strain ZTS
2.5 菌株的系统发育分析
基于ZTS菌株的16S rDNA序列与GenBank、EMBL、DDBJ和PDB等核酸序列数据库中钩端螺旋菌属其他已知成员的相应序列所构建的系统发育树见图5。在本研究中,由于钩端螺旋菌属在分类地位上属于硝化螺旋菌纲(NITROSPIRA),因此,将Nitrospira moscoviensis当作外类群(进行分支分类研究时,一般需要确定外类群。外类群是指为了探知内类群(指被研究的对象)的演化关系而借助比较的外部类群,它与内类群在演化关系上是最为接近的类群,具有最相近的祖先,且在进化程度上低于内类群)。根据文献[25−26]报道,基于16S rRNA基因的系统发育分析,钩端螺旋菌属可分成I、II和III组(这种分类与以G+C含量为标准划分的3类是一致的),其中氧化亚铁钩端螺旋菌49879菌株是第I组的典型代表,嗜铁钩端螺旋菌Fairview菌株是第II组的典型代表,固氮氧化亚铁钩端螺旋菌UBA1菌株是第III组的唯一代表。从图5可知,下载的所有成员可分成明显的3大组。ZTS菌株与第I组的氧化亚铁钩端螺旋菌聚类在一起形成独立的一个分支。从其序列相似性来看(见表2),ZTS菌株与第I组典型菌株49879的序列相似性高达100%;它和第II组所有成员之间的16S rDNA序列一致性为92%~93%,与该组典型菌株Fairview的序列相似性也只有93%;它和第III组唯一的成员之间的16S rDNA序列一致性仅为83%。由此表明,ZTS菌株应该属于氧化亚铁钩端螺旋菌。
2.6 重金属对ZTS菌株氧化亚铁的影响
通常,在硫化矿的生物浸出过程中,当其他条件相同时(如矿物种类、温度和初始酸碱度等),菌种的氧化Fe2+能力越强,抗金属离子的浓度越高,其浸出作用就越强。因此,了解ZTS菌株的重金属抗性能力具有重要的实践意义。同时,Fe2+氧化成高价铁离子所释放出的能量是氧化亚铁钩端螺旋菌获得生长繁殖需要的唯一的能量来源,因此,本研究以考察不同浓度的重金属离子对ZTS菌株氧化Fe2+能力的影响来表征菌株金属抗性能力的强弱。
不同浓度的Cu2+、Co2+和Ni2+对ZTS菌株氧化Fe2+能力的影响见图6。由图6可知,与对照后相比,浓度为10 mmol/L的Cu2+或Ni2+对ZTS菌株氧化Fe2+能力几乎没有影响,培养基中的Fe2+(40 g/L)在2 d内被完全氧化,而10 mmol/L的Co2+对ZTS菌株氧化Fe2+能力的影响非常明显,培养基中的Fe2+需要6 d才被完全氧化;在20 mmol/L时,3种重金属离子当中,Co2+对ZTS菌株表现出最强的毒性,培养基中的Fe2+需要10 d才被完全氧化;当Co2+和Cu2+浓度分别大于40和80 mmol/L时,ZTS菌株氧化Fe2+能力完全被抑制,而此时,ZTS菌株对处于相同浓度的Ni2+却表现出较强的抗性,高浓度的Ni2+只是延长了培养基中Fe2+被完全氧化的时间。上述结果表明,3种重金属Cu2+、Co2+和Ni2+对ZTS菌株的毒性强弱顺序依次为:Co2+>Cu2+>Ni2+。
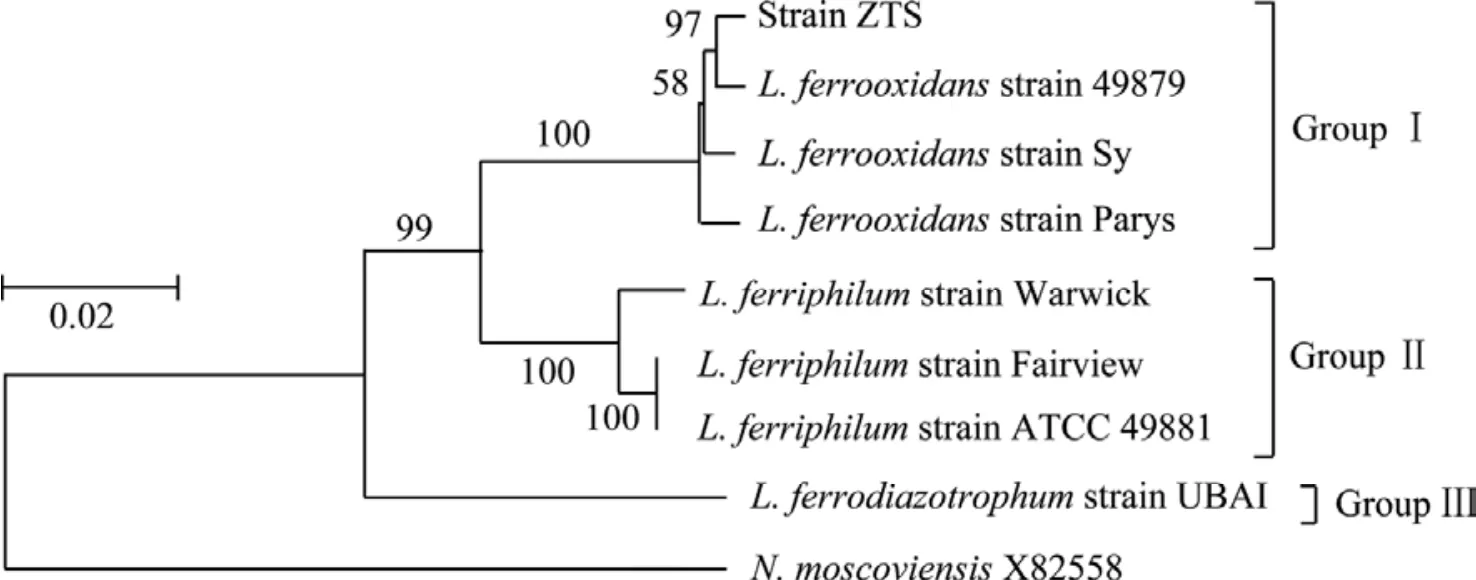
图5 基于16S rDNA序列构建的ZTS以及相关菌株的系统发育树Fig.5 Phylogenetic tree derived from 16S rDNA sequences of strain ZTS and relative strains (N. moscoviensis has been acted as the outgroup)
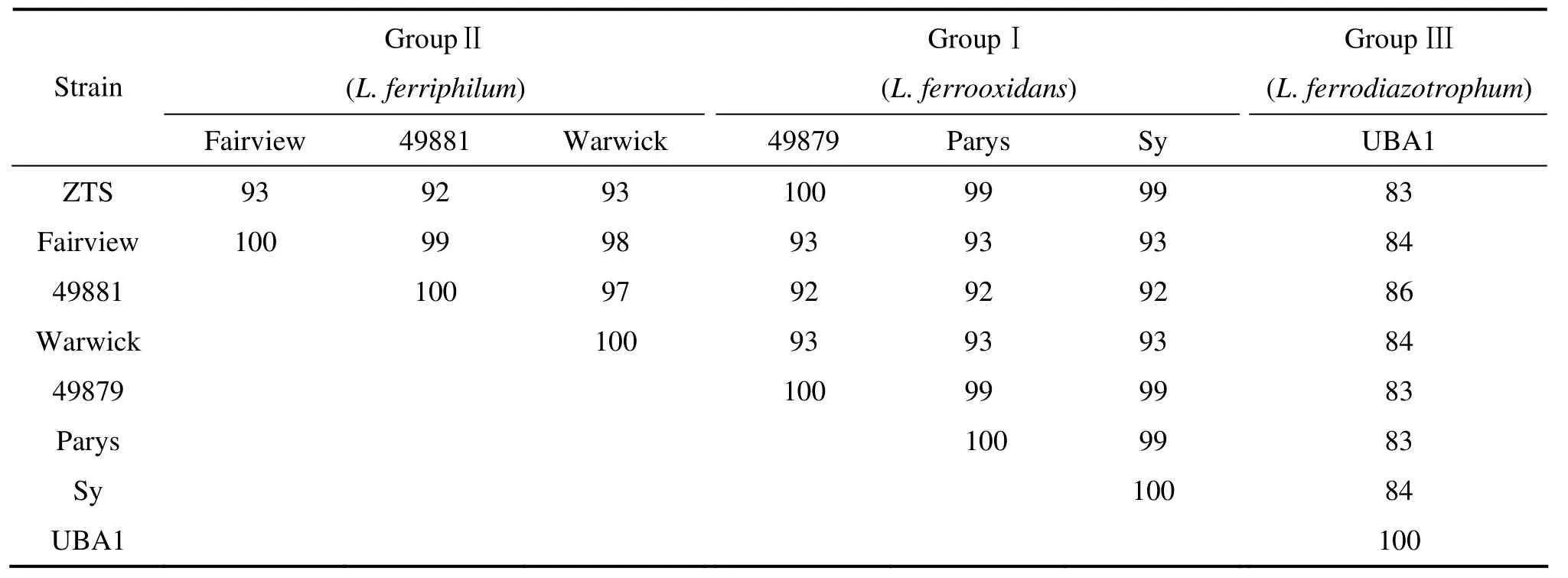
表2 ZTS菌株与钩端螺旋菌属已知成员的16S rDNA序列的相似性比较Table 2 16S rDNA sequences similarity(%) between strain ZTS and given members of genus Leptospirillum
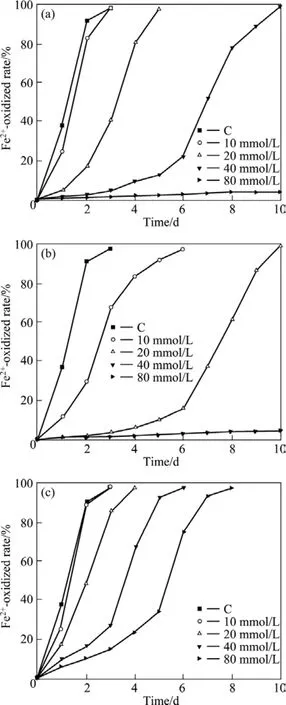
图6 不同浓度的Cu2+、Co2+和Ni2+对ZTS菌株氧化Fe2+能力的影响Fig.6 Effect of Cu2+(a), Co2+(b) and Ni2+(c) on Fe2+-oxidized ability of strain ZTS (C: Inoculated flasks without metal addition)
据SAND等[2]报道,氧化亚铁钩端螺旋菌对Co2+非常敏感,其耐受Co2+的质量浓度小于2 g/L,而本研究的ZTS菌株耐受Co2+的质量浓度与其结果基本一致,表明氧化亚铁钩端螺旋菌种内菌株间的Co2+抗性可能具有相对的稳定性。另外,他们通过比较研究嗜酸氧化亚铁硫杆菌、嗜酸氧化硫硫杆菌和氧化亚铁钩端螺旋菌对重金属的抗性,认为氧化亚铁钩端螺旋菌与嗜酸氧化亚铁硫杆菌对Cu2+和Ni2+的抗性相当,但存在同种菌株间的异质性。就Cu2+抗性而言,氧化亚铁钩端螺旋菌对Cu2+的耐受能力高的可达25 g/L(相当于400 mmol/L的Cu2+),低的也有20g/L;而本研究中ZTS菌株的Cu2+的耐受能力低于80 mmol/L。这一结果与SAND等[2]报道的结果相差较大,这进一步证实了菌株间异质性的存在。尽管如此,ZTS菌株经过近一年的驯化后,其Cu2+的抗性也可以达到300 mmol/L,即19.2 g/L(数据未显示);至于Ni2+抗性,SAND等[2]报道的结果是氧化亚铁钩端螺旋菌的抗Ni2+能力达8 g/L,约相当于134 mmol/L的Ni2+。而图6表明,对于测试的3种重金属离子,ZTS菌株对Ni2+也显示出较高的耐受能力,鉴于此,ZTS菌株对Ni2+分别在160和320 mmol/L的耐受性也被测试。结果表明,当Ni2+浓度为160 mmol/L时,ZTS菌株经过20 d的培养后,培养液中的Fe2+被完全氧化;而当Ni2+浓度为320 mmol/L时,ZTS菌株即使经过35 d的培养后,培养液中的Fe2+浓度仍然与无菌空白对照培养液中的Fe2+浓度相当(数据未显示)。这表明ZTS菌株至少能够耐受160 mmol/L(9.44 g/L)的Ni2+。另外,在SAND等[2]的报道中,对氧化亚铁钩端螺旋菌而言,Ni2+的毒性比Cu2+大得多,但本研究中ZTS菌株的Ni2+抗性能力却比Cu2+抗性高得多,这可能与其本身的遗传特性有关。因此,抗高浓度Ni2+的氧化亚铁钩端螺旋菌ZTS菌株的分离,为后续研究氧化亚铁钩端螺旋菌的镍抗性遗传机制提供了极好的材料。
3 结论
1) 从山西中条山铜矿废弃的酸性矿坑水中分离出一株螺旋状或弧状细菌,命名为ZTS菌株。经形态学、生理学以及核糖体16S RNA基因序列分析表明,ZTS菌株属于氧化亚铁钩端螺旋菌(L. ferrooxidans)。
2) 重金属抗性试验结果表明,ZTS菌株耐受Ni2+的能力可高达160 mmol/L,从而显示出较好的应用前景。同时,它的分离也为后续研究氧化亚铁钩端螺旋菌的镍抗性遗传机制提供了极好的材料。
REFERENCES
[1] KELLY D P, WOOD A P. Reclassification of some species of Thiobacillus to the newly designated genera Acidithiobacillus gen. nov., Halothiobacillus gen. nov. and Thermithiobacillus gen. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50: 511−516.
[2] SAND W, GEHRKE T, HALLMANN R, RHODE K,SOBOTKE B, WENTZIEN S. In-situ bioleaching of metal sulfides: The importance of Leptospirillum ferrooxidans[C]//TORMA A E, WEY J E, LAKSHMANAN V I. Biohydrometallurgical Technologies.(Vol. 1), Warrendale, Pennsylvaia, 1993: 15−27.
[3] VERA M, PAGLIAI F, GUILIANI N, JEREZ C A. The chemolithoautotroph Acidithiobacillus ferrooxidans can survive under phosphate-limiting conditions by expressing a C-P lyase operon that allows it to grow on phosphonates[J]. Applied and Environmental Microbiology, 2008, 74(6): 1829−1835.
[4] NEMATI M, HARRISON, S T L. A comparative study on thermophilic and mesophilic biooxidation of ferrous iron[J]. Minerals Engineering, 2000, 13(1): 19−24.
[5] LI H M, KE J J. Influence of Ni2+and Mg2+on the growth and activity of Cu2+-adapted Thiobacillus ferrooxidans[J]. Hydrometallurgy, 2001, 61: 151−156.
[6] LEDUC L G, FERRONI G D. The chemolithotrophic bacterium Thiobacillus ferrooxidans[J]. FEMS Microbiology Reviews, 1994, 14: 103−120.
[7] LEDUC L G, FERRONI G D, TREVORS J T. Resistance to heavy metals in different strains of Thiobacillus ferrooxidans[J]. World Journal of Microbiology and Biotechnology, 1997, 13: 453−455.
[8] DAS A, MODAK J M, NATARAJAN K A. Studies on multi-metal ion tolerance of Thiobacillus ferrooxidans[J]. Minerals Engineering, 1997, 10: 743−749.
[9] NOVO M T, DA SILVA A C, MORETO R, CABRAL P C, COSTACURTA A, GARCIAO, JR & OTTOBONI L M. Thiobacillus ferrooxidans response to copper and other heavy metals: Growth, protein synthesis and protein phosphorylation[J]. Antonie van Leeuwenhoek, 2000, 77: 187−195.
[10] KIM S D, BAE J E, PARK H S, CHA D K. Bioleaching of cadmium and nickel from synthetic sediments by Acidithiobacillus ferrooxidans[J]. Environmental Geochemistry and Health, 2005, 27(3): 229−235.
[11] LOMBARDI A T, GARCIA O, MOZETO A A. Bioleaching of metals from anaerobic sewage sludge: Effects of total solids, leaching microorganisms, and energy source [J]. Journal of Environmental Science and Health, Part A: Toxic/Hazardous Substances & Environmental Engineering, 2001, 36: 793−806.
[12] CHEN B Y, LIU H L, CHEN Y W, CHENG Y C. Dose-response assessment of metal toxicity upon indigenous Thiobacillus thiooxidans BC1[J]. Process Biochemistry, 2004, 39: 735−745.
[13] BARREIRA R P R, VILLAR L D, GARCIA O. Tolerance to copper and zinc of Acidithiobacillus thiooxidans isolated from sewage sludge[J]. World Journal of Microbiology and Biotechnology, 2005, 21: 89−91.
[14] KONISHI Y, TOSHIDO S, ASAI S. Bioleaching of pyrite by acidophilic thermophile Acidianus brierleyi[J]. Biotechnology and Bioengieering, 1995, 48: 592−600.
[15] VITAYA V B, LOIZUMI J, TODA K A. Kinetic assessment of substantial oxidation by Sulfolobus acidocaldarius in pyrite dissolution[J]. Journal of Fermentation Bioengineering, 1994, 77(5): 528−534.
[16] 丁建南, 朱若林, 康 健, 张成桂, 吴学玲, 邱冠周. 喜温嗜酸硫杆菌YN12菌株的鉴定及其镉抗性能[J]. 中国有色金属学报, 2008, 18(2): 342−348. DING Jian-nan, ZHU Ruo-lin, KANG Jian, ZHANG Cheng-gui, WU Xue-ling, QIU Guan-zhou. Identification and cadmium (Ⅱ) resistance of strain YN12, Acidithiobacillus caldus[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(2): 342−348
[17] NORRIS P R, PARROTT L, MARSH R M. Moderately thermophilic mineral-oxidizing bacteria[J]. Biotechnology and Bioengineering Symposium, 1986, 16: 253−262.
[18] 高 健, 康 健, 吴学玲, 徐 竞竞, 李邦梅, 邱冠周. Fe2+对嗜铁钩端螺旋菌(L. ferriphilum)生长活性的影响[J]. 中国有色金属学报, 2008, 18(1): 159−162. GAO Jian, KANG Jian, WU Xue-ling, XU Jing, LI Bang-mei, QIU Guan-zhou. Effect of Fe2+on growth activity of L. ferriphilum[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(1): 159−162.
[19] GAO J, ZHANG C G, WU X L, WANG H H, QIU G Z. Isolation and identification of a strain of L. ferriphium from an acid mine adrainage site[J]. Annals of microbiology, 2007, 57(2): 171−176.
[20] VOGEL A I. A textbook of quantitative chemical analysis[M]. London: Longmam, 1962: 309−319.
[21] GÜRTLER V, STANISICH V A. New approaches to typing and identification of bacteria using the 16S-23S rDNA spacer region[J]. Microbiology, 1996, 142: 3−16.
[22] TAMURA K, DUDLEY J, NEI M, KUMAR S. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596−1599.
[23] SAITOU N, NEI M. The neighbor-joining method: A new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution, 1987, 4: 406−425.
[24] HIPPE H. Leptospirillum gen. nov.(ex Markosyan 1972), nom. rev., including Leptospirillum ferrooxidans sp. nov.(ex Markosyan 1972) nom. rev. and Leptospirillum thermoferrooxidans sp. nov.(GOLOVACHEVA et al. 1992)[J]. International Journal of Systematic and Evolutional Microbiology, 2000, 50: 501−503.
[25] CORAM N J, RAWLINGS D E. Molecular relationship between two groups of Leptospirillum and the finding that the world and the Leptospirillum ferriphilum sp. nov. dominates South African commercial biooxidation tanks that operate at 40℃[J]. Applied and Environmental Microbiology, 2002, 68: 838−845.
[26] TYSON G W, LO I, BAKER B J, ALLEN E E, HUGENHOLTZ P, BANFIELD J F. Genome-directed isolation of the key nitrogen fixer Leptospirillum ferrodiazotrophum sp. nov. from an acidophilic microbial community[J]. Appl Environ Microbiol, 2005, 71(10): 6319−6324.
[27] VARDANYAN N S, AKOPYAN V P. Leptospirillum-like bacteria and evaluation of their role in pyrite oxidation[J]. Mikrobiologiya, 2003, 72(4): 493−497.
(编辑 何学锋)
Identification and heavy metal toxicity assessment upon Fe2+-oxidizing ability of Leptospirillum-like bacterium isolated from acid mine drainage
GAO Jian1, DING Jian-nan2, KANG Jian1, WU Xue-ling2, QIU Guan-zhou2
(1. School of Life Science, Hunan University of Science and Technology, Xiangtan 411201, China; 2. School of Resources Processing and Bioengineering, Central South University, Changsha 410083, China)
Using a dilution method, an iron-oxidizing bacterium, designated strain ZTS, was isolated from acid mine drainage of Zhongtiaoshan Copper Mine, Shanxi Province, China. Cells of strain ZTS were spiral or curved-shaped, gram-negative, and the optimum temperature was 30 ℃ and the optimum pH was 2.5. The strain ZTS was sensitive to low concentration of yeast extract. The cell shape, physiological characteristics and 16S rDNA sequence analysis indicated that the strain ZTS should belong to the species of Leptospirillum ferrooxidans. Considering its recent commercial interest, the effects of copper (Cu2+), cobalt (Co2+) and nickel (Ni2+) on strain ZTS were investigated during the oxidation of a ferrous iron solution (40 g/L). The results show that copper, cobalt and nickel individually inhibit the ferrous iron oxidation in the order Co2+>Cu2+>Ni2+. Interestingly, the nickel resistance capability of strain ZTS, which can resist nickel of 160 mmol/L, is much stronger than that of Leptospirillum ferrooxidans reported ago. This ability of strain ZTS may be relevant to its genetic characteristics.
acid mine drainage; Leptospirillum ferrooxidans; iron oxidation ability; heavy metal resistance
1004-0609(2011)01-0220-07
国家重点基础研究发展计划资助项目(2010CB630900)
2010-01-28;
2010-06-07
邱冠周, 教授, 博士;电话: 0731-88879815; E-mail: qgzfblw@yahoo.com.cn

