转谷氨酰胺酶催化对不同大豆蛋白凝胶性的影响
安 静,于国萍*,初云斌,窦超然,姜巍巍
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
转谷氨酰胺酶催化对不同大豆蛋白凝胶性的影响
安 静,于国萍*,初云斌,窦超然,姜巍巍
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
研究转谷氨酰胺酶对大豆分离蛋白和7S、11S球蛋白凝胶特性的影响,采用TA-XT plus物性测定仪、荧光分光光度计对各参数进行测定。结果表明:转谷氨酰胺酶能够显著提高大豆蛋白凝胶的凝胶强度,最佳工艺条件为酶添加量40U/g、温度40℃、pH7.5、作用时间2.5h,但此时凝胶表面疏水性和保水性有所下降。经转谷氨酰胺酶催化后,不同蛋白形成热处理凝胶的凝胶特性均发生显著变化,凝胶强度均显著增加,转谷氨酰胺酶催化后大豆蛋白凝胶强度的顺序为11S>7S>SPI。
转谷氨酰胺酶;大豆分离蛋白;7S球蛋白;11S球蛋白;凝胶性
中国是大豆的起源地,也是大豆食品生产和消费大国。大豆含有约40%(干基)的蛋白质,比任何一种粮食作物的蛋白质含量都高,大豆蛋白已作为一种组分应用于各种食品[1]。7S和11S球蛋白是大豆分离蛋白(SPI)主要成分,它们有不同的功能性质和结构。7S球蛋白具有良好的乳化性,11S球蛋白的凝胶性和起泡性较好,这些功能性质对大豆分离蛋白的功能特性起着十分重要的作用,而含有大豆蛋白的制品质地会受其功能特性的影响[2-3]。
转谷氨酰胺酶(TGase)是一种酰基转移酶,可催化相同或不同蛋白质分子之间交联与聚合,形成新的共价键[4]。转谷氨酰胺酶可以提高大豆分离蛋白的凝胶能力及性能。TGase催化SPI形成凝胶的主要作用是分子交联形成的空间网络结构[5-7]。目前,很多人都在研究转谷氨酰胺酶对热诱导大豆蛋白及其他蛋白凝胶特性的影响。而在国外,转谷氨酰胺酶交联的高蛋白产品在市场已广泛存在[8]。
本实验以大豆蛋白为原料,研究转谷氨酰胺酶对不同大豆蛋白凝胶强度、保水性和表面疏水性的影响,了解其变化规律,寻找其可能的变化机理,为改进大豆蛋白的功能性和应用价值提供参考。
1 材料与方法
1.1 材料、试剂与仪器
转谷胺酰胺酶[转谷氨酰胺酶活力单位(U)定义为每分钟产生lμmol氧肟酸所需酶量。本品实测为952U/g] 一鸣生物制品有限公司。1-苯胺基萘-8-硝基苯甲酸盐(ANS) 美国Sigma公司;大豆分离蛋白(SPI)、低温脱脂豆粉 哈高科大豆食品有限责任公司;其余试剂均为国产分析纯。
TA-XT plus物性测定仪 英国Stable Micro System公司;650-60荧光分光光度计 日本岛津公司;实验室pH计 梅特勒-托利多仪器(上海)有限公司;HJ-3恒温磁力搅拌器 江苏金坛市中大仪器厂;LD10-2.4A离心机 北京医药离心机厂。
1.2 方法
1.2.1 大豆7S和11S蛋白的提取和鉴定
依据Nagano法提取大豆7S和11S蛋白[9]。本实验终产物7S和11S球蛋白采用冻干的方式制得,不同于Nagano法中的低温干燥。凯氏定氮法测定大豆7S和11S球蛋白总蛋白含量(GB/T 5009.5—2003《食品中蛋白质的测定》)(蛋白质转换系数6.25)。
把SPI、7S和11S球蛋白作为样品,同时,取酶催化后的不同大豆蛋白凝胶,加入到0.01mol/L pH7.0的磷酸缓冲液中,在室温条件下,用磁力搅拌器缓慢搅拌2h,然后,将处理过的样品在9000r/min离心15min,从3种凝胶中提取出的蛋白作为酶催化后的样品。将各样品加入到样品缓冲液[0.5mol/L Tris-HCl(pH6.8)2mL、甘油2mL、20g/100mL的SDS 2mL、0.1g/100mL溴酚蓝0.5mL、β-巯基乙醇1mL、重蒸水2.5mL]中,最终SPI和7S、11S球蛋白的质量浓度是1mg/mL。标准蛋白质Markers分子质量14400~97400D。在80V和120V条件下,浓缩胶(4%)和分离胶(14%)(V/V)进行电泳实验。考马斯亮蓝(R-250)染色液染色。然后用脱色液(冰醋酸75mL和甲醇50mL,蒸馏水定容到1000mL)脱色。
1.2.2 转谷氨酰胺酶催化制备大豆分离蛋白凝胶
1.2.2.1 加酶量对大豆分离蛋白凝胶特性的影响
配制13g/100mL大豆分离蛋白分散液:以13g大豆分离蛋白分散在100mL水中,室温条件下,用磁力搅拌器搅拌2h。大豆分离蛋白最终质量浓度为13g/100mL。
将配制好的13g/100mL大豆分离蛋白分散液,调pH值到7.5,按蛋白质量添加TGase量分别为0、10、20、30、40、50、60U/g,反应物于40℃反应0.5h。
制胶条件:将样品在90℃加热40min。然后,用冰水浴将凝胶迅速冷却至室温。最后,将样品置于4℃冰箱过夜,用于凝胶性质的测定。
1.2.2.2 反应温度对大豆分离蛋白凝胶特性的影响
配制13g/100mL大豆分离蛋白分散液,调pH值到7.5,添加TGase量40U/g,反应物于30、40、50、60、70℃反应0.5h。按1.2.2.1节制胶条件,制备凝胶。
1.2.2.3 pH值对大豆分离蛋白凝胶特性的影响
配制13g/100mL大豆分离蛋白分散液,调pH值到5.5、6.0、6.5、7.0、7.5、8.0、8.5,添加TGase量40U/g,反应物于40℃反应0.5h。按1.2.2.1节制胶条件,制备凝胶。
1.2.2.4 反应时间对大豆分离蛋白凝胶特性的影响
配制13g/100mL大豆分离蛋白分散液,调pH值到7.5,添加TGase量40U/g,反应物于40℃分别反应0.5、1、1.5、2、2.5、3、3.5h。按1.2.2.1节制胶条件,制备凝胶。
1.2.3 转谷氨酰胺酶催化大豆分离蛋白和7S、11S球蛋白后3种凝胶特性的比较
分别称取不同量的大豆分离蛋白和7S、11S球蛋白原料(使三者纯蛋白含量同为10.61%),调pH值到7.5,添加TGase量为40U/g,反应物于40℃反应2.5h。按1.2.2.1节制胶条件,制备凝胶。
1.2.4 蛋白凝胶的凝胶强度的测定
依据Campbell等[10]测定方法,略有改动。样品测定前在室温条件下陈化1h即可测定。凝胶大小约为50mm(直径)×25mm(高)。采用P/0.5柱形探头,设定前进速度10mm/s,冲压速度10mm/s;后撤速度10mm/s,冲压深度10mm;一次测定过程中探头下压两次。每个样品重复3次测定过程,取平均值,得凝胶质构参数。
1.2.5 蛋白凝胶的表面疏水性指数的测定[10-11]
取一块不同方法制得的大豆蛋白凝胶,加入到0.01mol/L pH7.0的磷酸缓冲液中,在室温条件下,用磁力搅拌器缓慢搅拌2h。然后,将处理过的样品在9000r/min离心15min,取上清液备用。采用ANS(1-苯胺基-8-萘磺酸)荧光探针法,对大豆分离蛋白凝胶的表面疏水性指数进行测定,具体方法见文献[11]。
1.2.6 蛋白凝胶保水性的测定
测定方法依据Gu等[12]的方法,略有改动。大豆蛋白凝胶在9000r/min离心20min。保水性(WHC)计算式如下:
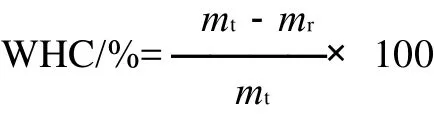
式中:mt为凝胶样品中所含水分的总质量/g;mr为离心后凝胶溢出水分的质量/g。
1.2.7 扫描电镜分析(scanning electron microscopy,SEM)
依据Chin等[13]测定方法,取一块凝胶(3mm×3mm×3mm)在体积分数2.5%的戊二醛溶液(用pH7.0的0.1mol/L磷酸缓冲液配制)中于4℃固定24h。用pH7.0的0.1mol/L磷酸缓冲液洗涤10min(重复3次)。室温,50%、60%、70%、80%、90%、100%乙醇梯度脱水,每次10min。临界点干燥,离子溅射,给样品镀金。扫描电镜观察,加速电压5kV,观测并拍摄样品颗粒的外观形态。
1.2.8 统计分析
每次实验重复3次,所用数据均为3次的平均值,误差项为标准差,数据均使用SPSS 13.0软件进行统计分析。
2 结果与分析
2.1 各原料总蛋白含量
根据国标(GB/T 5009.5—2003)测定原料脱脂豆粉、大豆分离蛋白和本实验制备的大豆7S和11S球蛋白的蛋白含量(湿基),结果列于表1。

表1 原料成分表Table 1 Composition table of materials
2.2 转谷氨酰胺酶催化前后SPI和7S、11S球蛋白凝胶的SDS-PAGE电泳分析
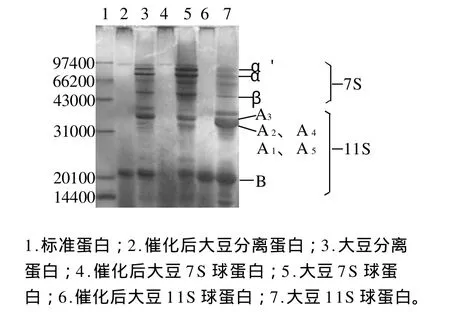
图1 转谷氨酰胺酶催化前后蛋白凝胶的电泳图谱Fig.1 SDS-APGE of SPI and 7S, 11S proteins before and after treatment with TGase
根据蛋白质分子质量与相对迁移率的关系,由图1求出回归方程为lgM=-1.1925x+5.2752,R2=0.9993。图中7S球蛋白(泳道5)的电泳图谱中3条主要的蛋白带所对应的亚基相对分子质量,从上至下依次为81000、72000和51000,与文献报道的 7S球蛋白的3种亚基的相对分子质量基本吻合[14]。大豆11S球蛋白,共12个亚基,具有6个酸性亚基(A1、A2、A3、A4、A5、A6)和 6 个碱性亚基(B1、B2、B3、B4、B5、B6)。图1中11S球蛋白(泳道7)的电泳图谱中3条主要的蛋白带所对应的亚基相对分子质量,从上至下依次为35000、34800、21000,分别与文献报道的碱性亚基B的相对分子质量为21000,酸性亚基A1、A2、A4、A5为34800,A3为35000相吻合[14]。从图谱可以看出11S和7S球蛋白中含有少量的杂带,但是11S和7S球蛋白相关的亚基已富集,可以认为它们己经具有较高的纯度,可以用于实验。
加入转谷氨酰胺酶后,反应体系中聚合物的量不断增加。由于TGase对大豆蛋白交联聚合作用,使聚合物相对分子质量增大,以至于不能很好进入分离胶而只能停留在浓缩胶与分离胶的界面上,即图中顶端电泳区带。
由电泳图可知,经TGase催化的大豆7S球蛋白(泳道4)的3个亚基电泳图谱有较大变化。7S球蛋白的部分亚基条带色泽变淡或消失;那些亚基聚合成了一些大分子聚合物而不能进入分离胶(即图1顶端黑色条带)。经TGase改性后大豆11S球蛋白(泳道6)的酸性亚基的量近乎于消失,而碱性亚基几乎都没有明显的变化,说明11S球蛋白的酸性亚基聚合生成了大分子蛋白聚合物,而TGase对11S蛋白碱性亚基几乎没有影响,出现这种结果可能是因为11S蛋白的碱性亚基被深深地包在大豆球蛋白的内部,很难与TGase结合形成活化复合物。
2.3 转谷氨酰胺酶催化对大豆分离蛋白凝胶强度的影响
2.3.1 酶添加量对大豆分离蛋白凝胶强度的影响
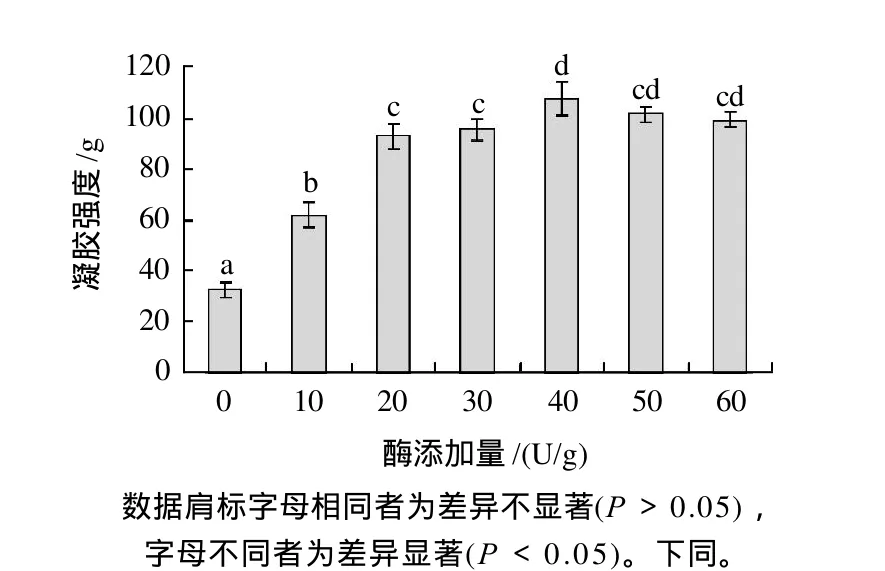
图2 酶添加量对TGase催化大豆分离蛋白凝胶强度的影响Fig.2 Effect of TGase addition amount on gel hardness of TGase-treated SPI gels
由图2可知,随着加酶量的增加,凝胶强度显著增加;加酶量在40U/g时,凝胶强度达到最大;随着加酶量继续增加,凝胶强度有所下降。同时说明添加TGase对SPI凝胶强度有很明显的改善作用,此时维系蛋白质凝胶网络稳定所需的共价键的数目具有一定的饱和性。而过多的酶量反而不利于凝胶的空间网络,原因可能是:加酶量大时,蛋白质分子表面的作用位点可能会很快被交联而降低了其与周围其他蛋白质分子进行交联的机率,因而形成的分子间交联要比加酶量小的情况下要少。而分子间的交联对凝胶性起主要作用;分子内交联起的作用不大[5,17]。
2.3.2 温度对大豆分离蛋白凝胶强度的影响
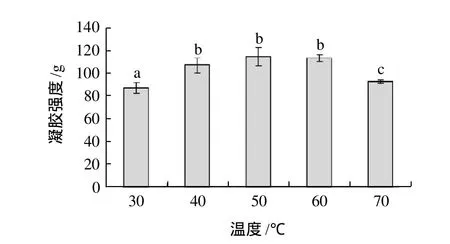
图3 温度对TGase催化大豆分离蛋白凝胶强度的影响Fig.3 Effect of treatment temperature on gel hardness of TGase-treated SPI gels
由图3可知,随着酶反应温度的增加,凝胶强度显著增加;在40~60℃,没有显著变化;在70℃时,凝胶强度显著下降。
温度一方面影响酶反应的速度,另一方面影响酶活性。唐传核等[15]报道,TGase的最适反应温度为50~55℃。Ando等[16]曾报道,以氧肟酸为底物时,微生物TGase在pH7.0时,酶的最适反应温度为40℃。本实验与上述结论基本相符合。较高温度条件下交联反应速度很快,使得蛋白质分子表面的作用位点很快被交联而降低了此蛋白质分子与其周围蛋白质分子进行分子间交联的机率,因而分子间的交联所占比例下降[5,15,17]。
2.3.3 pH值对大豆分离蛋白凝胶强度的影响

图4 pH值对TGase催化大豆分离蛋白凝胶强度的影响Fig.4 Effect of treatment pH on gel hardness of TGase-treated SPI gels
由图4可知,在pH5.5~7.5范围内,随着pH值的增加,凝胶强度增加;在pH7.5时,凝胶强度最高;之后,随着pH值继续增加,凝胶强度显著下降。说明pH5.5~8.5范围内对SPI凝胶强度产生很明显的影响。
研究表明:TGase的最适pH值范围是6.0~7.5,本实验结果与之基本一致。体系pH值改变一方面影响酶活性和稳定性;另一方面影响SPI的溶解性,影响蛋白质相互作用过程中的疏水作用和静电作用之间的平衡,进而影响凝胶的网状结构。在极端pH值条件下,酶蛋白不稳定发生空间构象改变而丧失活性;而pH值处于SPI的等电点(4~5)附近时,蛋白质分子所带净电荷较少,易凝结成块,无法形成有序的网状结构[5,17]。
2.3.4 作用时间对大豆分离蛋白凝胶强度的影响
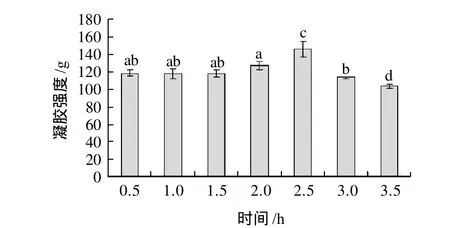
图5 作用时间对TGase催化大豆分离蛋白凝胶强度的影响Fig.5 Effect of treatment time on gel hardness of TGase-treated SPI gels
由图5可知,反应时间在0.5~2h,随着反应时间的增加,凝胶强度变化不明显,反应时间继续增加,凝胶强度显著增加;在2.5h时,凝胶强度达到最大;之后,呈现显著下降趋势。
反应时间也是影响酶促反应的重要因素,因此对SPI的凝胶性也必然产生较大的影响。随酶促反应时间延长,底物不断消耗,其浓度逐渐降低,酶也逐渐失活。所以,达到一定程度后催化速度必然减慢,SPI凝胶强度也呈现下降趋势。
2.4 转谷氨酰胺酶催化对大豆分离蛋白(SPI)和7S、11S球蛋白凝胶特性的影响
2.4.1 转谷氨酰胺酶催化对大豆分离蛋白和7S、11S球蛋白凝胶强度的影响
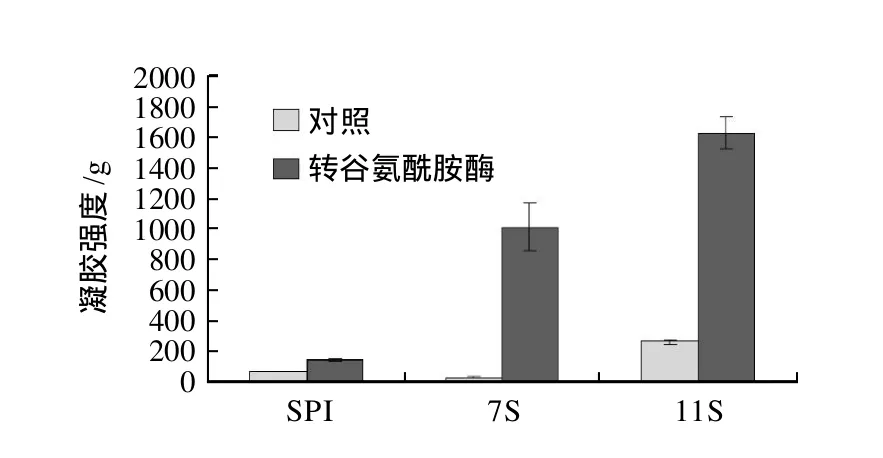
图6 TGase催化对SPI和7S、11S球蛋白凝胶强度的影响Fig.6 Effect of TGase treatment on gel hardness of SPI and 7S, 11S gels
由如图6可知,SPI和7S、11S球蛋白在90℃加热40min后,11S球蛋白凝胶的凝胶强度远远超出SPI凝胶、7S凝胶。热处理后的凝胶强度:11S>SPI>7S。经转谷氨酰胺酶催化后的SPI、7S、11S球蛋白凝胶强度显著增加。TGase催化后的凝胶强度11S>7S>SPI。
转谷氨酰胺酶的添加,提高了大豆分离蛋白的凝胶能力及性能,酶导致的蛋白中疏水基团的暴露有利于在较低的蛋白浓度下形成网络组织结构。TGase催化SPI形成凝胶的主要作用是分子交联形成的空间网络结构[5-7]。TGase催化大豆蛋白不同组分的速率是有所差异的,催化11S球蛋白聚合时,只能催化11S中的酸性亚基(acid subunits)聚合,而几乎不影响11S的碱性亚基(basic subunits),是由于11S球蛋白的结构特征所致,其酸性亚基似乎位于球状结构的外部,而碱性亚基趋向于埋于内部(疏水性更高)。与11S相对应,7S主要由α-、α′-以及γ-亚基组成,TGase似乎较难催化它聚合。大豆7S球蛋白具有紧密的空间结构,因而不是MTGase的较好底物,然而随着TGase催化大豆11S球蛋白聚合较完全之后,它也会催化7S球蛋白缓慢聚合。另外,TGase导致大豆7S球蛋白聚合,导致它的空间结构松散,从而更有利于TGase的催化[18]。
TGase催化大豆蛋白(特别是11S)的反应温度最好低于50℃。从某种程度上来说,较高温度下聚合较短时间可达到较低温度下较长时间的效果。尽管不同催化条件下聚合效果差不多,但是形成的生物聚合物的功能特性却不一样,较低温度反应较长时间所形成的生物聚合物的聚合度较大[15]。
2.4.2 转谷氨酰胺酶催化对大豆分离蛋白和7S、11S球蛋白凝胶的表面疏水性指数的影响
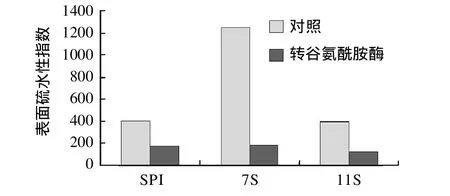
图7 TGase催化对SPI和7S、11S球蛋白凝胶表面疏水性的影响Fig.7 Effect of TGase treatment on surface hydrophobicity of SPI and 7S, 11S gels
由图7可知,热处理后的7S球蛋白凝胶的表面疏水性指数远远高于SPI和11S球蛋白。转谷氨酰胺酶催化后的SPI、7S、11S凝胶的表面疏水性指数显著降低。TGase催化后的凝胶的表面疏水性指数为7S>SPI>11S。大豆蛋白主要成分是11S和7S球蛋白,在中性pH条件下,其变性温度分别为80℃左右和70℃左右,所以7S较11S更容易变性,其结构变得更松散,疏水基团外漏。
2.4.3 转谷氨酰胺酶催化对大豆分离蛋白和7S、11S球蛋白凝胶保水性的影响
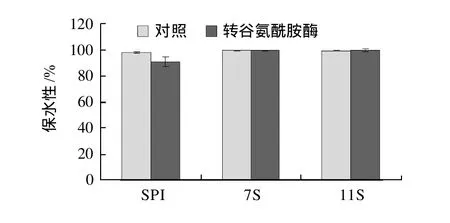
图8 TGase催化对SPI和7S、11S球蛋白凝胶保水性的影响Fig.8 Effect of TGase treatment on water-holding capacity of SPI and 7S, 11S gels
由图8可知,热处理后的SPI、7S、11S三种蛋白凝胶保水性没有显著差异。经转谷氨酰胺酶催化后的SPI、7S、11S凝胶表面疏水性略有下降,但也没有显著变化。
由SDS-PAGE图可知,TGase催化大豆蛋白溶解性下降,经TGase作用形成了较大的共价聚合物,亲水性基团因相互聚合而减少,这对溶解性的下降起一定的作用。另有研究[5]发现经TGase催化后,其二级结构和三级结构逐渐打开,多肽链变的舒展,使原先埋藏于分子内部的诸多疏水区域暴露于溶液,然而这种疏水区域在水溶液中是不稳定的,它们会因相互疏水作用而凝集或聚合在一起,进而从溶液中析出而沉降。因TGase催化作用导致大豆蛋白溶解度下降,分子内部的诸多疏水区域暴露,所以导致酶催化后各种蛋白凝胶的表面疏水性指数和保水性下降。
3 结 论
通过实验确定了转谷氨酰胺酶的相关参数(酶添加量、作用温度、pH值及反应时间)对转谷氨酰胺酶催化大豆分离蛋白凝胶凝胶强度影响的变化规律。结果表明,转谷氨酰胺酶催化显著提高了大豆分离蛋白凝胶的凝胶强度,而酶催化后各种蛋白凝胶的表面疏水性指数和保水性有不同程度的下降。经转谷氨酰胺酶催化后,大豆SPI、7S、11S球蛋白的凝胶强度变化幅度顺序为11S>7S>SPI。转谷氨酰胺酶主要催化大豆7S球蛋白和大豆11S球蛋白的酸性亚基发生交联,而对大豆11S球蛋白的碱性亚基几乎没有影响。
[1] LAKEMOND C M M, de JONGH H H J, PAQUES M, et al. Gelationof soy glycinin; influence of pH and ionic strength on network structure in relation to protein conformation[J]. Food Hydrocolloids, 2003, 17(3):365-377.
[2] LI Xianghong, LI Yun, HUA Yufei, et al. Effect of concentration, ionic strength and freeze-drying on the heat-induced aggregation of soy proteins[J]. Food Chemistry, 2007, 104(4): 1410-1417 .
[3] RENKEMA J M S, VLIET T V. Relations between rheological properties and network structure of soy protein gels[J]. Food Hydrocolloids,2004, 18: 39-47.
[4] 陈伟斌. 大豆分离蛋白的功能性和改性研究进展[J]. 粮食加工, 2006(4): 67-71.
[5] 田少君, 梁华民. 转谷氨酰胺酶对大豆分离蛋白的改性研究[J]. 粮油加工与食品机械, 2005(6): 54-59.
[6] 袁道强, 杨丽. 改性对大豆分离蛋白凝胶性的影响[J]. 食品科技,2007, 14(2): 21-23.
[7] 郑雅丹, 张建友, 丁玉庭, 等. 大豆蛋白凝胶特性研究进展[J]. 中国酿造, 2008(14): 11-15.
[8] GAN C Y, CHENG L H, EASA A M. Physicochemical properties and microstructures of soy protein isolate gels produced using combined cross-linking treatments of microbial transglutaminase and Maillard crosslinking[J]. Food Research International, 2008, 41(6): 600-605.
[9] 刘春, 王红玲, 崔竹梅, 等. 大豆籽粒贮藏蛋白11S和7S组分提取分离方法的优化[J]. 中国油脂, 2006, 31(2): 31-36.
[10] CAMPBELL L J, GU Xin, DEWAR S J, et al. Effects of heat treatment and glucono-δ-lactone-induced acidification on characteristics of soy protein isolate[J]. Food Hydrocolloids, 2009, 23(2): 344-351.
[11] HETTIARACHCHY N S, KALAPATHY U, MYERS D J. Alkalmodified soy proteins with improved adhesive and hydrophobic properties[J]. Journal of Agricultural and Food Chemistry, 1995, 72(12): 1461-1464.
[12] GU Xin, CAMPBELL L J, EUSTON S R. Influence of sugars on the characteristics of glucono-δ-lactone-induced soy protein isolate gels[J].Food Hydrocolloids, 2009, 23(2): 314-326.
[13] CHIN K B, GO M Y, XIONG Y L. Effect of soy protein substitution for sodium caseinate on the transglutaminate-induced cold and thermal gelation of myofibrillar protein[J]. Food Research International, 2009, 42(8): 941-948.
[14] WOLF W J. Physical and chemical properties of soybean proteins[J]. J Am Oil Chemist ' s Soc, 1997, 54(2): 112-117.
[15] 唐传核, 杨晓泉, 彭志英, 等. 微生物转谷氨酰胺酶催化大豆11S球蛋白聚合研究[J]. 食品科学, 2002, 23(3): 42-46.
[16] ANDO H, ADACHI M, UMEDA K, et al. Purification and characteristics of a novel trans-lutaminase derived from microorganisms[J]. Agric Biol Chem, 1989, 53: 2613-2617.
[17] 姜燕, 温其标, 唐传核. 微生物谷氨酰胺转移酶对大豆分离蛋白凝胶性能的影响[J]. 食品工业科技, 2006, 27(5): 59-62.
[18] 唐传核, 杨晓泉, 赵谋明, 等. MTGase聚合大豆蛋白及其改性机理(I).MTGase催化大豆蛋白研究[J]. 中国粮油学报, 2004, 19(1): 43-47.
Effect of Transglutaminase on Characteristics of Soybean Protein Gels
AN Jing,YU Guo-ping*,CHU Yun-bin,DOU Chao-ran,JIANG Wei-wei
(School of Food Science, Northeast Agricultural University, Harbin 150030, China)
In order to explore the effect of transglutaminase (TGase) on the characteristics of soybean protein isolate (SPI),7S and 11S protein gels, the parameters of these TGase-treated protein gels were determined by TA-XT plus SEM (scanning electron microscope) and fluorescence spectrophotometer. Results indicated that gel hardness of TGase-treated SPI gels was significantly increased compared with that of the control. The optimal conditions of TGase treatment for SPI were TGase addition amount of 40 U/g, treatment temperature of 40 ℃, treatment pH of 7.5 and treatment time of 2.5 h. After treatment with TGase, the surface hydrophobicity and water-holding capacity of soy protein isolate gels exhibited a decrease. Meanwhile,heating treatment also resulted in a significant increase in the hardness of TGase-treated protein gels, and TGase-treated SPI gels had the largest gel intensity, followed by 7S and 11S in turn.
transglutaminase;soy protein isolate;7S;11S;gel characteristics
TS201.2
A
1002-6630(2011)06-0032-06
2010-04-21
国家“863”计划项目(2006AA10Z322);哈尔滨市科技创新人才研究专项(2006RFQXN014)
安静(1983—),女,硕士研究生,研究方向为食品化学。E-mail:anjinganjing2008@yahoo.com.cn
*通信作者:于国萍(1963—),女,教授,博士,研究方向为食品化学。E-mail:yuguopingneau@hotmail.com

