预处理方式对酵母细胞吸附茶多酚性能的影响
刘 寅,王 淼,2,*
(1.江南大学食品学院,江苏 无锡 214122;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122)
预处理方式对酵母细胞吸附茶多酚性能的影响
刘 寅1,王 淼1,2,*
(1.江南大学食品学院,江苏 无锡 214122;2.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122)
采用4种方式对酵母细胞进行预处理,制备醇溶酵母细胞(ACY)、酵母自溶酶解细胞(AEY)、酵母自溶细胞(AY)和碱提取酵母细胞(AWGP),并对它们在水相中吸附茶多酚的性能进行研究。结果表明,在吸附时间4h、吸附温度40℃、茶多酚溶液pH4.00,4种预处理酵母细胞加入量均为2.00g的条件下,它们对茶多酚的吸附率(m/m)可达到ACY 98.1%、AEY 94.3%、AY 93.2%、AWGP 73.2%,单位吸附量达到ACY 319.8mg/g、AEY 307.4mg/g、AY 303.8mg/g、AWGP 238.5mg/g。吸附动力学结果表明,预处理酵母细胞对茶多酚的等温吸附曲线符合Langmuir等温吸附模式和Freundlich等温吸附模式,并且抗氧化实验证明酵母细胞在一定程度上能发挥微胶囊的作用。
酵母细胞;茶多酚;吸附;微胶囊
酵母是最古老、最常用的食品级工业微生物之一。酵母中含有大量的蛋白质和多糖。近年来,国内外研究表明,酵母细胞具有很好的吸附性能,能吸附重金属离子[1-2]和酚类化合物[3],因此,酵母细胞是一种新型的、可食用的微胶囊吸附剂。利用酵母作为吸附剂具有原材料来源丰富、品种多、成本低、吸附设备简单、易操作等特点,还具有速度快、吸附量大、选择性好等优点。并且,酵母β-葡聚糖是构成酵母细胞壁的主要成分,占细胞壁干质量的30%~60%。酵母β-葡聚糖是一种活性多糖,具有多种生理功能:抗肿瘤活性、抗氧化、抗辐射、促进伤口愈合,还能降低胆固醇和血脂[4]。
茶多酚又称茶鞣质或茶单宁,是一类多羟基酚类化合物的总称,其主要成分为儿茶素类化合物(黄烷醇类)、黄酮及黄酮醇类、花色素类、酚酸及缩酚酸类多酚化合物的复合体。其中以儿茶素最为重要,占其总量的80%左右[5]。茶多酚被誉为茶叶中的精华,是形成茶叶色香味的主要成分之一,同时也是茶叶中最重要的功效成分。茶多酚具有抗氧化、抗癌及抑癌、抗衰老、降血脂、降血糖及血压、抗辐射损伤及减轻放疗的不良反应等一系列重要作用。
本实验采用4种不同方法处理面包酵母,得到4种不同的预处理酵母细胞,即醇溶酵母细胞(ACY)、酵母自溶酶解细胞(AEY)、酵母自溶细胞(AY)和碱提取酵母细胞(AWGP)。其中用乙醇处理酵母细胞是目前利用酵母作为吸附载体时常用的预处理手段[6-8],而酵母自溶、酶解以及碱法是目前提取酵母葡聚糖常用的方法[9-11],故本实验选取以上4种方式预处理酵母细胞,分别研究它们在不同吸附时间、细胞加入量、吸附温度、茶多酚溶液pH值等条件下吸附茶多酚的情况,并对其吸附机理、吸附动力学以及吸附后茶多酚在猪油中的抗氧化活性进行研究。
1 材料与方法
1.1 材料与试剂
面包酵母 河北马利食品有限公司;茶多酚(TP≥98%) 遵义陆圣康源科技发展有限责任公司。
无水乙醇、无水乙醚、三氯甲烷、冰醋酸(分析纯)国药集团化学试剂有限公司;硫代硫酸钠标准溶液;KOH标准溶液;酚酞指示剂;淀粉指示剂。
1.2 仪器与设备
ARB 120电子天平 尤尼柯上海仪器有限公司;AB 204-N电子天平 上海森信实验仪器有限公司;EL20型pH计 瑞士梅特勒-托利多仪器有限公司;TGL-16离心机 上海安亭科学仪器厂;Avanti J-25台式冷冻离心机 美国Backman Coulter公司;DKY-11恒温调速回转式摇床 上海社科自动化设备有限公司;V-1800型可见分光光度计 上海美谱达仪器有限公司。
1.3 方法
1.3.1 常规成分的分析
蛋白质:微量凯氏定氮法(GB 5009.5—1985《食品中蛋白质的测定方法》);脂肪:索氏抽提法(GB/T 5009.6—2003《食品中脂肪的测定方法》);总碳水化合物:苯酚硫酸法;灰分:550~650℃灰化法(GB/T 5009.4—2003《食品中灰分的测定方法》)。
1.3.2 醇溶酵母细胞(ACY)的制备[6]
新鲜面包酵母泥依次与50%、70%、90%乙醇溶液按1:3(g/mL)混合,室温搅拌2h,离心(6000r/min,15min),去除上清液,残渣冷冻干燥至水分含量低于5%即为所需醇溶酵母细胞。
1.3.3 酵母自溶细胞(AY)的制备[12]
将新鲜面包酵母泥加入至质量分数3%的NaCl溶液中,配成200g/L的酵母溶液,55℃水浴条件下搅拌均匀,维持pH5.50,低速搅拌24h,离心(6000r/min,15min),去除上清液,残渣冷冻干燥至水分含量低于5%即为所需酵母自溶细胞。
1.3.4 酵母自溶酶解细胞(AEY)的制备
酵母自溶残渣与蒸馏水按1:3(g/mL)混合,55℃水浴搅拌均匀,调节pH8.00,加入碱性蛋白酶,搅拌1h,离心(6000r/min,15min),残渣冷冻干燥至水分含量低于5%即为所需酵母自溶酶解细胞。
1.3.5 碱提取酵母细胞(AWGP)的制备[12]
酵母自溶残渣与质量分数3% NaOH溶液按1:4(g/mL)混合,75℃水浴条件下搅拌2h,自然冷却后,继续搅拌1h,离心(6000r/min,15min),残渣重复上述操作两次,然后调节pH4.50,离心,蒸馏水洗3次,离心,残渣冷冻干燥至水分含量低于5%即为所需碱提取酵母细胞。
1.3.6 茶多酚的定量方法
按GB/T 8313—2002《茶:茶多酚测定》方法测定茶多酚的含量,计算公式如下:

式中:L1为试液的总体积/mL;L2为测定时的用液体积/mL;M0为试样的质量/g;m为试样干物质含量/%;A为试样的吸光度;1.957为用10mm比色杯,当吸光度等于0.50时,每毫升溶液中含茶多酚相当于1.957mg。
1.3.7 酵母细胞对茶多酚的吸附研究[5]
配制一定质量浓度的茶多酚溶液,移取一定量的茶多酚溶液于锥形瓶中,加入适量的酵母细胞,置于恒温振荡器中(110r/min)吸附一定时间,按GB/T 8313—2002的规定测定吸附前后溶液中茶多酚的含量。茶多酚吸附率计算公式如下:

式中:a为吸附前溶液中茶多酚的含量/%;b为吸附前溶液中茶多酚的含量/%。
1.3.8 酵母细胞对茶多酚的吸附动力学研究[14]
配制不同质量浓度、等体积的茶多酚溶液,分别加入等量的酵母细胞,置于恒温振荡器中(110r/min),一定温度条件下吸附一定时间,用Langmuir等温吸附方程和Freundlich等温吸附方程来拟合预处理酵母细胞对茶多酚的等温吸附过程。
1.3.9 吸附前后茶多酚抗氧化作用的检测
1.3.9.1 过氧化值(POV)的测定
在250mL碘量瓶中精确称取油样2~3g(精确至0.0001g),加入30mL三氯甲烷-冰乙酸(体积比2:3)混合液,使样品完全溶解,加入1mL饱和碘化钾溶液,塞好瓶塞,轻摇0.5min,置于暗处3min,取出加入100mL去离子水,摇匀,立即用一定浓度的Na2S2O3标准溶液滴定至浅黄色,加入1mL淀粉指示剂,继续滴定至蓝紫色消失即为终点,并作试剂空白试验。过氧化值计算公式如下:

式中:X为样品的过氧化值/(g/100g);V1为样品消耗Na2S2O3标准溶液的体积/mL;V0为试剂空白消耗Na2S2O3标准溶液体积/mL;c为Na2S2O3标准溶液的浓度/(mol/L);0.1269为与1.00mL Na2S2O3标准溶液相当的碘的质量/g;m为样品质量/g。
1.3.9.2 酸价(AV)的测定
在150mL锥形瓶中精确称取油样3~5g(精确至0.0001g),加入50mL预先中和过的乙醚-乙醇(体积比2:1)混合液中,使样品完全溶解,加入3滴酚酞指示剂,用一定浓度KOH标准溶液滴定,直到指示剂显示终点(酚酞变为粉红色至少需维持10s不褪色)。并作试剂空白实验,酸价计算公式如下:
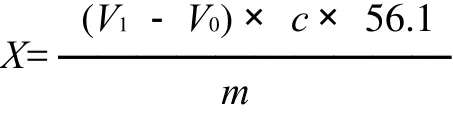
式中:X为样品的酸价/(mg KOH/g);V1为样品消耗KOH标准溶液的体积/mL;V0为试剂空白消耗KOH标准溶液体积/mL;c为KOH标准溶液的浓度/(mol/L);56.1为KOH的摩尔质量/(g/mol);m为样品质量/g。
2 结果与分析
2.1 酵母细胞的成分分析
酵母细胞的成分对其吸附性能有较大影响,故本研究首先对预处理酵母细胞的成分进行分析,结果(以干物质计)见表1。

表1 预处理酵母细胞的成分分析Table 1 Composition analysis of pre-treated yeast cells
2.2 酵母细胞对茶多酚的吸附性能研究
2.2.1 吸附时间对吸附的影响
平行吸取10mL质量分数40mg/mL的茶多酚溶液7份,分别加入0.50g预处理酵母细胞ACY、AY、AEY和AWGP,置于恒温振荡器中(110r/min,30℃),吸附不同时间(1.0、2.0、3.0、4.0、5.0、6.0、7.0h)后,分别取出测定上清液的体积,并计算预处理酵母细胞对茶多酚的吸附率,结果如图1所示。

图1 吸附时间对茶多酚吸附率的影响Fig.1 Effect of adsorption time on adsorption rate of tea polyphenols
由图1可知,预处理酵母细胞对茶多酚的吸附率均随着吸附时间的延长逐渐增大,吸附2h后吸附率增加较缓慢,当吸附4 h后,吸附基本达到平衡,此时,ACY、AY、AEY和AWGP对茶多酚的吸附率分别可达到64.7%、51.2%、55.5%和48.3%,故4h为较佳的吸附时间。
2.2.2 酵母细胞的加入量对吸附的影响
平行吸取10mL质量浓度为40mg/mL的茶多酚溶液9份,分别加入预处理酵母细胞ACY、AY、AEY和AWGP 0.20、0.40、0.60、0.80、1.00、1.50、2.00、2.50、3.00g,置于恒温振荡器中(110r/min,30℃),吸附4h,分别取出测定上清液的体积,并计算预处理酵母细胞对茶多酚的吸附率,结果如图2所示。

图2 酵母细胞加入量对茶多酚吸附率的影响Fig.2 Effect of yeast cell addition amount on adsorption rate of tea polyphenols
由图2可知,预处理酵母细胞对茶多酚的吸附率均随着酵母细胞用量的增加而不断增大,当ACY、AY、AEY用量均为2.00g后,茶多酚吸附率变化不大,吸附趋于饱和。但是,与这3种酵母细胞相比,AWGP更容易吸水膨胀,当其用量超过1.00g后,溶液呈泥状,无法振荡摇动。由实验可知,AWGP比其他3种酵母细胞更容易吸水膨胀,导致细胞很快吸水达到饱和。基于AWGP这种特点,将吸附前茶多酚溶液的体积扩大至30mL,吸附率随AWGP加入量的变化如图2所示。最初,茶多酚伴随水分子也较快进入AWGP中,与蛋白质结合,但是细胞中蛋白质含量较低,没有充足的结合位点供茶多酚络合,故其对茶多酚的吸附率较低,当AWGP加入量为2.00g后,茶多酚吸附率变化较小,吸附趋于饱和。因此,对于10mL质量浓度为40mg/mL的茶多酚溶液,ACY、AY、AEY用量均为2.00g时,吸附效果较佳;对于30mL质量浓度为40mg/mL的茶多酚溶液,AWGP用量为2.00g时,吸附效果较佳。
2.2.3 吸附温度对吸附的影响
平行吸取10mL质量分数为40mg/mL的茶多酚溶液4份,分别加入4种不同酵母细胞ACY、AY、AEY和AWGP 0.50g,分别置于恒温振荡器中(110r/min),使其在不同温度20、30、40、50℃吸附4h,分别取出测定上清液的体积,并计算预处理酵母细胞对茶多酚的吸附率,结果如图3所示。

图3 吸附温度对茶多酚吸附率的影响Fig.3 Effect of adsorption temperature on adsorption rate of tea polyphenols
由图3可知,随着温度的升高,AWGP对茶多酚的吸附率没有明显变化,而在40℃与50℃,其余3种酵母细胞对茶多酚的吸附率均较大,考虑到茶多酚在高温下容易被氧化,故在实际吸附过程中选择40℃为最佳吸附温度。
温度主要影响蛋白质-多酚之间的络合过程。这是因为温度的升高,会使蛋白质的结构更为松散,分子内的疏水性基团就会充分的暴露出来,更有利于多酚的羟基与之反应,所以更多的蛋白质与茶多酚参与了络合反应。由于AWGP中蛋白质的含量较其他3种酵母细胞要少得多,所以温度对其吸附能力的影响并不明显。
2.2.4 茶多酚溶液pH值对吸附的影响
平行吸取10mL质量分数为40mg/mL的茶多酚溶液5份,分别调节pH3.00、4.00、5.00、6.00、7.00,分别加入ACY 0.50g,置于恒温振荡器中(110r/min,30℃),吸附4h,分别取出测定上清液的体积,并计算预处理酵母细胞对茶多酚的吸附率。按上述方法重复测定AY、AEY和AWGP对茶多酚的吸附率。结果如图4所示。
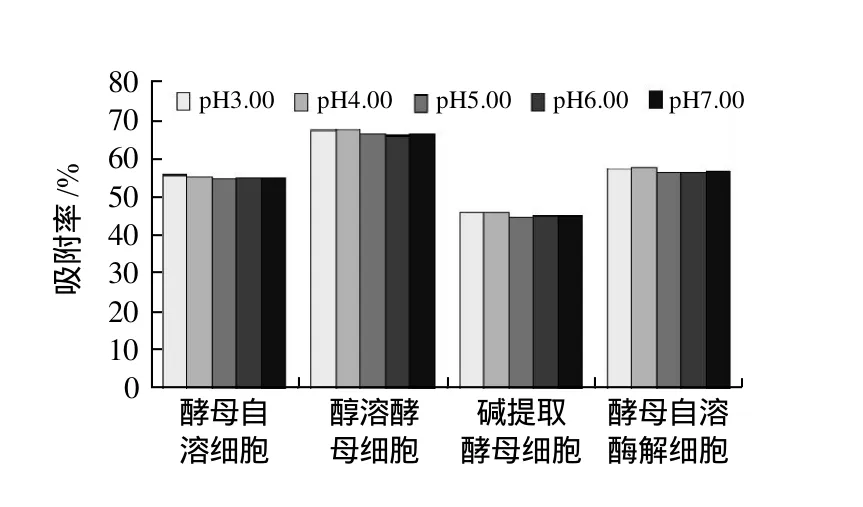
图4 茶多酚溶液pH值对茶多酚吸附率的影响Fig.4 Effect of tea polyphenol solution pH on adsorption rate of tea polyphenols
由图4可知,当pH5.00、6.00及7.00时,4种预处理酵母细胞对茶多酚的吸附率均较pH3.00和4.00小,并且茶多酚耐酸性较好,在pH≥4的环境中十分稳定,故选择pH4.00为最佳的吸附pH值。
反应体系的pH值对多酚和蛋白质的反应程度也有很大的影响[13-14]。每一种蛋白质都有其最适合的多酚络合位点,常常在等电点附近1个pH值的范围内络合出的多酚的量最多。这是由于在这个范围内,蛋白质的静电斥力最小,此时多酚-蛋白质之间交联的拉力大于蛋白质分子之间存在的斥力,从而蛋白质与多酚络合量最大。由图4可知,在pH3.00和4.00时,预处理酵母细胞对茶多酚的吸附均较大,这可能是因为酵母细胞中大多数蛋白质的等电点在pH3.00、4.00附近,故在此pH值附近有更多的蛋白质与茶多酚参与络合反应。
2.2.5 在较佳条件下预处理酵母细胞对茶多酚的吸附情况
平行吸取质量浓度为40mg/mL、pH4.00的茶多酚溶液10mL 3份,分别加入ACY、AY、AEY 2.00g及相同的茶多酚溶液30mL 1份,加入AWGP 2.00g,置于恒温振荡器(110r/min)40℃吸附4h。吸附率分别为ACY 98.1%、AEY 94.3%、AY 93.2%、AWGP 73.2%,单位平衡吸附量分别为ACY 319.8mg/g、AEY 307.4mg/g、AY 303.8mg/g、AWGP 238.5mg/g。可见,ACY吸附能力最强,AEY与AY吸附能力比较接近,AEY略高一些,AWGP吸附能力最弱,它更容易吸收溶液中的水分子。
预处理酵母细胞各成份含量的差别可能是导致它们对茶多酚吸附能力不同的主要原因之一,尤其是蛋白质含量的不同。多酚与蛋白质结合的主要形式为氢键或者是疏水键。多酚的大量酚羟基与蛋白质主链的肽基—NHCO,侧链上的—OH、—NH2以及—COOH以氢键的形式多点结合[13-14]。酵母细胞壁富含β-葡聚糖,β-葡聚糖含有丰富的—OH,也可通过氢键的作用吸附茶多酚,但是实验结果表明,它对吸附茶多酚的影响是极小的,这可能是因为β-葡聚糖以3股螺旋形式存在,3条多糖链平行排列并缠绕在一起,通过链间氢键而处于稳定状态,导致暴露在表面的—OH数目很少,故对吸附的影响极小。
酵母富含蛋白质,在酵母干细胞中,蛋白质的含量占据52.4%,细胞壁含蛋白质10%~15%,其余大部分都分布在细胞质内。由实验可知,酵母细胞蛋白质的含量在很大程度上影响其对茶多酚的吸附。如果茶多酚只是吸附在酵母细胞表面,而与细胞质内蛋白质的含量相比,细胞壁上的蛋白质不足以造成这么大的吸附差异。故可以判断茶多酚不仅吸附于细胞的表面,也吸入细胞内部。
2.3 预处理酵母细胞对茶多酚的吸附动力学探讨[15-16]
平行吸取10mL不同质量浓度的茶多酚溶液7份,分别加入等量的ACY、AY、AEY、AWGP,置于恒温振荡器中(110r/min),在40℃吸附6h,分别取出测定上清液的体积,并计算4种预处理酵母细胞对茶多酚的单位平衡吸附量Q。
本实验采用两种常用的吸附等温线Langmuir等温吸附方程q=qmC/(C+1/KL)和Freundlich等温吸附方程q=KFC1/n来对预处理酵母细胞对茶多酚的吸附动力学进行分析,其中q为平衡吸附量/(mg/g),qm为最大理论吸附量/(mg/g),C为茶多酚溶液的质量浓度/(g/L),KL为常数,KF为吸附容量,n为吸附强度。在Langmuir方程中,将C/q对C作图,得到一条直线,即可求出KL和qm的计算值。在Freundlich方程中,将lgq对lgC作图,得到一条直线,即可求出KF和n的计算值。结果如表2所示。
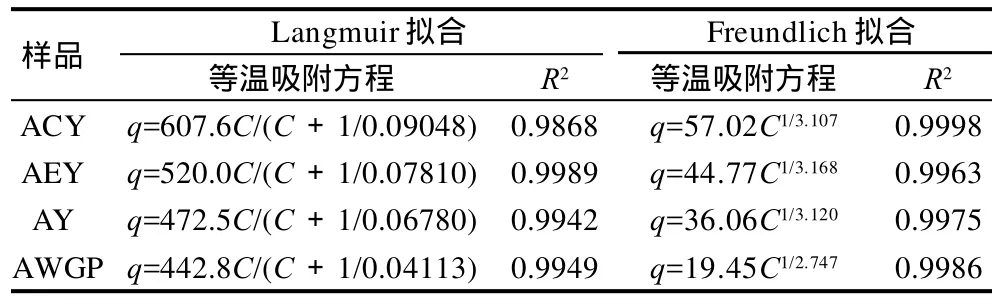
表2 预处理酵母细胞对茶多酚的Langmuir和Freundlich等温吸附方程Table 2 Langmuir and Freundlich adsorption isotherm equations of pre-treated yeast cells on the adsorption of tea polyphenols
由表2可知,Langmuir、Freundlich等温吸附线均可用来拟合预处理酵母细胞对茶多酚的等温吸附过程,由等温吸附方程计算出最大理论单位吸附量qm分别为ACY 607.6、AEY 520.0、AY 472.5、AWGP 442.8mg/g。Freundlich方程中常数KF表征预处理酵母细胞对茶多酚的吸附容量,ACY、AEY、AY、AWGP吸附容量依次降低,这与实验所得到的结果基本相似。式中常数n表征茶多酚溶液的质量浓度对酵母吸附作用的影响,n值越大,单位平衡吸附量Q随茶多酚质量浓度C的变化就越小,即说明在茶多酚溶液质量浓度较低的情况下,酵母细胞就能对茶多酚有较强的吸附作用。AWGP吸附强度较低,其他3种酵母细胞的吸附强度差别不大,这表明与AWGP相比,在较低质量浓度的茶多酚溶液中,其他3种酵母细胞对茶多酚有较好的吸附作用。
由已知的Langmuir、Freundlich等温吸附方程可以算出在不同质量浓度的茶多酚溶液中酵母细胞对茶多酚的理论单位平衡吸附量,与实验所得的单位平衡吸附量相比较,结果如图5所示。

图5 预处理酵母细胞吸附茶多酚的等温吸附曲线Fig.5 Langmuir and Freundlich isotherm curves of pre-treated yeast cells on the absorption of tea polyphenols
由图5可知,由预处理酵母细胞的Langmuir、Freundlich方程得到的等温吸附曲线与实验所得的曲线十分相似,说明酵母细胞对茶多酚的吸附能很好地符合Langmuir和Fre undlich等温吸附式。两者比较,Freundlich等温吸附方程得到的理论曲线与实验所得的曲线有更好的重合度,并且表2也说明同样的问题,与Langmuir等温式相比,采用Freundlich等温式拟合预处理酵母细胞对茶多酚的等温吸附过程能得到更高的回归系数R2。故Freundlich等温吸附式比Langmuir等温吸附式能更好地拟合预处理酵母细胞的等温吸附过程。
2.4 吸附前后茶多酚抗氧化作用的检测
准备6份新鲜制备的猪油(未加任何抗氧化剂),一份为空白实验组,一份加入一定量的茶多酚,另外4份分别加入吸附茶多酚的预处理酵母细胞ACY、AY、AEY、AWGP,细胞加入量须保证与直接加入茶多酚的油样中茶多酚含量相当,经计算加入量分别为ACY 312.7mg、AEY 325.3mg、AY 329.2mg、AWGP 419.3mg、TP 0.10g。本实验采用烘箱加热法在37.5℃的条件下进行加速氧化,每3d测定6份油样的过氧化值和酸价。
2.4.1 过氧化值(POV)
在加速氧化过程中,过氧化物大量形成,而抗氧化剂正是通过抑制过氧化物的形成或者与其结合阻断连锁反应来延缓氧化的目的。6份猪油过氧化值的变化如表3所示。
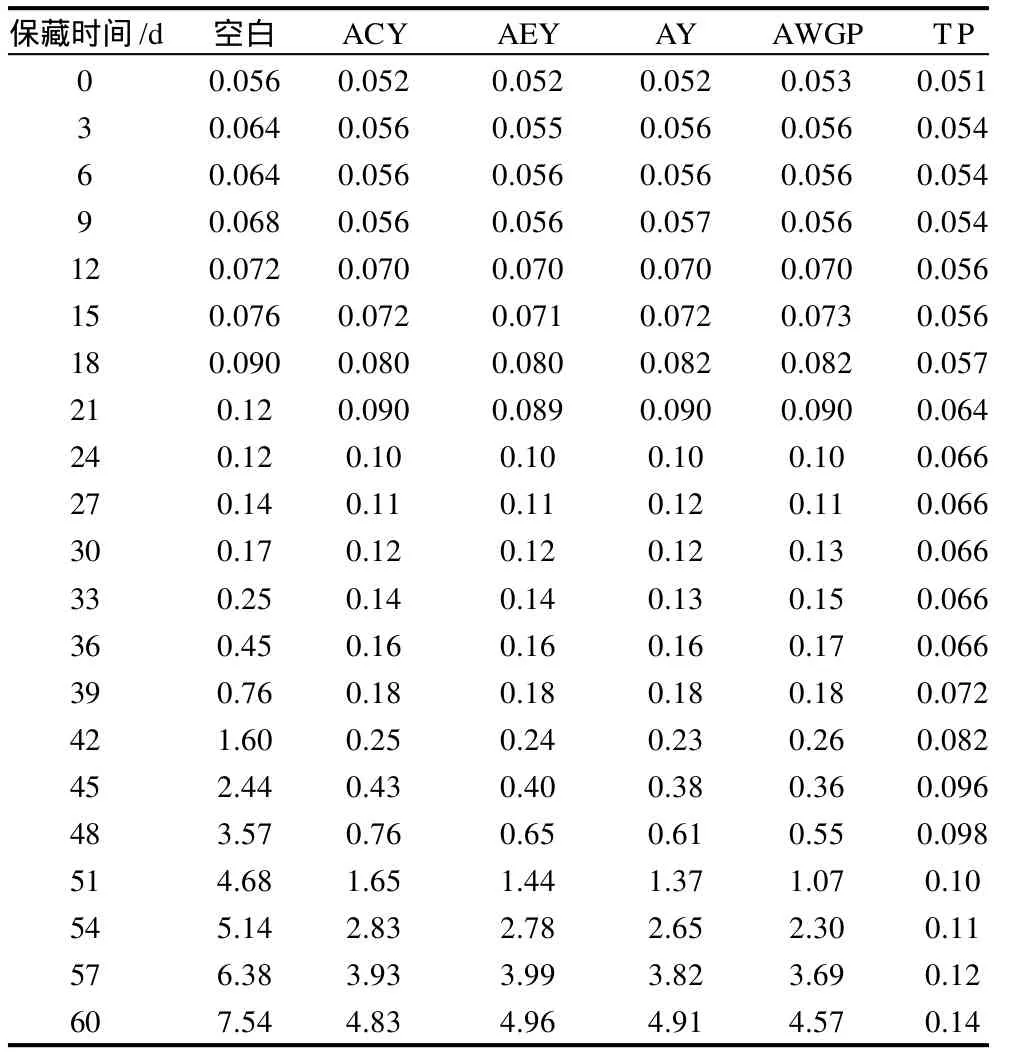
表3 猪油过氧化值的变化Table 3 Change in POV value of lard g/100g
由表3可知,TP组油样的POV值与其他组相比很小,时间越长数值差距越大。虽然茶多酚吸附于4种酵母细胞后其抗氧化效果不如直接添加茶多酚的效果好,但是与空白组相比,前期虽然没有明显的差异,但是30d后,空白组的POV值比其余4组明显增大,相差的比例也随时间越来越大,到54d后这种差异开始缩小。30d后抗氧化效果之间的明显差异可以说明酵母细胞在一定程度上能发挥微胶囊的作用,茶多酚在酵母细胞内稳定存在,并在一定时间内被缓慢释放出来,故后期的抗氧化作用比前期的强。
2.4.2 酸价(AV)
酸价是油脂中游离脂肪酸的含量,可以从一个方面来表示油脂发生酸败的程度。酸价主要来自于油脂水解产生的游离脂肪酸,但还包括油脂体系中存在的其他酸性物质,它衡量的是油脂体系的总酸。6份猪油酸价的变化如表4所示。
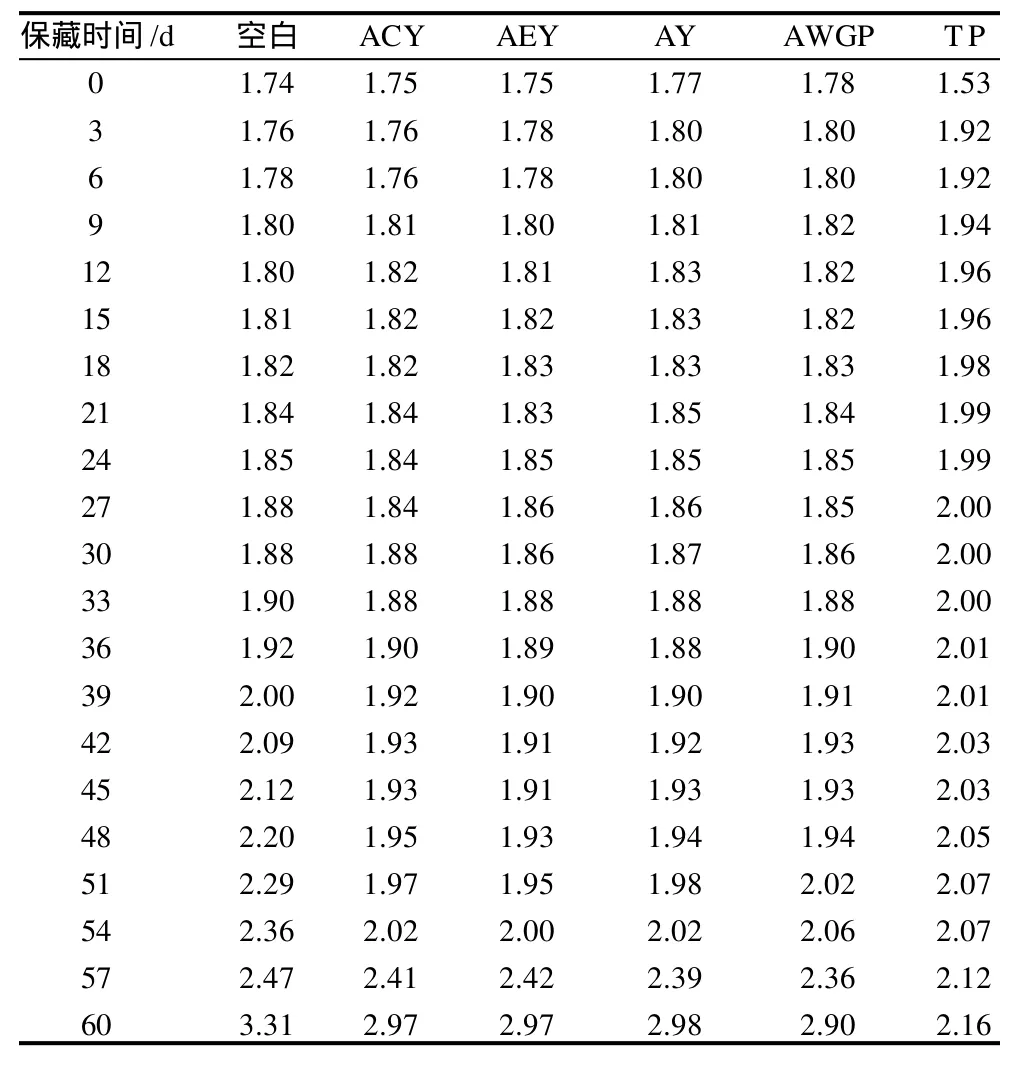
表4 酸价的变化Table 4 Change in acid value mg KOH/g
由表4可知,各样品起始酸价差异除TP组较小以外,其余没有明显的差异。在加速氧化实验过程中,AV值的增幅很小,不如POV值的变化敏感。因此,酸价的测定并不适宜用来评价样品的抗氧化活性。与此相比,POV值的测定可以客观精确的评价茶多酚在各样品中的抗氧化效果。
3 结 论
3.1 预处理酵母细胞对茶多酚的吸附能力有所不同。在10mL质量浓度为40mg/mL的茶多酚溶液中4种预处理酵母细胞较佳的吸附条件分别为吸附时间4 h、吸附pH4.00、吸附温度40℃及ACY、AEY、AY、AWGP添加量均为2.00g(此时AWGP对应的茶多酚溶液的体积为30mL),在较佳条件下吸附率可达到ACY 98.1%、AEY 94.3%、AY 93.2%、AWGP 73.2%,单位吸附量为ACY 319.8mg/g、AEY 307.4mg/g、AY 303.8mg/g、AWGP 238.5mg/g。
3.2 预处理酵母细胞对茶多酚的吸附动力学均符合Langmuir等温吸附式和Freundlich等温吸附式,相比之下,Freundlich等温吸附式能更好的拟合预处理酵母细胞的等温吸附过程。实验结果表明,预处理酵母细胞对茶多酚的吸附容量情况为ACY>AEY>AY>AWGP,并且与AWGP相比,在较低质量浓度的茶多酚溶液中,其他3种酵母细胞对茶多酚有较好的吸附作用。
3.3 预处理酵母细胞中各成分含量可能影响细胞对茶多酚的吸附能力,实验结果表明,蛋白质可能是最主要的影响因素。由于蛋白质在酵母细胞中的分布,可以说明茶多酚不仅吸附于细胞表面,也进入细胞内部。
3.4 由抗氧化实验可知,酵母细胞在一定程度上能发挥微胶囊的作用,茶多酚在酵母细胞内稳定存在,并在一定时间内被缓慢释放出来,在外界环境中发挥其抗氧化作用。
[1] 孙峰. 啤酒酵母废菌吸附处理含铜废水的实验研究[J]. 科学技术与工程, 2009, 9(3): 773-776.
[2] 陈灿, 周芸, 胡翔, 等. 啤酒酵母对废水中Cu2+的生物吸附特性[J].清华大学学报: 自然科学版, 2008(12): 2093-2095.
[3] PRADELLE R, VICHI M, ALEXANDRE N, et al. Influence of the drying processes of yeasts on their volatile phenol sorption capacity in model wine[J]. International Journal of Food Microbiology, 2009, 135(2): 152-157.
[4] KOGAN G. (1-3,1-6)-β-D-glucans of yeasts and fungi and their biological activity[J]. Studies in Natural Products Chemistry, 2000, 23(2):107-152.
[5] 罗志敏, 薛丽群, 张婷. 珠状壳聚糖树脂对绿茶中茶多酚的吸附研究[J]. 食品科学, 2009, 30(1): 86-89.
[6] INOUE C, ISHIGURO M, ISHIWAKI N. Process for preparation of microcapsules: European Patent, 0453316B1[P]. [1991-10-17].
[7] NORMAND V, DARDELLE G, BOUQUERAND P E. Flavor encapsulation in yeast:limonene used as a model system for characterization of the release mechanism[J]. Food Chemistry, 2005, 53(3): 7532-7543.
[8] DARDELLE G, NORMAND V,STEENHOUDT M, et al. Flavor-encapsulation and flavour-release performances of a commercial yeast-based delivery system[J]. Food Hydrocolloids, 2007, 53(1): 953-960.
[9] 黄国宏, 李科德, 曾庆孝. 酵母β-1,3-葡聚糖研究进展[J]. 酿酒科技, 2006(12): 100-103.
[10] 刘红芝, 王强, 周素梅, 等. 酵母β-葡聚糖的功能活性及其分离提取研究进展[J]. 食品科学, 2006, 27(11): 552-556.
[11] 唐治玉, 王淮, 熊善柏. 自溶-酶-碱法提取啤酒酵母中β-1,3-葡聚糖的工艺研究[J]. 现代食品科技, 2006, 22(2): 28-30.
[12] 王淼. 酵母免疫活性葡聚糖的研究与开发[D]. 无锡: 无锡轻工大学,1997.
[13] 黄惠华, 王志, 陈建新. 多酚-蛋白质络合反应的影响因素研究[J].食品科学, 2003, 24(2): 22-25.
[14] 覃思, 吴卫国, 刘焱, 等. 茶多酚与蛋白质的相互作用对蛋白质功能特性的影响研究进展[J]. 食品工业科技, 2006(6): 310-314.
[15] HO Y S. Removal of copper ions from aqueous solution by tree fern[J].Wster Research, 2003, 37(4): 2323-2330.
[16] GIMBERT F, MORIN-CRINI N, RENAULT F, et al. Adsorption isotherm models for dye removal by cationized starch-based material in a single component system:Error analysis[J]. Journal of Hazardous Materials,2008, 157(1): 34-46.
[17] BISHOP J R P, NELSON G, LAMB J. Microencapsulation in yeast cells[J]. Journal of Microencapsulation, 2009, 62(6): 761-773.
Effect of Different Pretreatment Methods on Adsorption Capability of Yeast Cells towards Tea Polyphenols
LIU Yin1,WANG Miao1,2,*
(1. School of Food Science and Technology, Jiangnan University, Wuxi 214122, China;2. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Microencapsulation is an effective method to protect biologically active materials from the damage by environmental factors. Yeast cells are natural and edible microencapsules. In the present study, yeast cells were pre-treated by alcohol, 3%sodium chloride, alkaline protease and sodium hydroxide to obtain ACY, AEY, AY and AWGP, respectively. The treated yeast cells were used to adsorb tea polyphenols in aqueous solution. The results indicated that the absorption rates of tea polyphenols in 4 kinds of pre-treated yeast cells such as ACY, AEY, AY and AWGP with the addition of 2.00 g tea polyphenols were 98.1%,94.3%, 93.2%, and 73.2% under the conditions with absorption time of 4 h, absorption temperature of 40℃, and tea polyphenol solution at pH 4.0. The adsorption capacities of ACY, AEY, AY and AWGP on tea polyphenols were 319.8, 307.4, 303.8 mg/g and 238.5 mg/g, respectively. Adsorption kinetics analysis showed that four kinds of pre-treated yeast cells were in accordance with Langmuir and Freundlich isotherm models. Antioxidant experiments confirmed that yeast cells could function as the role of microencapsules.
yeast cells;tea polyphenols;adsorption;microencapsules
TS201.3
A
1002-6630(2011)06-0038-07
2010-06-11
“十一五”国家科技支撑计划重点项目(2006BAD27B03)
刘寅(1986—),女,硕士研究生,研究方向为食品生物技术。E-mail:lyivy@126.com
*通信作者:王淼(1962—),女,教授,博士,研究方向为食品生物技术。E-mail:mwang@jiangnan.edu.cn

