利用衍生化试剂D T N B测定枸杞中谷胱甘肽
朱亚玲,张小勇,崔胜云*
(延边大学 长白山生物资源与功能分子教育部重点实验室, 吉林 延吉 133002)
利用衍生化试剂D T N B测定枸杞中谷胱甘肽
朱亚玲,张小勇,崔胜云*
(延边大学 长白山生物资源与功能分子教育部重点实验室, 吉林 延吉 133002)
利用5,5'-二硫硝基苯甲酸(DTNB)衍生化试剂和植物材料同步破壁提取的样品处理方法,采用电喷雾质谱法和分光光度法对枸杞中还原型谷胱甘肽(GSH)进行定性、定量分析。枸杞样品提取过程中GSH受破壁后胞外化学环境的影响导致氧化变性。利用5,5'-二硫硝基苯甲酸(DTNB)衍生化试剂同步提取,因生成稳定的GSH的衍生化产物避免了GSH氧化变性导致的GSH分析信息丢失。用 UV-Vis 分光光度法测定GSH含量,发现枸杞中含有丰富的GSH。标准加入法测定枸杞干品中GSH,其含量范围达(6.56±0.54)mg/g,是目前所测植物样品中GSH含量较高的物种。本研究对药用植物胞内活性物质的准确分析提供方法学的尝试,并通过测定发现枸杞中富含GSH。
谷胱甘肽;5,5'-二硫硝基苯甲酸;枸杞;分光光度法;质谱分析法;同步衍生化
谷胱甘肽(glutathione,GSH)是生物细胞内具有较高浓度分布、含有半胱氨酸残基的具有重要生物活性的三肽。由于谷胱甘肽的氧化型和还原型所组成电对的条件电位为-0.250V(vs.SHE),说明GSH的巯基具有还原性[1-3]。因此,GSH只在细胞内特定的氧化还原氛围中稳定存在并发挥其生物学功能。目前生物样品中GSH的测定方法包括分光光度法[4-5]、谷胱甘肽还原酶循环法[6]、荧光分析法[7-9]、电化学分析方法[10-13]、色谱分析法[14-15]、毛细管电泳分析[16]、色谱-质谱联用分析[17]等。上述方法的样品处理过程大多是先对样品破壁提取后进行测定。这种处理方法导致生物样品破壁之后,胞内的GSH受破壁后复杂的化学环境加上空气等影响使其氧化变性或分解,给准确分析GSH带来困难。这也是目前许多具有重要生物活性的药用植物都缺少GSH含量分析数据的原因之一。
本研究改进通常的植物样品前处理模式,利用含巯基衍生化试剂 DTNB的溶剂,采用衍生化和植物细胞破壁提取为一体的样品处理操作。其目的是利用同步衍生化反应生成稳定的GSH衍生化产物来避免细胞破壁之后巯基受胞外其他化学环境影响导致的变性所带来的准确分析GSH的困难。由于本操作中胞内的GSH在破壁的同时立刻与衍生化试剂生成稳定的衍生化产物,可通过光度法和质谱测定衍生化产物得到准确、完整的植物样品中GSH的定量及定性信息。本研究为准确分析植物样品中GSH含量提供了可靠的分析手段,这对富含GSH的药用植物的筛选、GSH在药用植物中的活性地位的评价等研究具有重要的实际意义。
1 材料与方法
1.1 材料、试剂与仪器
宁夏产枸杞为市售的枸杞干品。还原型谷胱甘肽(99.0%)、5,5'-二硫硝基苯甲酸(DTNB)(沃凯试剂99.0%)国药集团化学试剂有限公司;其他试剂均为分析纯。
UV-2500PC紫外分光光度仪 日本岛津公司; pHS-3C型实验室酸度计 上海洛奇特电子设备有限公司;HP1100-1946A LC-MS液-质联用仪;DC-3006低温恒温槽;80-2离心沉淀器;SG2200HE超声波清洗器。
1.2 方法
1.2.1 植物材料的前处理和提取液的制备
将枸杞干品用蒸馏水淋洗、低温烘干去掉水分。将枸杞干品用粉碎机粉碎至粗粉状。取0.25g枸杞干粉,加入25mL含有一定浓度衍生化试剂(DTNB)的0.02mol/L PBS缓冲液(pH7)作为提取液,超声振荡破壁30min,离心,取上清液备用。取10mL上清液,加入2倍体积的乙醇,放置30min,然后在转速5000r/min离心8min除蛋白。取离心后上清液,浓缩至10mL,用碱液调节酸度至中性(pH7.00)得光谱测定供试品溶液。供质谱测定的植物材料提取液用蒸馏水代替PBS缓冲液,其他操作同上。
1.2.2 分析方法
GSH的定量分析是基于DTNB在pH7溶液中与巯基反应,生成3-羧基-4-硝基苯硫酚,其离子呈黄色且在波长412nm处有强烈的吸收峰(本实验中在波长409nm处具有强吸收)。该吸收峰在过量的DTNB溶液中最大吸收波长处的吸收强度与加入的GSH浓度呈良好的线性关系。分别采用标准加入法和标准曲线法测定GSH含量。
枸杞提取液中GSH定性分析是采用液质联用仪质谱端口进样方法,通过检测DTNB和GSH衍生化产物在m/z198和m/z503的特征分子离子峰来判断GSH存在。质谱测定条件为:离子源:ESI;碰撞电压:70eV;干燥气:N2;干燥气流量:4L/min;干燥气温度:350℃;雾化器压力:55psi;毛细管电压:-3500V。
2 结果与分析
2.1 DTNB与GSH 混合溶液的光谱、质谱测定
为了便于对实际样品中 GSH 的定性和衍生化反应机理的探讨,分别对一定浓度的DTNB和该溶液中加入GSH后的混合溶液进行UV-Vis光谱和电喷雾质谱测定,结果见图1。

图1 DTNB、GSH及两者混合溶液的UV-Vis吸收光谱和电喷雾质谱图(负离子模式)Fig.1 UV-visible and ESI-MS spectra (negative mode) of DTNB, GSH and mixture solution
图 1A 表明:DTNB在λmax=323nm 处出现强吸收峰,而在GSH和DTNB的浓度比为2:1的混合溶液中,由于衍生化作用使得DTNB在λmax=323nm处的吸收峰消失并在λmax=409nm处生成衍生化产物的新吸收峰。这一结果与文献[18]报道相似,只是本实验条件下衍生化产物吸收波长略微不同(文献[18]值为λmax=420nm),说明GSH和DTNB衍生化作用产物,3-羧基-4-硝基苯硫酚在可见区有强吸收。图1B、1D分别为DTNB、GSH和两者混合溶液的电喷雾质谱图。DTNB和GSH分别在m/z395和m/z306处出现灵敏的脱质子分子离子峰,而在两者混合溶液中尽管在m/z395处仍能观察到DTNB的脱质子分子离子峰,但m/z306处的GSH的脱质子分子离子峰完全消失,同时在m/z198和m/z503处分别出现GSH与DTNB的作用产物的脱质子分子离子峰。根据上述光谱和质谱测定结果推知,GSH与 DTNB作用生成如图2所示的衍生化产物。

图2 GSH与DTNB的作用产物Fig.2 Reaction products between GSH and DTNB
据文献[19]报道,m/z198处的作用产物3-羧基-4-硝基苯硫酚在溶液中具有如图3所示的负离子态的共振结构,故在可见区具有较强的吸收光谱。因此,通过DTNB和巯基化合物的衍生化反应定量生成3-羧基-4-硝基苯硫酚的显色反应,可利用UV-Vis分光光度法测定GSH的含量。
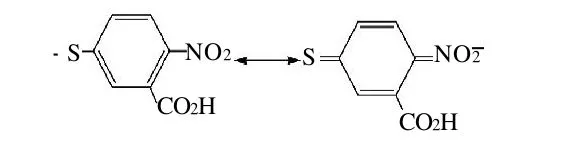
图3 4-硝基苯硫酚化合物的共振结构Fig.3 Resonance structure of 4-nitrophenyl phenolic sulfur compound
2.2 枸杞提取液中GSH的定性分析
基于DTNB 衍生化试剂的分光光度法测定GSH是根据巯基对DTNB中二硫键的还原作用生成3-羧基-4-硝基苯硫酚的显色反应。但这一方法对样品中GSH没有专一性,样品中其他巯基化合物对测定有干扰[11],故有必要对样品中待测含巯基化合物骨架进行定性分析。根据图1、2结果可知,GSH与DTNB作用后,除了显色物质3-羧基-4-硝基苯硫酚外也生成GSH巯基与DTNB的二硫键通过氧化还原反应生成的二硫键的交换反应产物。因此,通过质谱测定该交换反应产物(对GSH来说在m/z503的质谱峰)可准确地对样品中的含巯基化合物的分子骨架进行定性。
为了探讨枸杞中GSH含量信息和胞外化学环境对植物样品中GSH的测定影响,采用如下两种样品处理方法获取枸杞干品提取液并对其分别进行质谱和光谱测定。1)利用含有DTNB衍生化试剂的溶剂作为提取液,采用衍生化和超声破壁同步进行的方法获取提取液;2)先用溶剂超声破壁提取,然后往提取液中加入衍生化试剂。图4为不同样品处理方法得到的枸杞提取液的质谱测定结果。

图4 采用不同提取模式枸杞提取液的电喷雾质谱图(负离子模式)Fig.4 ESI-MS spectra of the extracts fromLycium barbarumL fruits obtained by different extraction methods
如图4A所示,采用处理方法2得到的枸杞提取液在m/z 306处观察不到GSH的脱质子分子离子峰。当该提取液中加入DTNB时(图4B),在m/z198处观察到DTNB的还原产物3-羧基-4-硝基苯硫酚的分子离子峰,但观察不到m/z503处GSH与3-羧基-4-硝基苯硫酚生成的二硫键交换反应产物的分子离子,说明提取液中可能不含有完整的GSH分子形态的组分。比较图4A、4B结果发现,枸杞提取液在m/z337处出现丰度较高的质谱峰,当加入DTNB时,该峰几近消失,同时在m/z198和m/z278处分别出现DTNB被还原成3-羧基-4-硝基-苯硫酚的脱质子分子离子峰和DTNB的二硫键中一个硫原子被磺酸化的产物脱质子分子离子峰。根据氮规则和相对分子质量推断为GSH的巯基被氧化成亚磺酰胺的产物,其结构见图4B。由此可推断:枸杞提取液中m/z337的质谱峰所对应的物质是样品处理过程中GSH的半氧化变性产物,该产物可能也对DTNB的二硫键具有一定的氧化作用,生成显色物质3-羧基-4-硝基-苯硫酚。图4C为含有DTNB的溶剂同步提取液的质谱图,从图4C可知除了m/z198处出现3-羧基-4-硝基硫酚的分子离子峰之外,在m/z503处也可观察到GSH的巯基与DTNB的二硫键交换反应产物的脱质子分子离子峰,说明枸杞提取液中初始含有完整的GSH分子形态。

图5 采用不同提取模式的枸杞提取液的UV-Vis吸收光谱图Fig.5 UV-visible spectra of extracts ofLycium barbarumL fruits obtained by different extraction methods
图5 为方法1和方法2两种处理方法得到的枸杞提取液的UV-Vis吸收光谱图。结果表明,方法1得到的枸杞提取液[图5(1)]在λmax=409nm处的吸收光谱的强度明显大于方法2得到的枸杞提取液的吸收光谱强度,说明同步提取有利于胞内GSH在破壁的同时立刻与DTNB作用生成衍生化显色产物。
从上述讨论中可推断:植物细胞破壁和DTNB衍生化同步进行的提取方法中,因细胞破壁的同时DTNB与胞内GSH立刻生成相对稳定的衍生化产物,故切断了GSH破壁后的氧化修饰或变性。因此,通过对生成的稳定衍生化产物的光谱或质谱测定可得到完整的GSH的分析信息。若采用先破壁后衍生化的提取方法,因只在胞内特定氧化还原氛围中稳定的GSH在破壁后的新的化学环境中(其中包括各种细胞器内的酶等物质)易发生氧化修饰或其他的分解反应,故得不到完整的GSH分析信息。
2.3 分光光度法定量测定枸杞中的GSH
2.3.1 GSH 浓度与显色物吸光度的线性范围
为了考察G S H的浓度和衍生化显色物质在λmax=409nm处的吸光度的线性范围,分别在一定浓度的DTNB溶液中依次加入不同浓度比的GSH标准溶液并测得UV-Vis吸收光谱,结果见图6。

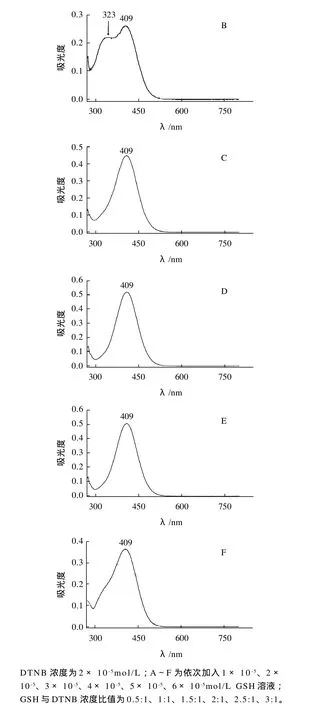
图6 DTNB溶液中加入不同浓度GSH溶液后测得的UV-Viss吸收光谱图Fig.6 UV-visible spectra of different amounts of GSH in DTNB solution
图6 表明,当恒定DTNB浓度为一定时(2×10-5mol/L),随着加入GSH浓度的增加,λmax=409nm处的吸光度在GSH和衍生化试剂DTNB浓度比小于2时,吸光度与GSH浓度呈良好的线性关系,线性回归方程为A409=0.0044+0.12565C,相关系数r=0.9975,当GSH与DTNB浓度比超过2时,λmax=409nm处的吸光度反而降低。加入的GSH浓度和λmax=409nm处的吸光度关系曲线见图7。

图7 波长409nm处的吸光度与GSH浓度间的校正曲线Fig.7 Calibration curve between absorbance at 409 nm and GSH concentration
由图7可知,GSH与衍生化产物在λmax=409nm处的吸光度在GSH和DTNB浓度比小于或等于2时呈良好的线性关系。而当其浓度比大于2时,过量的GSH与前期作用产物3-羧基-4-硝基苯硫酚之间发生明显的相互作用导致后者的吸光度降低。这可能是由于GSH与DTNB的作用是两步反应(图8)。

图8 GSH和DTNB的反应机理Fig.8 Reaction mechanism between GSH and DTNB
如图8所示,第一步反应中两分子GSH与一分子DTNB 反应生成两分子的衍生化产物(Ⅰ),然后该产物再与两分子GSH作用生成两分子2,3-羧基-4-硝基苯硫酚(Ⅱ)和两分子氧化型谷胱甘肽(GSSG)[18]。由于GSH和吸光产物(Ⅱ)的反应计量关系为2:1,故在一定浓度的DTNB溶液中,当GSH和DTNB浓度比小于2时,显色产物(Ⅱ)的量随GSH的浓度的增加而线性增加。而当GSH和DTNB的浓度比大于2时,由于过量的GSH和显色产物(Ⅱ)的巯基相互作用生成在可见区无吸收的产物(Ⅰ),从而导致可见光区(λmax=409nm) 的吸光度反而减小(图 7)。
2.3.2 枸杞中GSH含量的测定
分别采用改进的提取方法对枸杞提取液采用标准曲线法和标准加入法分别测定了枸杞中的GSH含量,并与采用荧光法测定结果进行比较。

图9 枸杞提取液及其加入GSH标准溶液测得的UV-Vis吸收光谱图Fig.9 UV-visible spectra ofLycium barbarumL extract with extra amount of DTNB and GSH standard solution at various concentrations
如图9所示,含有DTNB的枸杞提取液在λmax=409nm处具有明显的吸收,说明提取液中含有GSH。当该提取液中加入GSH标准溶液时,λmax=409nm处的吸光度随加入的GSH的浓度呈线性增加,加入法的线性校正曲线见图10。
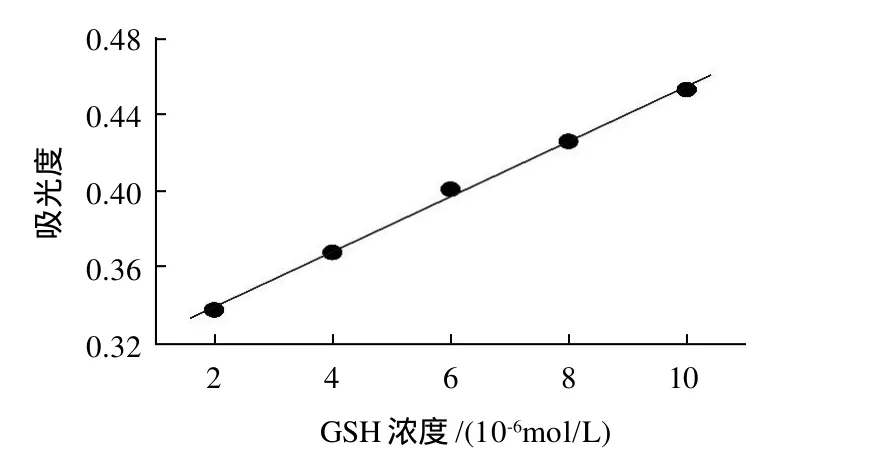
图10 标准加入法校正曲线Fig.10 Calibration curve for standard addition method
图10 表明,利用含DTNB溶剂的枸杞提取液溶液在λmax=409nm处的吸光度随加入的GSH的浓度呈良好的线性关系,其线性回归方程为A=0.3091+0.0150C,相关系数r=0.9983。利用衍生化产物在λmax=409nm吸光度与GSH浓度的线性关系分别用标准曲线法和标准加入法测定了枸杞中GSH含量并与采用文献[8-9]所提及的荧光光谱测定结果进行对照,结果见表1。

表1 枸杞中GSH含量分析结果(n=5)Table 1 GSH determination results inLycium barbarumL fruits (n=5)
从表1可知,标准加入法测定枸杞中GSH含量范围在(6.56±0.54)mg/g、标准曲线法测定其含量范围为(7.37±0.62)mg/g,两者结果与荧光光谱法测定结果(6.72±0.62)mg/g基本吻合。
3 结 论
3.1 利用DTNB衍生化试剂同步提取植物细胞内的GSH方法,采用分光光度法成功测定了枸杞样品中GSH含量。通过与刺五加、五味子等其他植物比较筛选后发现枸杞样品含有较高的GSH含量,标准加入法测定其干品含量范围达(6.56±0.54)mg/g,是目前所报道植物[20-21]中GSH含量最高的一种药用植物。
3.2 DTNB衍生化法测定植物样品中GSH与样品前处理过程具有至关重要的关系。质谱测定结果表明,由于GSH只在细胞内特定的氧化还原氛围中稳定存在,当细胞破壁时会受到胞外化学环境的影响导致氧化变性,从而导致无法准确测定其含量,甚至导致漏检。
3.3 采用DTNB同步提取的植物样品前处理方法使胞内的GSH在破壁瞬间与衍生化试剂生成稳定的衍生化显色产物。因此,通过光谱测定可获得胞内完整、准确的GSH的含量信息。本研究对富含GSH植物种的筛选、植物生理、GSH在药用植物中的地位研究提供方法学上的可靠依据。
[1] JACOB C, GILES G I, GILES N M, et al. Sulfur and selenium: the role of oxidation state in protein structure and function[J]. Angewandte Chemie Int Ed, 2003, 42(39): 4742-4758.
[2] CUI Shengyun, JIN Hua, KIM S J, et al. Interaction of glutathione and sodium selenitein vitroinvestigated by electrospray ionization tandem mass spectrometry[J]. J Biochem, 2008,143(5): 685-693.
[3] 金春英, 崔京兰, 崔胜云. 氧化型谷胱甘肽对还原性谷胱甘肽清除自由基的协同作用[J]. 分析化学, 2009, 37(9): 1349-1353.
[4] ELLMAN G L. Tissue sulfhydryl group[J]. Arch Biochem Biophys,1959, 82(1): 70-77.
[5] 李丽娜, 李军生, 阎柳娟. 分光光度法测定食品蛋白中的二硫键的含量[J]. 食品科学, 2008, 29(8): 562-564.
[6] TEIZE F. Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione[J].Anal Biochem, 1969, 27(3): 502-522.
[7] COHN V H, LYLE J. A fluorometric assay for glutathione[J]. Anal Biochem, 1966, 14(3): 434-440.
[8] PAUL J H, RUSELL H. A fluorometric method for determination of oxidized glutathione and reduced glutathione in tissue[J]. Analytical Biochemistry, 1976, 74(1): 224-226.
[9] 王秋林, 王浩毅, 丁怡, 等. 血浆中游离还原型及氧化型谷胱甘肽的荧光测定法[J]. 光谱学与光谱分析, 2005, 25(11): 1834-1838.
[10] EDEN J P, MCCARLEY R B, WANG Weihua, et al. Electrochemical detection of glutathione using redox indicator[J]. Anal Chem, 2006, 78(21): 7577-7588.
[11] WHITE P C, LAWRENCE N S, DAVIS J, et al. Electrochemical determination of thiols: a perspective[J]. Electroanalysis, 2002, 14(2):89-98.
[12] MATTEO S, NATHAN S L, ALESSANDRA A, et al. Electrochemical reduction of Ellman's reagents: a novel selective detection protocal for thiol compounds[J]. Electroanalysis, 2007, 19(23): 2437-2443.
[13] JAN V, JIRI P, RENE K, et al. Electrochemical determination of lead and glutathione in a plant cell culture[J]. Bioelectrochemistry, 2004, 63(1/2): 347-351.
[14] LEROY P, NICOLAS A. Rapid liquid chromatographic assay of glutathione in cultured cells[J]. Biomedical Chromatography, 1993(7): 86-89.
[15] LI W, BOLLECKER S S, SCHOLFIED J D. Glutathione and related compounds. I. Glutathone and ralated thiol compounds in flour[J]. Journal of Cereal Science, 2004, 39(2): 205-212.
[16] WANG W, XIN H, SHAO H L. Determination of glutathone in single human hepatocarcinoma cells by capillary electrophoresis with electrochemical detection[J]. Journal of Chromatography B, 2003, 789: 425-429.
[17] CAMERA E, RINALDI M, BRIFANTI S, et al. Simultaneous determination of reduced and oxidized glutathione in peripheral blood mononuclear by liquid chromatography-electrospray mass sepctrometry[J].Journal of Chromatography, 2001, 757(1/5): 69-78.
[18] 范崇东, 王淼, 卫功元, 等. 谷胱甘肽测定方法研究进展[J]. 生物技术, 2004, 14(1): 68-70.
[19] BROCKLEHURST K, LITTLE G. Reactivities of the various protonic states in the reactions of papain and of L-cysteine with 2,2'- and with 4,4'- dipyridyl disulphide: evidence for nucleophilic reactivity in the unionized thiol group of the cysteine-25 residue of papain occasioned by its interaction with the histidine-159-asparagine-175 hydrogen-bonded system[J]. Biochem, 1972, 128(2): 471-474.
[20] RUBEN R A, LUIS E H, JAVIER A, et al. Direct and simultaneous determination of reduced and oxidized glutathion and homoglutahione by liquid chromatography-electrospray/mass spectrometry in plant tissue extracts[J]. Anal Biochem, 2006, 356(2): 254-264.
[21] 郑建仙. 功能性食品[S]. 北京: 中国轻工业出版社, 1999: 348.
Determination of GSH inLycium barbarumL Fruits by Derivatizing Agent
ZHU Ya-ling,ZHANG Xiao-yong,CUI Sheng-yun*
(Key Laboratory of Natural Resources of Changbai Mountain & Functional Molecules,Ministry of Education,Yanbian University, Yanji 133002, China)
The content of reduced glutathione (GSH) inLycium barbarumL fruits was determined by mass spectroscopy and UV-visible spectroscopy using 5,5'-dithio-bis-nitrobenzoic acid (DTNB) as the simultaneous derivatizing agent. GSH inLycium barbarumL fruits was significantly affected by extracellular chemical environment during sample treatment. Extraction with DTNB as the simultaneous derivatizing agent inhibited the transformation or decomposition of GSH due to immediate derivatization during sample treatment. Quantitative determination results indicated thatLycium barbarumL fruits contained GSH in the range of (6.56±0.54) mg/g, which was one of the most GSH-abundant plant species.
glutathione;5,5 '-dithio-bis-nitrobenzoic acid (DTNB);Lycium barbarumL;mass spectroscopy;simultaneous derivatization
O657
A
1002-6630(2011)06-0250-06
2010-06-03
朱亚玲(1984—),女,硕士,研究方向为有机分析。E-mail:136584711@qq.com
*通信作者:崔胜云(1957—),男,教授,博士,研究方向为有机分析。E-mail:sycui820@yahoo.com.cn

