新疆早熟棉品种SSR分子标记体系的建立
薛艳,李保成,张新宇,沙红,孙杰
(1石河子大学农学院/新疆兵团绿洲生态农业重点实验室,石河子832003;2新疆农垦科学院,石河子,832003;3新疆农业科学院经济作物研究所,乌鲁木齐830052)
新疆早熟棉品种SSR分子标记体系的建立
薛艳1,李保成2,张新宇1,沙红3,孙杰1
(1石河子大学农学院/新疆兵团绿洲生态农业重点实验室,石河子832003;2新疆农垦科学院,石河子,832003;3新疆农业科学院经济作物研究所,乌鲁木齐830052)
为探索适宜新疆早熟棉的SSR-PCR反应体系,采用L9(34)正交实验设计,研究了SSR-PCR反应体系的主要成分对扩增结果的影响。结果表明,棉花SSR-PCR最适反应体系为:在10μL的反应体系中,Taq DNA聚合酶用量为0.1 U、dNTP浓度0.2 mmol/L、引物浓度0.4μmol/L、Mg2+浓度2.5 mmol/L和模板DNA 20 ng;在此基础上,从2300对SSR引物中筛选出多态性高的引物52条,分别构建了新疆已经审定的42个早熟棉品种的DNA指纹图谱。该研究为早熟棉品种鉴定、遗传多样性分析,分子标记辅助育种和种子质量综合评价等奠定了基础。
陆地棉;早熟;SSR;体系优化
随着基因概念的发展,遗传标记研究也逐步深入,已从传统的以等位基因的表型识别为基础的形态标记、细胞学标记、同工酶标记等,拓展到如SSR(simple sequence repeat)一类的以DNA多态性为基础的分子标记。SSR即简单序列重复,又称微卫星(microsatellite),是以1~6个碱基为基本单元的串联重复序列,在植物基因组中广泛分布。SSR标记具有遗传上的共显性和技术上的简单性等特点[1],被广泛应用于棉花、水稻、小麦等多种农作物[2-5]及其他植物的遗传多样性分析、分子作图、基因定位和系谱分析等领域。目前,SSR分子标记已应用于棉花品种真实性和纯度鉴定[6]、遗传多样性分析[2]、杂种优势预测、标记辅助选择、指纹图谱构建[7]等方面,已显示出了良好的应用前景。SSR标记虽有诸多优点,但其应用于不同作物及作物的不同类型时会出现较大的差异,如易产生非特异性扩增、干扰因素多、反应体系中成分复杂等。因此,有必要对早熟棉SSR反应体系中各成分的浓度、用量等各因素进行优化试验。
本研究利用正交设计分析法,对新疆早熟棉SSR PCR反应体系进行优化,建立适宜新疆早熟棉遗传分析的高效稳定的SSR技术体系,并在此基础上,筛选多态性高的SSR引物序列,以期为新疆早熟棉遗传多样性分析、图谱的构建、品种鉴别及QTL定位的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料
自1978-2009年新疆审定并推广的早熟棉新陆早1号至新陆早42号共42个品种,其中新陆早1号~新陆早32号由新疆农业科学院李雪源课题组提供,新陆早33号~42号由新疆农垦科学院棉花所李保成研究员提供。
1.1.2 SSR引物及试剂
TML、TMK、BNL(brookhaven national laboratory)SSR引物来自CottonDB(http://algodon.tamu.edu)公布的序列,J ESPR(Jenkins,El-Zik,Saha,Pepper and Reddy)SSR引物来自Reddy等[8]发表的序列。引物由上海博亚公司合成,共2300对。
丙烯酰胺、PVP40、TEMED购自上海生物工程公司,Taq DNA聚合酶和4×dN TPs购自华美生物工程公司,其它试剂均为国产分析纯。
1.2 方法
1.2.1 棉花基因组DNA的提取
棉花种子硫酸脱绒后播种于灭菌的蛭石中,28℃光照培养箱培养2周后取叶片,采用CTAB法[9]提取棉花基因组总DNA。DNA样品经浓度和纯度测定后,用 TE缓冲液稀释至26 ng/μL,置入-80℃冰箱中保存备用。
1.2.2 SSR扩增反应条件的优化
1.2.2.1 单因素试验
对SSR扩增反应的各影响因素均设置多水平梯度[10]。设计 Mg2+、dNTPs、引物、Taq酶、模板DNA浓度5个因素各8个水平(表1)。为了避免因品种不同而影响PCR扩增效果,分别选用了新陆早1号、新陆早8号、新陆早12号、新陆早13号、新陆早26号、新陆早33号6个亲缘关系较远的品种进行体系的优化。
肝脏核磁共振检查作为临床常用检查手段之一,其清晰反映患者病灶位置详情及疾病性质,为临床治疗方案提供可靠的数据资料。不过检查过程中,指导患者调节呼吸频率、服用造影剂,缓解心理压力,给予患者优质的临床护理措施是关键[1]。为此,本院为进一步提高肝脏核磁共振检查图像质量及工作顺利性,以收治的60例肝脏核磁共振检查患者作为分析对象,给予临床护理路径,详细汇报结果如下。
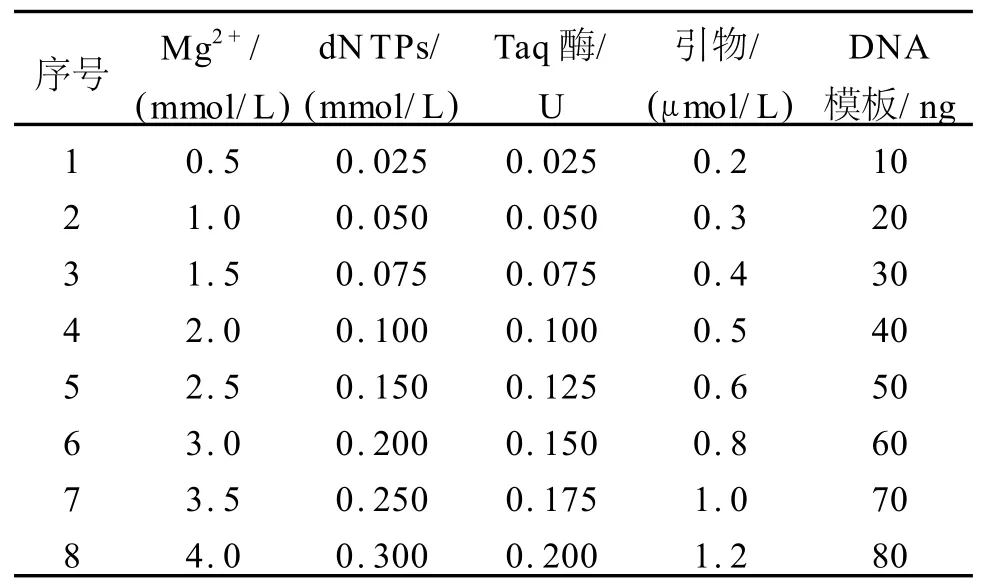
表1 棉花SSR反应体系条件优化试验设计Tab.1 Test design of condition optimization in cotton SSR reaction system
1.2.2.2 正交设计
选用L9(34)[11]正交设计表,4个因素为Mg2+、dNTPs、Taq酶、引物,共9个反应体系。试验设计见表2。为了避免因品种不同而影响 PCR扩增效果,分别选用了新陆早8号、新陆早12号、新陆早13号、新陆早26号、新陆早33号5个亲缘关系较远的品种进行体系的优化。
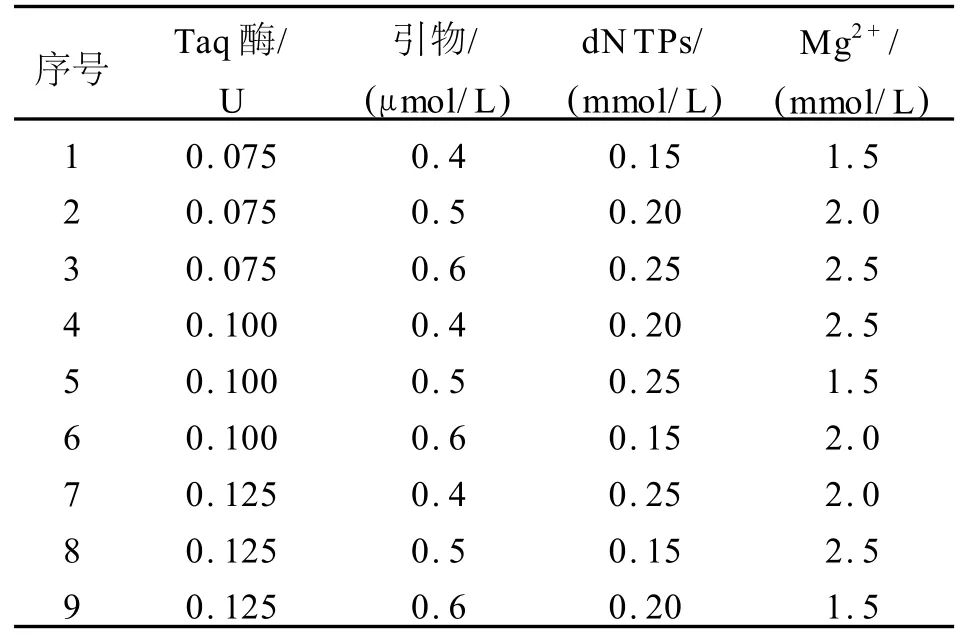
表2 棉花SSR反应体系正交设计Tab.2 Orthogonal design of cotton SSR reaction system
1.2.3 PCR扩增程序及产物的检测
PCR反应程序为:95℃预变性2 min;94℃变性45 s,55℃退火45 s,72℃延伸1 min,30个循环;72℃延伸7 min[12]。取扩增产物2μL,9%的非变性聚丙烯酰胺凝胶(0.5×TBE)电泳分离,200 V恒压1.5 h,银染(10%硝酸银)检测[13]。
2 结果与分析
2.1 单一因素对SSR-PCR检测结果的影响
如图1a所示,当 Mg2+浓度为0.5、1.0 mmol/L时,扩增条带不清晰,Mg2+浓度为1.5、2.0、2.5 mmol/L时,有较好的扩增条带;当Mg2+浓度大于3.0 mmol/L时,扩增效果逐渐变差。在10μL反应体系中,Taq酶浓度为0.025~0.05 U时,条带较弱,Taq酶增加至0.075 U、0.1 U和0.125 U时,条带亮度增加,较清晰。当 Taq酶增加至0.15 U以上时,出现明显的非特异性扩增条带(图1b);模板DNA浓度为20~80 ng时均有清晰的电泳条带出现,但结果稍有不同(图1c)。对dN TPs进行的8个浓度梯度试验中(图1d),浓度为0.025~0.150 mmol/L时均可以扩增出清晰的条带,差异不显著,在浓度为0.200~0.300 mmol/L时,扩增产物增加,出现非特异性扩增。在供试8个引物浓度中,当引物浓度为0.4~0.8μmol时,条带清晰,差异不明显;引物浓度为1.0和1.2时,各品种间差异明显,有些品种条带清楚,有些品种模糊不清(图1e)。
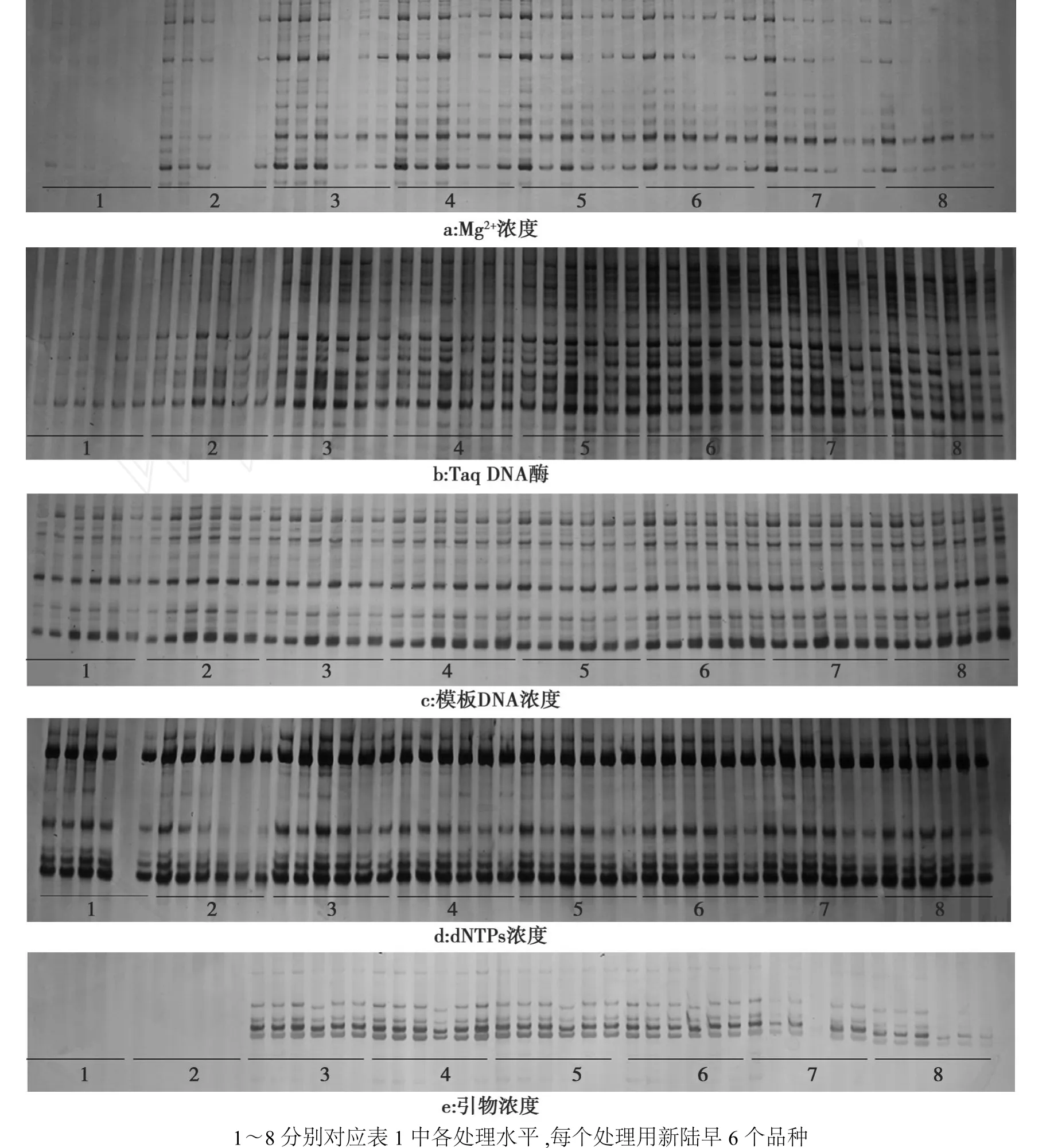
图1 各影响因素的SSR扩增结果Fig.1 The amplified results of factors
2.2 正交设计SSR-PCR检测结果
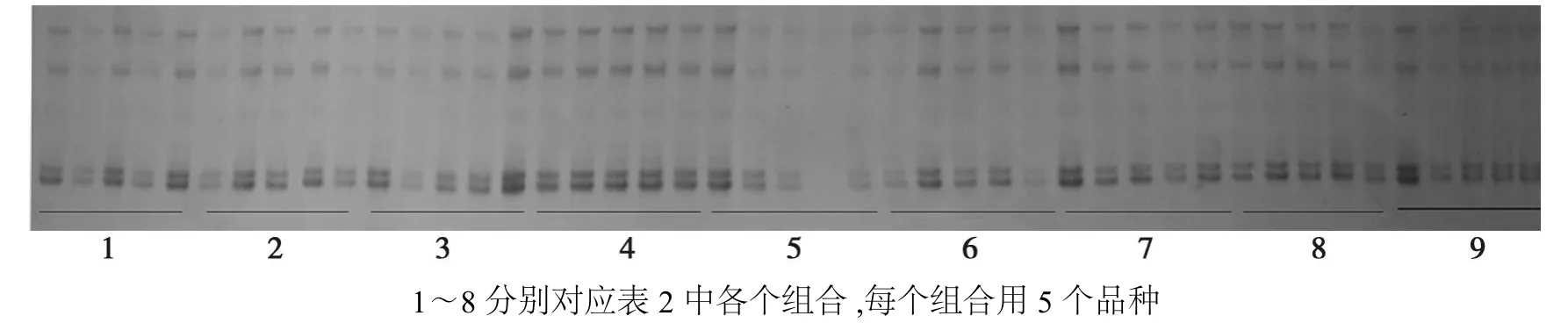
图2 正交设计SSR-PCR反应体系扩增结果Fig.2 The amplified results of treatments in orthogonal experimental design
2.3 体系稳定性鉴定及DNA指纹图谱的构建
为了验证体系对不同扩增材料的适应性,利用优化后的SSR-PCR反应体系对42个早熟棉花品种进行PCR扩增,检测结果见图3;同时,为验证体系对不同引物的适用性,随机挑选45对SSR引物,用新陆早38号的基因组DNA为模板进行扩增,结果见图4。
从图3、图4均可看出:扩增条带清晰,特异性好,反应体系具有较好的稳定性和可重复性。这表明优化后的体系不仅适用于不同的SSR引物,也适用于不同的棉花品种,且稳定可靠。利用这个体系,从2300对引物中筛选出52对多态性高的SSR引物,并利用这些引物分别构建了42个早熟棉品种的DNA指纹图谱。
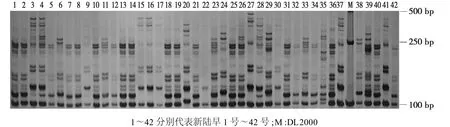
图3 引物JESPR153对42个棉花品种的扩增结果Fig.3 The PCR amplified results using primer JESPR153 on forty-two varieties of cotton
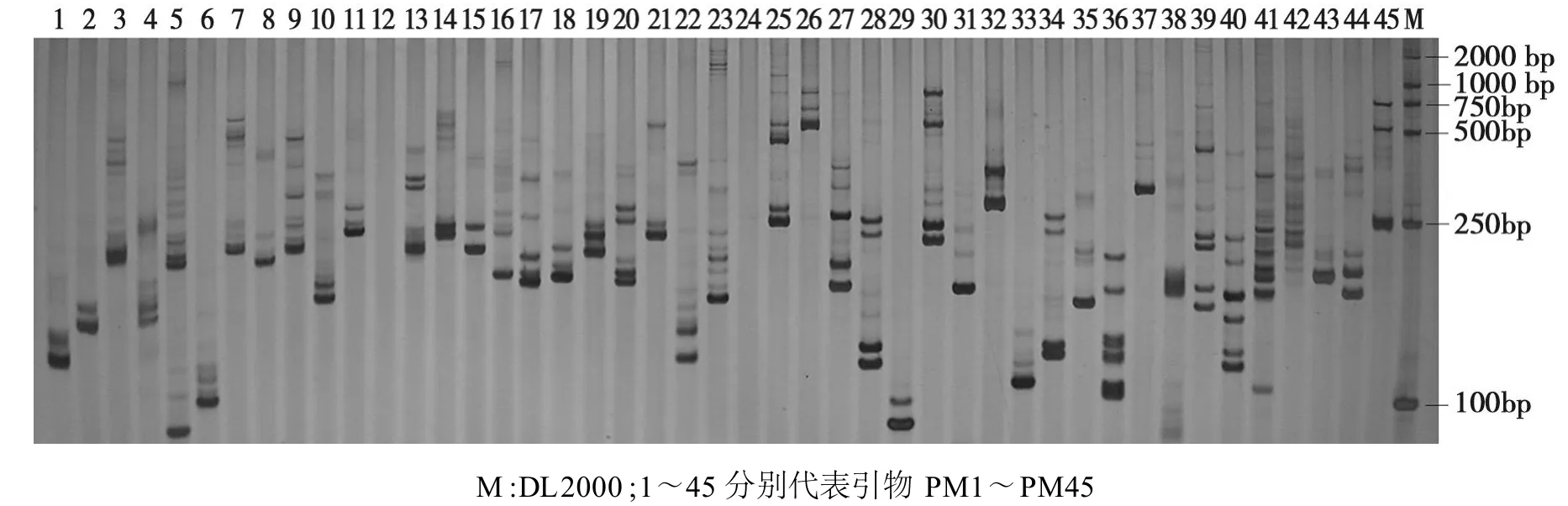
图4 不同引物在早熟棉花品种新陆早41号上的DNA指纹图谱Fig.4 The fingerprinting of cotton varieties(Xinluzao41)by SSR with different primers
3 讨论与结论
PCR反应是SSR检测过程中一个重要环节,筛选SSR引物和建立稳定的反应体系是SSR多态性应用的基础[11]。由于SSR反应体系所含组分较多,各组分均可能对扩增的敏感性、特异性和产量产生影响。因此,实行多因素联合优化的正交试验设计,借助合适的正交表,利用正交表的均衡分散性和整齐可比性,可有效解决理论上需要进行的试验次数与实际可行的试验次数的矛盾,以及实际所做的有限量试验与要求全面掌握事物内在规律间的矛盾[19]。
本试验中单因素分析结果显示,SSR扩增对模板DNA浓度的要求不高,从扩增图谱(图1c)来看,模板浓度在10~80 ng时无较大差异,这与前人研究结果一致[2]。因此在设计正交实验时,我们只设计了个4因素。通过正交实验,可了解到PCR扩增反应不仅受单个因素的影响,而且还与它们之间的配合力有关。Mg2+、引物、dNTPs、Taq DNA 酶和DNA模板做为PCR扩增的原料,有相对适宜的用量范围。但在正交实验中,单因素中表现较好的浓度进行组合,不一定会达到理想效果(图2)。
目前,关于棉花SSR反应体系的优化已有很多的报道,已证明利用正交设计优化棉花SSR反应体系是一种有效、适用而且简便的方法,能较好地识别SSR反应体系中的关键影响因素,并优化反应条件。本研究主要是针对多个品种的反应体系的优化,应用面比较广。由于品种多,在单因素设计时,各因素的水平设计范围大,均达到8个水平。为了使该体系在42个早熟棉品种中都能扩增出较好的效果,整个体系优化过程中均应用了6个品种,并且这6个品种在早熟棉品种中的遗传基础相对较远。
本研究最终构建的适宜早熟棉遗传分析的SSR技术体系:10μL的体积中,模板DNA 20 ng,Mg2+浓度2.5 mmol/L,上下游引物各0.4μmol/L,dNTPs 0.20 mmol/L,Taq DNA酶0.1 U。利用这个体系,筛选多态性高的SSR引物序列,分别构建了42个早熟棉品种的DNA指纹图谱,还分别构建了每个早熟棉品种的DNA指纹图谱。这些结果为新疆早熟棉遗传多样性分析、图谱的构建、品种鉴别及Q TL定位研究奠定了基础。
[1]Bassam B J,Caetano Anoles G,Gresshoff P M.Fast and sentitive silver staining of DNA in polyacrylamide gels[J].Anal Biochem,1991,196(1):80-83.
[2]Guang Chen,Xiongming D U.G enetic diversityof source germplasm of upland cotton in China as determined by SSR marker analysis[J].Acta G enetica Sinica,2006,33(8):733-745.
[3]刘之熙,陈祖武,朱克永,等.利用 SSR分子标记快速鉴定杂交水稻种子纯度技术体系的优化[J].杂交水稻,2008,23(1):60-63.
[4]Haiyan Wang,Xiu’e Wang,Peidu Chen,et al.Assessment of genetic diversity of Yunnan,Tibetan,and Xinjiang wheat using SSR marker[J].Journal of Genetics and Genomics,2007,34(7):623-63.
[5]王士磊,李玉鹏,高树仁.正交设计优化玉米 SSR-PCR反应体系的研究[J].基因组学与应用生物学,2009,28(1):119-122.
[6]武耀廷,张天真,郭旺珍,等.陆地棉品种 SSR标记的多态性及用于杂交种纯度检测的研究[J].棉花学报,2001,13(3):131-133.
[7]殷剑美,陈旭升,狄佳春,等.杂交棉苏杂118的 SSR指纹图谱构建[J].江苏农业科学,2007(4):29-31.
[8]Reddy O U K,Pepper A E,Abdurakhmonov I,et al.New dinucleotide and trinucleotide microsatellite markers resources for cotton genome research[J].Cotton Sci,2001,5:103-113.
[9]叶磊,王茜.一种适于SSR-PCR的棉花基因组DNA提取法[J].分子植物育种,2007,5(5):738-742.
[10]王伟,杨文鹏,关琦,等.玉米 SSR分子标记技术操作规程的优化[J].安徽农业科学,2008,36(11):4259-4264,4293.
[11]陈浩东,李育强,洪亚辉.棉花SSR-PCR反应体系的优化[J].分子植物育种,2007,5(增刊):182-186.
[12]田海燕,田新惠,李艳军,等.棉花DNA的提取及其SSR分子标记体系的建立[J].石河子大学学报:自然科学版,2007,25(2):150-152.
[13]Zhang J,Wu Y T,Guo W Z.Fast screening of microsatellite markers in cotton with PAGE/silver staining[J].Coton Sci,2000,12:267-269.
Optimization of Amplification Reaction System and Construction of DNA Fingerprinting of Local Upland Cotton Cultivars in Xinjiang
XUE Yan1,LI Baocheng2,ZHANG Xinyu1,SHA Hong3,SUN Jie1
(1 College of Agriculture/The Key Laboratory of Oasis Eco-Agriculture of Xinjiang Production and Construction Group,Shihezi University,Shihezi 832003,China;2 Xinjiang Academy of Farmland Reclamation,Shihezi 832003,China;3 Institute of Industrial Crops,Xinjiang Academy of Agricultural Science,Urumqi 83000,China)
In this study,SSR-PCR reaction conditions of short-season upland cotton in Xinjiang were optimized.The factors that affect SSR results of upland cotton were studied by L9(34)orthogonal design.The results showed that 0.1U Taq Polymerase,0.2 mmol/L dNTP,0.4μmol/L primer,2.5 mmol/L Mg2+and 20 ng template DNA in 10μL SSR reaction system might be the best combination.52 pairs of SSR primers were screened out from 2300 pairs.The DNA fingerprint for 42 local cultivars of upland cotton in Xinjiang was successfully constructed by SSR-PCR amplification.This study lays a firm foundation for cultivars identification,genetic diversity evaluation and marker-assisted selection breeding and seed quality assessment of short-season upland cotton cultivars in Xinjiang.
upland cotton;earliness;SSR;system optimization
S562;Q78 < class="emphasis_bold">文献标识码:A
A
2010-01-22
国家科技支撑计划项目(2007BAD44B07)
薛艳(1983-),女,硕士生,专业方向为棉花遗传育种;e-mail:xueyan_8@sina.com。
孙杰(1969-),男,教授,从事棉花遗传育种研究;e-mail:sunjiezh@yahoo.com.cn。

