汉黄芩素对流感病毒感染肺泡巨噬细胞炎症相关因子的影响*
吴 莹, 金叶智, 吴 珺, 于雪飞, 郝 钰
(北京中医药大学中医药防治病毒性疾病教育部重点实验室,北京 100029)
汉黄芩素对流感病毒感染肺泡巨噬细胞炎症相关因子的影响*
吴 莹, 金叶智, 吴 珺, 于雪飞, 郝 钰△
(北京中医药大学中医药防治病毒性疾病教育部重点实验室,北京 100029)
目的研究汉黄芩素对甲型流感病毒鼠肺适应株A/FM/1/47(H1N1)感染的大鼠肺泡巨噬细胞(NR8383)产生促炎症细胞因子、炎症介质及氧自由基的影响。方法流感病毒感染 NR8383细胞1 h后,加入含汉黄芩素的培养基(终浓度16 mg/L),药物作用后6 h、12 h和24 h,ELISA法检测细胞上清中肿瘤坏死因子α(TNF-α)和单核细胞趋化蛋白 1(MCP-1)的含量,放射免疫测定法检测细胞上清中前列腺素E2(PGE2)、磷脂酸A2(PLA2)和白三烯B4(LTB4)的含量;药物作用后8 h、24 h、36 h和48 h,生化法检测细胞内一氧化氮(NO)含量和诱导型一氧化氮合酶(iNOS)活性,4 h、8 h、18 h和24 h,生化法检测超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量;药物作用后24 h,real-time PCR检测细胞内TNF-α和MCP-1的mRNA水平。结果汉黄芩素抑制了流感病毒感染NR8383细胞后TNF-α、MCP-1的转录和表达(P<0.01),降低了PGE2、PLA2、LTB4和MDA的含量(P<0.05);减少了NO和iNOS的产生(P<0.05),增强了SOD的活性(P<0.05)。结论汉黄芩素明显抑制了流感病毒感染后肺泡巨噬细胞内各种炎症相关因子的产生,具有抗炎作用。
汉黄芩素; 流感病毒A型; 巨噬细胞,肺泡; 细胞因子类
中药黄芩是用于治疗流感的复方中的常用组分(如毒热平注射液,双黄连口服液等),其主要有效成分为黄芩苷、黄芩素、汉黄芩素[1]。研究表明,黄芩提取物及黄芩苷、黄芩素在体内外均具有直接抗流感病毒的作用,然而,汉黄芩素在抗流感治疗中的作用目前尚不清楚[2,3]。流行性感冒病毒是成年人和老人病毒性肺炎最为常见的病原体。在流感病毒性肺炎的发病机制中,除病毒感染的直接损伤外,病毒引起的免疫损伤也起着重要作用,其中,肺泡巨噬细胞是启动肺部炎症反应的关键细胞。流感病毒感染后刺激肺泡巨噬细胞产生过量的炎症因子、炎症介质及氧自由基,加重肺内炎症反应[4,5]。因此,本研究旨在通过分析汉黄芩素对甲型流感病毒鼠肺适应株A/FM/1/47(H1N1)感染大鼠肺泡巨噬细胞(NR8383)后产生的炎症细胞因子、炎症介质及氧自由基的影响,明确汉黄芩素在抗流感病毒治疗中发挥的作用。
材 料 和 方 法
1材料
1.1病毒与细胞 甲型流感病毒鼠肺适应株A/FM/1/47(H1N1),由中国预防医学科学院病毒学研究所提供,-76 ℃保存备用。于9 d龄鸡胚尿囊腔连续传代2次后,测血凝滴度为1∶512,病毒的半数组织培养感染剂量(median tissue culture infective dose,TCID50)为103.6/L。大鼠肺泡巨噬细胞系(NR8383)购于中国科学院细胞库,由本室传代后使用。
1.2药物与试剂 汉黄芩素(批号111514-200403)为中国药品生物制品检定所产品,配成10 g/L的原药液。F12K干粉购于Sigma;胎牛血清为Hyclone产品;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium, MTT)为Amresco产品。大鼠单核细胞趋化蛋白 1(monocyte chemoattractant protein-1,MCP-1)ELISA试剂盒购于BD。大鼠肿瘤坏死因子( tumor necrosis factor-alpha,TNF-α) ELISA 试剂盒购于深圳晶美公司。白三烯B4(leukotriene B4, LT-B4)、前列腺素E2(prostaglandin E2, PGE2)和磷脂酶A2(phospholipase A2, PLA2)放射免疫测定试剂盒购于北京华英生物技术研究所。丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)试剂盒购于南京建成生物工程研究所。Griess试剂由本室配制,4 ℃保存。RIPA裂解液(批号为092003)购于北京尚柏生物技术有限公司产品。Trizol试剂购于Invitrogen。反转录试剂购于Fermentas MBI。 PCR试剂购于大连宝生物工程有限公司。SYBR Green试剂购于北京天根生化科技有限公司。
1.3荧光定量PCR引物 MCP-1引物:上游5’-GGGTCCAGAAGTACATTAGA-3’,下游5’-GCTGAAGTCCTTAGGGTTGA-3’。TNF-α引物:上游5’-CCACGCTCTTCTGTCTACTG-3’ ,下游5’-GCTACGGGCTTGTCACTC-3’。内参照β-actin引物:上游5’-CCACTGCCGCATCCTCTT-3’,下游5’-GCATCGGAACCGCTCATT-3’。以上引物均由北京凯诺春天生物科技有限公司合成。
2方法
2.1药物细胞毒性实验 NR8383细胞为半贴壁半悬浮细胞,待细胞生长状态良好时,吹打消化细胞,用培养液调整细胞至5×108cells/L,将该细胞液加入96孔板中,90 μL/well,于37 ℃、5% CO2培养箱中培养。用培养液将汉黄芩素用2倍稀释法稀释为不同浓度,加入细胞培养板中,10 μL/well,使药物的终浓度为0.032 g/L、0.016 g/L、0.008 g/L、0.004 g/L、0.002 g/L、0.001 g/L,每个药物稀释浓度平行做6个复孔,同时设正常细胞对照。于37 ℃、5% CO2培养48 h后,用MTT(终浓度0.5 g/L)比色法检测药物对NR8383细胞的毒性,计算细胞存活率。细胞存活率(%) =实验组吸光度值(A)/细胞对照组吸光度值(A)×100%,确定药物最大无毒浓度(TC0)。
2.2ELISA检测MCP-1和TNF-α 接种5×108cells/L NR8383细胞至24孔板,500 μL/cell,用100 TCID50的流感病毒感染NR8383细胞后,置37 ℃、5% CO2培养箱中吸附1 h,1 000 r/min离心5 min,弃上清,加入0.16 g/L的汉黄芩素药液,500 μL/cell,同时设正常细胞对照和病毒对照。置37 ℃、5%CO2培养箱中分别培养6 h、12 h、24 h后,1 000 r/min 离心5 min,吸取上清,按ELISA试剂盒说明书检测上清中MCP-1和TNF-α含量。
2.3荧光定量PCR检测MCP-1和TNF-α mRNA水平 药物作用于流感病毒感染的NR8383细胞后24 h,吹打消化细胞,1 000 r/min离心5 min,弃上清,收集细胞样品,用PBS溶液洗涤3次后,加入1 mL Trizol试剂,混匀,按试剂操作说明书提取细胞总RNA。取2 μg 总RNA为模板,以寡核苷酸Oligo(dT)为引物,反转录反应体系为25 μL,按反转录试剂盒说明书进行反转录。
PCR扩增按SYBR green试剂说明书进行:反应体系为40 μL,含2×mixture 20.0 μL,模板 1.0 μL,上游引物(20 μmol/L)1.0 μL,下游引物(20 μmol/L)1.0 μL,无菌水17.0 μL。扩增条件为:50 ℃ 2 min,95 ℃ 10 min,然后95 ℃ 15 s,60 ℃ 1 min,读板,共40个循环。
2.4放射免疫测定法(RIA)检测PGE2、PLA2和LTB4样品准备方法同2.2所示,按试剂盒说明书检测上清中PGE2、PLA2和LTB4含量。
2.5生化法检测细胞MDA、NO含量和SOD、iNOS活性 SOD活性的检测采用黄嘌呤氧化酶法,MDA的检测采用TBA法,样品准备方法同2.2所示。用药后4 h、8 h、18 h和24 h,吸取细胞上清,按试剂盒说明书检测上清中MDA含量和SOD活性。NO的检测采用Griess试剂,用药后8 h、24 h、36 h和48 h,取细胞上清100 μL,加入Griess 试剂,100 μL/well,室温显色10 min,酶标仪530 nm下测定各孔的A值。iNOS活性的检测采用比色法,用药后8 h、24 h、36 h、48 h,1 000 r/min离心5 min,弃细胞上清,加入200 μL细胞裂解液,吹打混匀后,12 000 r/min离心4 min,取上清100 μL,按试剂盒说明书检测细胞内iNOS活性。
3统计学处理

结 果
1汉黄芩素对NR8383细胞的毒性测定
MTT的检测结果显示,当汉黄芩素的浓度分别
为0.032 g/L、0.016 g/L、0.008 g/L、0.004 g/L、0.002 g/L和0.001 g/L时,对应NR8383细胞存活率为70.66%、94.25%、99.83%、95.08%、93.64%和99.82%,汉黄芩素对NR8383细胞的的最大无毒浓度为0.016 g/L。
2汉黄芩素抑制流感病毒感染NR8383细胞后MCP-1和TNF-α的转录与表达
流感病毒感染肺泡巨噬细胞后,细胞上清中MCP-1的含量明显增加,在各时点与正常细胞组比较均有显著差异(P<0.01)。汉黄芩素作用后,降低了巨噬细胞分泌的MCP-1含量,用药后6 h、12 h和24 h,与病毒组比较均有显著差异(P<0.01),见图1A。而病毒感染后TNF-α的含量在 12 h和24 h升高,与正常细胞组比较有显著差异(P<0.01),汉黄芩素作用后,降低了巨噬细胞分泌的TNF-α含量,与病毒组比较有显著差异(P<0.01),见图1B。汉黄芩素抑制了流感病毒感染后肺泡巨噬细胞MCP-1和TNF-α的转录,与病毒组比较差异显著(P<0.01),见表1。


图1汉黄芩素对流感病毒感染NR8383细胞后MCP-1和TNF-α分泌的影响
表1汉黄芩素对流感病毒感染NR8383细胞后MCP-1和TNF-α转录的影响


GroupMCP-1mRNA/β-actinmRNATNF-αmRNA/β-actinmRNANormal0.1577±0.0224∗∗0.0304±0.0006∗∗Virus0.4767±0.11000.3746±0.0505Virus+wogonin0.2775±0.0807∗∗0.1704±0.0203∗∗
**P<0.01vsvirus group.
3汉黄芩素对流感病毒感染NR8383细胞后PGE2、PLA2和LTB4分泌的影响
流感病毒感染肺泡巨噬细胞后,培养上清液中PGE2的含量在6 h时有明显增加,与正常细胞组相比有显著差异(P<0.05),随后降低,与正常细胞组相比无显著差异(P>0.05),汉黄芩素作用后PGE2的分泌有一定的降低,但作用不明显,与病毒组相比无显著差异(P>0.05),见图2A。病毒组PLA2的含量在24 h时升高,与正常细胞组相比有显著差异(P<0.05),而汉黄芩素在用药后6 h明显降低了PLA2的含量,与正常细胞组、病毒组相比均有显著差异(P<0.01),其它时点则未表现出对PLA2的抑制作用,见图2B。病毒组LTB4的含量在6 h、12 h时升高,与正常细胞组相比有显著差异(P<0.05),汉黄芩素在用药后12 h对LTB4分泌的抑制作用最明显,与病毒组相比有显著差异(P<0.01),见图2C。
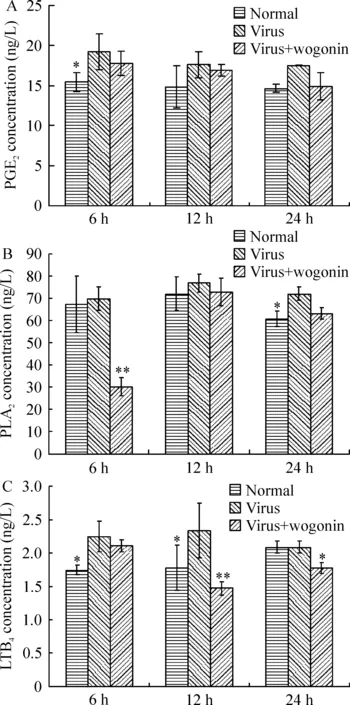
图2汉黄芩素对流感病毒感染NR8383细胞后PGE2、PLA2和LTB4含量的影响
4汉黄芩素降低流感病毒感染NR8383细胞后NO含量和iNOS活性
肺泡巨噬细胞受流感病毒感染刺激后,NO分泌逐渐增多,汉黄芩素作用后明显降低了病毒刺激后细胞NO的分泌至几乎与正常细胞相同水平。用药后24 h、36 h和48 h,汉黄芩素组的NO含量与病毒组相比有显著差异(P<0.01),见图3A。而细胞内iNOS活性的变化与上清中NO的变化一致,用药后24 h、36 h和48 h,汉黄芩素组iNOS活性与病毒组相比有显著差异(P<0.05),见图3B。
5汉黄芩素降低MDA的含量,增强SOD的活性
流感病毒感染后,NR8383细胞中MDA含量增加,而汉黄芩素降低了病毒刺激后细胞MDA的含量,用药后4 h和8 h,汉黄芩素组MDA的含量与病毒组相比有显著差异(P<0.05)。流感病毒感染后细胞内SOD的活性降低,表明细胞清楚氧自由基的能力降低,而汉黄芩素作用后增强了SOD活性,用药后4 h、8 h,与病毒组相比有显著差异(P<0.05,P<0.01)。


图3汉黄芩素对流感病毒感染NR8383细胞内NO含量和iNOS活性的影响
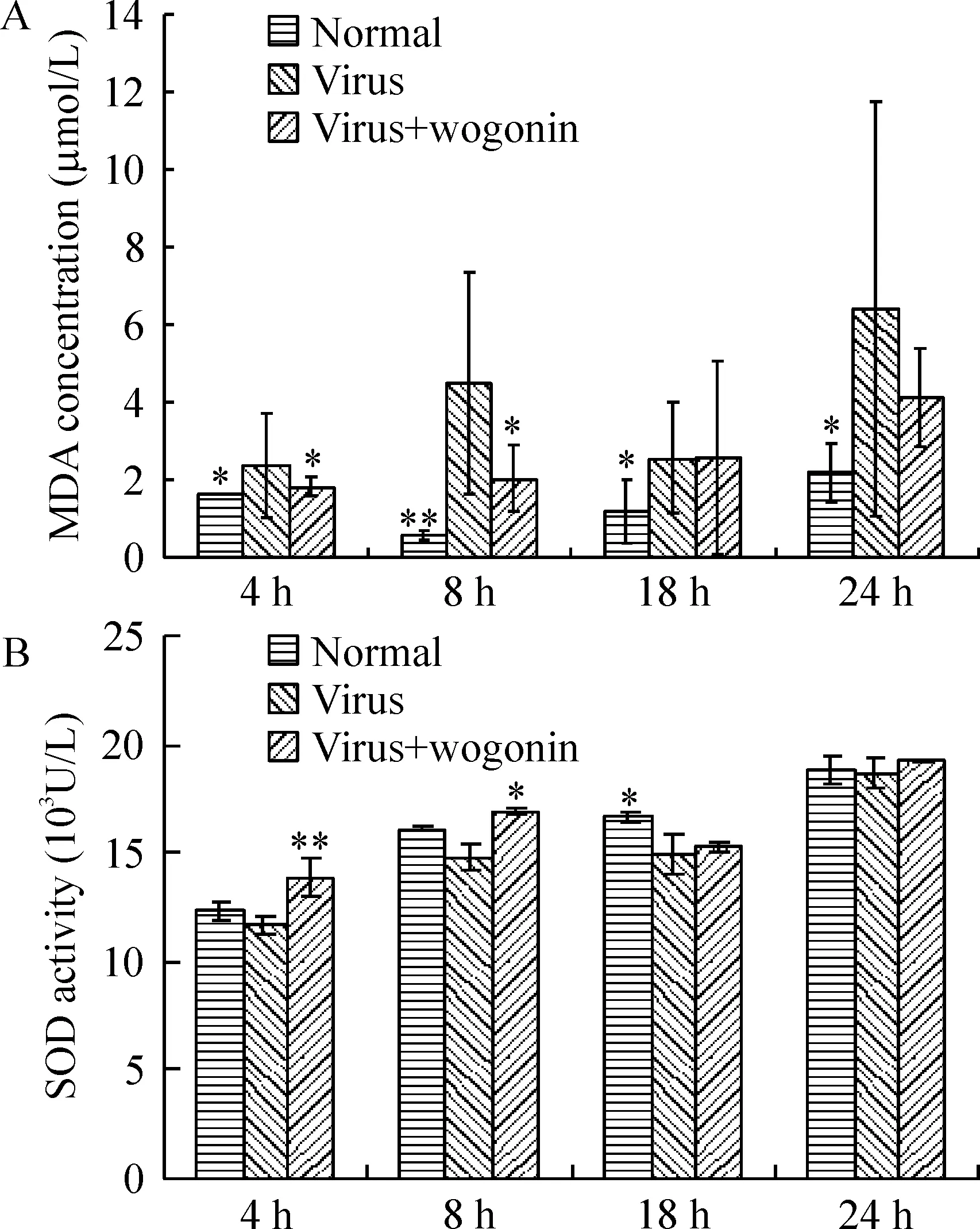
图4汉黄芩素对流感病毒感染NR8383细胞中MDA含量及SOD活性的影响
讨 论
病毒性肺炎是流感病毒感染后最严重的并发症,导致较高的死亡率[6]。流感病毒性肺炎的病理变化,是由病毒复制引起感染细胞的直接损伤与宿主的免疫反应共同作用的结果[7]。研究表明,小鼠流感病毒感染致命的后果更多的是取决于宿主的免疫病理损伤,而非病毒复制所致的直接细胞损伤[8]。
既往研究表明,黄芩提取物在小鼠流感病毒感染模型上能起到抗流感病毒的作用[2]。我们的前期研究对黄芩的主要单体成分黄芩苷、黄芩素及汉黄芩素的体外抗流感病毒的作用进行了比较,结果表明,黄芩苷在体外抗流感病毒作用最强,而汉黄芩素在体外无明显的抗病毒作用[9]。
然而,近期研究表明,汉黄芩素具有明显的抗炎、抗氧化作用,能明显抑制中枢神经系统巨噬细胞(小胶质细胞)活化后IL-6、NO、MCP-1以及调节激活正常T细胞表达和分泌因子(regulated upon activation,normal T-cell expressed and secreted,RANTES)等炎症相关因子的分泌,起到神经保护作用[10,11]。因此,我们设想,汉黄芩素可能通过抑制流感病毒感染后与宿主的免疫反应,减轻免疫损伤,从而起到抗流感病毒感染后炎症反应的作用。本研究以流感病毒鼠肺适应株感染的大鼠肺泡巨噬细胞(NR8383)细胞为模型,从3个方面分析了汉黄芩素对病毒感染后NR8383细胞分泌的炎症相关因子的影响。
1汉黄芩素对流感病毒感染NR8383细胞后TNF-α和MCP-1转录及表达的影响
TNF-α是病毒感染后最早释放的前炎症介质之一,是肺部炎症病变中最主要的促进因子,主要由肺泡巨噬细胞产生。过量的TNF-α能诱导肺内皮细胞活化、白细胞迁移、粒细胞脱颗粒和毛细血管渗漏等,从而诱发并进一步加重炎症反应。炎症反应发生时,炎性细胞在趋化因子作用下向病灶游走。其中CC家族趋化因子MCP-1主要参与单个核细胞浸润[12]。研究表明,巨噬细胞受流感病毒感染刺激后, MCP-1和TNF-α的转录和表达明显增强,汉黄芩素抑制了流感病毒感染后肺泡巨噬细胞MCP-1、TNF-α的转录和表达,与病毒组比较差异显著(P<0.01)。
2汉黄芩素对流感病毒感染NR8383细胞后炎症介质PGE2、PLA2和LTB4分泌的影响
PGE2是花生四烯酸代谢过程中产生的1个重要炎症介质,可通过其强大的扩血管促进炎症反应发生发展。病毒刺激是导致PLA2激活的原因之一,激活的PLA2作用于细胞膜磷脂,产生花生四烯酸,其代谢产物LTB4具有很强的嗜中性粒细胞趋化活性和淋巴细胞增殖作用,是目前已知最强的中性粒细胞催化因子和活化因子之一[13,14]。本研究表明,流感病毒感染肺泡巨噬细胞后,上清中PGE2、PLA2和LTB4的含量均有所增加。汉黄芩素能明显降低PLA2和LTB4的含量(P<0.05),对PGE2的分泌有一定的降低,但作用不明显,与病毒组相比无显著差异(P>0.05)。
3汉黄芩素对流感病毒感染NR8383细胞后NO、iNOS、SOD和MDA产生的影响。
NO 是重要的炎症介质,高水平NO导致细胞毒性作用,介导免疫损伤。iNOS主要在各种炎症情况下表达,NO的大量产生可能来源于iNOS诱导表达[15]。MDA的水平反映脂质过氧化程度,而SOD是机体重要的抗氧化酶,可清除自由基,减轻氧化损伤[16,17]。MDA间接反映细胞损伤程度,SOD活性反映机体清除氧自由基的能力。本研究表明,肺泡巨噬细胞受流感病毒感染刺激后,iNOS和NO的含量逐渐增多,汉黄芩素作用后明显降低了病毒刺激后细胞NO和iNOS的水平。NR8383细胞中MDA的含量在流感病毒感染后增加,表明细胞膜产生了脂质过氧化损伤,而汉黄芩素降低了病毒刺激后细胞MDA的含量,增强了SOD活性。
综上,本研究证实了汉黄芩素对流感病毒感染后肺泡巨噬细胞炎症相关因子的产生具有明显的抑制作用,明确了汉黄芩素在抗流感治疗中发挥了抗炎的作用,为汉黄芩素的药理作用增加了新的内容。我们设想,黄芩主要通过黄芩苷、黄芩素直接抗流感病毒,而通过汉黄芩素抑制流感病毒感染后的炎症级联反应,从而起到既抗病毒又抗炎的作用,这为黄芩临床治疗流感病毒性肺炎提供了实验依据与基础。
[1] 宋旦哥,孟庆刚. 黄芩药理作用研究述评[J]. 中华中医药学刊,2009,27(8):1619-1621.
[2] 初 明,初正云,王丹丹. 复方黄芩提取物对小鼠体内流感病毒mRNA复制和干扰素(IFN)表达的影响[J]. 中药材,2007,30 (1):63-65.
[3] 吴修华,刘 妮,杨 丽,等. 黄芩素体内抗甲型流感病毒作用的研究[J]. 广州中医药大学学报,2009,26(2):157-159、200.
[4] Seo SH, Webby R, Webster RG. No apoptotic deaths and different levels of inductions of inflammatory cytokines in alveolar macrophages infected with influenza viruses[J]. Virology, 2004,329(2):270-279.
[5] Snelgrove RJ, Edwards L, Rae AJ,et al. An absence of reactive oxygen species improves the resolution of lung influenza infection[J]. Eur J Immunol, 2006, 36(6):1364-1373.
[6] Wang J, Oberley-Deegan R, Wang S, et al. Differentiated human alveolar type II cells secrete antiviral IL-29 (IFN-λ1) in response to influenza A infection[J]. J Immunol, 2009, 182(3):1296-1304.
[7] Kim HM, Lee YW, Lee KJ, et al. Alveolar macrophages are indispensable for controlling influenza viruses in lungs of pigs[J]. J Virol, 2008, 82(9):4265-4274.
[8] Shimomura E, Suzuki F, Ishida N. Characterization of cells infiltrating the lungs of x-irradiated and nude mice after influenza virus infection[J]. Microbiol Immunol, 1982, 26(2): 129-138.
[9] 吴 莹, 金叶智, 吴 珺,等. 黄芩主要成分体外抗甲型流感病毒作用的研究[J].北京中医药大学学报, 2010, 33(8):541-545.
[10]朴花子,于兆霞,朴日龙,等. 汉黄芩素对脂多糖诱导一氧化氮和单核细胞趋化蛋白-1的影响[J]. 中药药理与临床, 2007, 23(3):20-21.
[11]朴花子,郑善子,崔万善. 汉黄芩素对脂多糖诱导细胞因子IL-6和趋化因子RANTES的影响[J].中药药理与临床, 2008, 24(6):34-36.
[12]沈 燕,熊思东.MCP-1结构与功能的分子基础[J].生命的化学, 2002,22(1):58-60.
[13]Lin WW,Chen BC. Pharmacology comparison of UTP-and thapsigargin-induced acid release in mouse RAW 264.7 macrophages[J]. Br J Pharmacol, 1998, 123(6):1173-1181.
[14]Sampson SE, Costello JF, Sampson AP. The effect of inhaled leukotriene B4 in normal and in asthmatic subjects[J]. Am J Respir Crit Care Med, 1997, 155(5):1789-1799.
[15]Michel T,Feron O.Nitric oxide synthase:which,where,how,and why?[J].J Clin Invest,1997, 100(9):2146-2152.
[16]李建强,高晓玲,刘卓拉,等.胆红素对抗脂多糖诱导致大鼠急性肺损伤的实验研究[J].中国病理生理杂志, 2005, 21(4):780-783.
[17]王秋林,王浩毅,王树人.氧化应激状态的评价[J].中国病理生理杂志, 2005, 21(10):2069-2074.
Effectsofwogoninoninflammation-relatedfactorsinalveolarmacrophagesinfectedwithinfluenzavirus
WU Ying, KIM Ye-ji, WU Jun, YU Xue-fei, HAO Yu
(KeyLaboratoryofChineseMedicineonViralDisease,MinistryofEducation,BeijingUniversityofChineseMedicine,Beijing100029,China.E-mail:yuhao64@sina.com)
AIM: To study the effects of wogonin on A inflammatory cytokines, inflammatory mediators and oxygen free radical generated from rat alveolar macrophages (NR8383) infected with influenza A virus adapted to mouse A/FM/1/47(H1N1).METHODSAfter 1 h adsorption of the influenza virus, the medium containing 16 mg/L wogonin was added to NR8383 cells. At 6 h, 12 h and 24 h of wogonin exposure, the cultured supernatants were collected and the concentrations of tumor necrosis factor-alpha (TNF-α) and monocyte chemoattractant protein-1 (MCP-1) were measured by ELISA. The concentrations of inflammatory mediators prostaglandin E2(PGE2), phospholipase A2(PLA2) and leukotriene B4(LTB4) were detected by radioimmunoassay (RIA). At 8 h, 24 h, 36 h and 48 h after wogonin exposure, the concentration of nitric oxide(NO) and the activity of inducible nitric oxide synthase(iNOS) were determined by biochemical detection. At 4 h, 8 h, 18 h and 24 h after wogonin exposure, biochemical detection was also used to measure the activity of superoxide dismutase(SOD) and the concentration of malondialdehyde(MDA). The mRNA levels of TNF-α and MCP-1 were determined 24 h after drug application by real-time PCR.RESULTSWogonin inhibited the transcription and expression of TNF-α and MCP-1 in NR8383 cells infected with the influenza virus (P<0.01), and reduced the concentrations of PGE2, PLA2, LTB4and MDA (P<0.05). Wogonin also reduced the production of NO and the activity of iNOS (P<0.05), and increased the activity of SOD (P<0.05).CONCLUSIONWogonin obviously inhibits the production of various inflammation-related factors in alveolar macrophages infected with influenza virus, indicating its anti-inflammatory mechanism on influenza virus infection.
Wogonin; Influenza A virus; Macrophages,alveolar; cytokines
R285.5
A
1000-4718(2011)03-0533-06
2010-09-08
2010-11-22
国家自然科学基金资助项目(No. 30772871)
△通讯作者 Tel:010-64286973; E-mail: yuhao64@sina.com
10.3969/j.issn.1000-4718.2011.03.022
本文获2010年中国病理生理学会炎症发热感染低温专业委员会和中医专业委员会第12届联合学术交流会青年优秀论文一等奖

