新型大麻制剂O-1602和CBD减轻小鼠实验性急性胰腺炎的机制研究*
冯佳燕, 李 琨, 林旭红, 余良英, 李永渝
(同济大学医学院病理生理教研室,同济大学消化系疾病研究所,上海 200092)
新型大麻制剂O-1602和CBD减轻小鼠实验性急性胰腺炎的机制研究*
冯佳燕, 李 琨, 林旭红, 余良英, 李永渝△
(同济大学医学院病理生理教研室,同济大学消化系疾病研究所,上海 200092)
目的观察2种新型大麻类制剂O-1602和大麻二酚(CBD)对雨蛙肽(CAE)诱导的小鼠急性胰腺炎(AP)的抗炎作用,并通过其对热休克蛋白60(HSP60)表达的影响,探讨其可能的机制。方法以CAE腹腔注射(50 μg·kg-1·h-1,共6次)复制小鼠AP模型,对照组用生理盐水(NS)替代CAE;给AP小鼠腹腔注射O-1602或CBD作为治疗组。组织学检查评估不同处理组胰腺组织形态学改变;测定血浆淀粉酶及脂肪酶活性(生化法)、血浆细胞因子如肿瘤坏死因子α(TNF-α)及白细胞介素6(IL-6)的水平(ELISA法),以及肺脏中髓过氧化物酶(MPO)活性的变化(生化法);同时,用 real-time PCR和Western blotting测定胰腺组织热休克蛋白(HSP60) mRNA和蛋白的表达特点。结果AP组小鼠胰腺组织出现明显损伤及炎症表现;此类表现在AP+O-1602及AP+CBD治疗组得到明显改善。AP组血浆淀粉酶及脂肪酶活性、TNF-α及IL-6水平、肺脏MPO水平较NS组均有显著升高(P<0.05);而在AP+O-1602及AP+CBD组,这些指标均较AP组明显降低(P<0.05)。同时,胰腺组织HSP60 mRNA和蛋白的表达量在AP组均降低(P<0.05), O-1602或CBD处理可一定程度提高HSP60的表达(P<0.05)。结论CAE可成功诱导小鼠AP的发生,并伴有一定程度的全身炎症反应,O-1602和CBD可改善胰腺局部损伤程度及全身炎症程度,其机制可能与大麻类物质对炎症介质、细胞因子的抑制以及提高细胞保护因子HSP60的表达有关。
急性胰腺炎; 大麻素类; 热休克蛋白质60
大麻类物质包括从大麻植物提取的生物活性成分-大麻(cannabinoid,CB)、人工合成的大麻素类制剂以及机体代谢产生的内源性脂质(内源性大麻类物质),它们能作用于靶组织中的特定受体发挥效应[1]。大麻素受体(cannabinoid receptors)主要是一组属于G蛋白偶联受体超家族的细胞膜受体。在哺乳动物体内,已发现存在2种经典的大麻素受体,即CB1受体和CB2受体[2]。目前已知这2种受体参与机体多种功能活动的调节,在病理情况下与疼痛、炎症等的发生发展关系密切。Smith等[3]证实CB1、CB2受体激动剂(WIN 55212-2、HU210)在抑制细胞因子及抗炎方面有明显的作用。Michalski等[4]及Matsuda等[5]看到CB1、CB2受体激动剂可减轻AP所致的疼痛、炎症程度并延长生存时间[4,5]。
随着对大麻素系统的深入研究,最近一种也属G蛋白偶联受体,但非CB1受体、非CB2受体的大麻受体GPR55(G protein-coupled receptor 55)在哺乳类被发现,并受到了广泛的关注[6]。目前对GPR55相关的大麻类制剂相继被研发,大麻二酚(cannabidiol, CBD) 及O-1602是2种新型的大麻类制剂。前者首先发现于印度大麻中,是一种非精神作用的大麻类物质,其作用途径较复杂,但已被很多研究证实在控制炎症方面作用显著[7,8];后者为一种人工合成的大麻二酚类似物,能特异激活GPR55,对CB1、CB2受体无作用[9]。二者结构相似,见图1,对其作用的相关研究报道较少,对AP的作用尚未见报道。

Figure 1. The structural fomulas of cannabidiol(CBD) and O-1602.
图1CBD及O-1602的结构式
为了探讨大麻素系统在AP发病过程中的可能作用,本实验用经典方法即胆囊收缩素类似物雨蛙肽(caerulein,CAE)腹腔注射诱导小鼠急性胰腺炎(acute pancreatitis, AP)模型,以2种GPR55相关的新型大麻类制剂O-1602和CBD对AP动物进行处理,研究这2种新型大麻类制剂可能的抗炎作用及其作用机制。
材 料 和 方 法
1动物及分组
体重18-22 g 的C57BL小鼠 35只,雌雄各半,购自第二军医大学实验动物中心。实验前小鼠禁食不禁水16 h,随机将小鼠分为5组(每组小鼠7只):未处理组(正常组)、生理盐水对照组(NS组)、急性胰腺炎组(AP组)、AP+O-1602组以及AP+CBD组。参照Ding等[10]的方法制备AP模型,即小鼠腹腔注射(ip)50μg/kg CAE(Sigma),每小时1次,共6次(AP组)。NS组用生理盐水替代雨蛙肽ip;AP+O-1602组及AP+CBD组在AP造模前0.5 h及造模过程5 h时点给O-1602(10 mg/kg,ip) 或CBD(1 mg/kg,ip)(Biotrend AG)。药物剂量的确定通过预实验及参考文献[4]的方法。
2取材及各项指标的检测
第6次注射CAE或NS后3 h,七氟醚(丸石制药株式会社)吸入麻醉小鼠,断头取血,1%肝素抗凝处理,收集血浆标本,-80 ℃保存。仔细分离并取出胰腺、肺脏。胰腺组织分成若干份,1份迅速置于4%多聚甲醛,其余组织生理盐水冲洗、滤纸吸干、称重,-80 ℃保存,用于以下相关指标检测。
2.1胰腺组织形态学检测 将置于4%多聚甲醛中的胰腺组织进行石蜡包埋、切片、苏木素-伊红(HE)染色。光学显微镜下观察胰腺组织病理改变。
2.2血浆淀粉酶及脂肪酶活性检测,肺组织髓过氧化物酶(myeloperoxidase,MPO)活性检测,以及肿瘤坏死因子α(tumor necrosis factor α,TNF-α)及白细胞介素6(interleukin 6,IL-6)水平检测 血浆淀粉酶、脂肪酶活性以及肺组织MPO活性按相关生化试剂盒(南京建成生物科技有限公司)说明书介绍的步骤检测。MPO活性测定同时,使用蛋白定量试剂盒(BCA,Thermo)测定各检测标本组织的蛋白量,从而换算得出每毫克组织蛋白的MPO活性水平。血浆TNF-α以及IL-6水平按相关ELISA试剂盒(R&D)说明书介绍的步骤检测。
2.3Real-time PCR检测胰腺组织中HSP60 mRNA的表达 参照Li等[11]的方法,即采用Trizol(Invitrogen)提取胰腺组织总RNA,将其逆转录成cDNA(TaKaRa逆转录试剂盒)后,以荧光定量PCR仪(上海枫岭生物技术有限公司)进行基因扩增。PCR反应条件为:95 ℃预变性10 s,95 ℃ 5 s,60 ℃ 31 s,45个循环扩增。以HSP60的copy数与内参照3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GAPDH)的copy数的比值计算HSP60 mRNA相对表达量。HSP60正义链5’- GGCTATCGCTACTGGT -3’,反义链5’-GCAAGTCGCTCGTTCA-3’,产物长292 bp;GAPDH正义链5’-ACCACAGTCCATGCCATCAC-3 ’,反义链5’-TCCACCACCCTGTTGCTGTA-3’,产物长490 bp(Primer 5.10 软件设计,Invitrogen公司合成)。
2.4Western blotting检测胰腺组织中HSP60蛋白的表达 取胰腺组织加入蛋白裂解液[组成:25 mmol/L HEPES(pH 7.5),1mmol/L EDTA, 150 mmol/L NaCl, 10 mmol/L MgCl2,1% NP40, 2% glycerol,1mmol/L PMSF, 10 mg/L aprotinin],均浆、充分裂解后,离心取上清液,检测样品蛋白浓度(BCA,Thermo)。等浓度样品加入5×上样缓冲液(碧云天生物技术研究所),95 ℃煮沸10 min使蛋白变性。将样品(40 μg蛋白)在4%-10%Tris-SDS-Page胶中电泳1.5 h,转移到硝酸纤维素膜上,5%脱脂牛奶封闭1 h;滴加HSP60单克隆抗体(1∶1 000稀释, Strssgen),4 ℃孵育过夜;滴加IR Dye800 共轭亲和纯化抗体(1∶5 000稀释,Rockland),室温下孵育1 h;内参照用单克隆抗体β-actin(1∶1 000稀释,
Sigma)。用Odyssey红外双色激光成像系统(LI-COR)检测蛋白条带;采用Image J分析蛋白条带的光强度。HSP60蛋白的相对表达量用HSP60条带的光强度与β-actin条带光强度的比值表示。
3统计学处理
结 果
1胰腺组织病理改变
光镜下观察发现,与对照组比较,AP组胰腺组织呈现重度水肿及炎症表现,大片胰腺腺泡肿胀,有空泡形成,间隙明显增宽,中性粒细胞浸润,血管扩张、充血明显。在AP+O-1602及AP+CBD组,组织水肿及炎症程度减轻,间质轻度增宽,组织仍可见充血及中性粒细胞浸润,但程度减轻。2种药物处理组相比,AP+O-1602组胰腺组织水肿程度更轻,见图2。

Figure 2. Effect of O-1602 or CBD on the morphology of pancreatic tissues in mice with acute pancreatitis(AP)(HE staining,×400).A:normal:B:AP;C:AP+O-1602;D:AP+CBD.
图2O-1602或CBD对急性胰腺炎小鼠胰腺组织形态学的影响
2血浆中淀粉酶和脂肪酶活性的改变
与正常组比较,NS组血浆淀粉酶、脂肪酶活性没有明显改变(P>0.05);AP组血浆淀粉酶、脂肪酶活性与NS组比较显著升高(P<0.05);而AP+O-1602及AP+CBD组中,血浆淀粉酶、脂肪酶活性与AP组比较显著降低(P<0.05),与NS组比较仍维持在较高水平(P<0.05);2种药物处理组之间无显著差异(P>0.05),AP+CBD组的下降幅度较大,见图3。
3血浆中TNF-α和IL-6水平的改变
如图4所示, AP组TNF-α和IL-6水平均比NS组显著升高(P<0.05)。与AP组比较,O-1602或CBD均可明显降低AP小鼠血浆中的促炎细胞因子IL-6和TNF-α的水平(P<0.05),其水平基本与NS组的相当(P>0.05)。
4肺脏组织中髓过氧化物酶活性变化
结果显示于图5,NS组肺组织MPO活性与正常组比较无明显差异(P>0.05);AP组肺组织MPO活性与NS组比较显著升高(P<0.05);O-1602或CBD均可明显降低AP小鼠肺组织MPO活性(P<0.05),与NS组的比较无显著差异(P>0.05)。
5胰腺组织中HSP60mRNA的表达
如图6所示,NS注射引起胰腺组织HSP60 mRNA表达水平显著升高,与正常组比较差异显著(P<0.05),而CAE注射复制AP,胰腺组织HSP60 mRNA表达显著降低,与NS组比较P<0.05。在AP+O-1602及AP+CBD组,胰腺HSP60 mRNA表达水平较AP组有明显升高(P<0.05),但与NS组比较仍处于低水平(P<0.05)。


图3O-1602或CBD对急性胰腺炎小鼠血浆淀粉酶及脂肪酶活性的影响


图4O-1602或CBD对急性胰腺炎小鼠血浆IL-6及TNF-α水平的影响


图5O-1602或CBD对急性胰腺炎小鼠肺髓过氧化物酶(MPO)活性的影响


图6O-1602或CBD对急性胰腺炎小鼠胰腺组织HSP60mRNA表达的影响
6胰腺组织中HSP60蛋白的表达
与正常组和NS组比较,AP时胰腺组织HSP60蛋白表达水平明显降低(P<0.05)。如同其mRNA的表达一样,在AP+O-1602及AP+CBD组HSP60蛋白的表达较AP组有所升高(P<0.05),且较NS组无明显变化(P>0.05), 见图7。
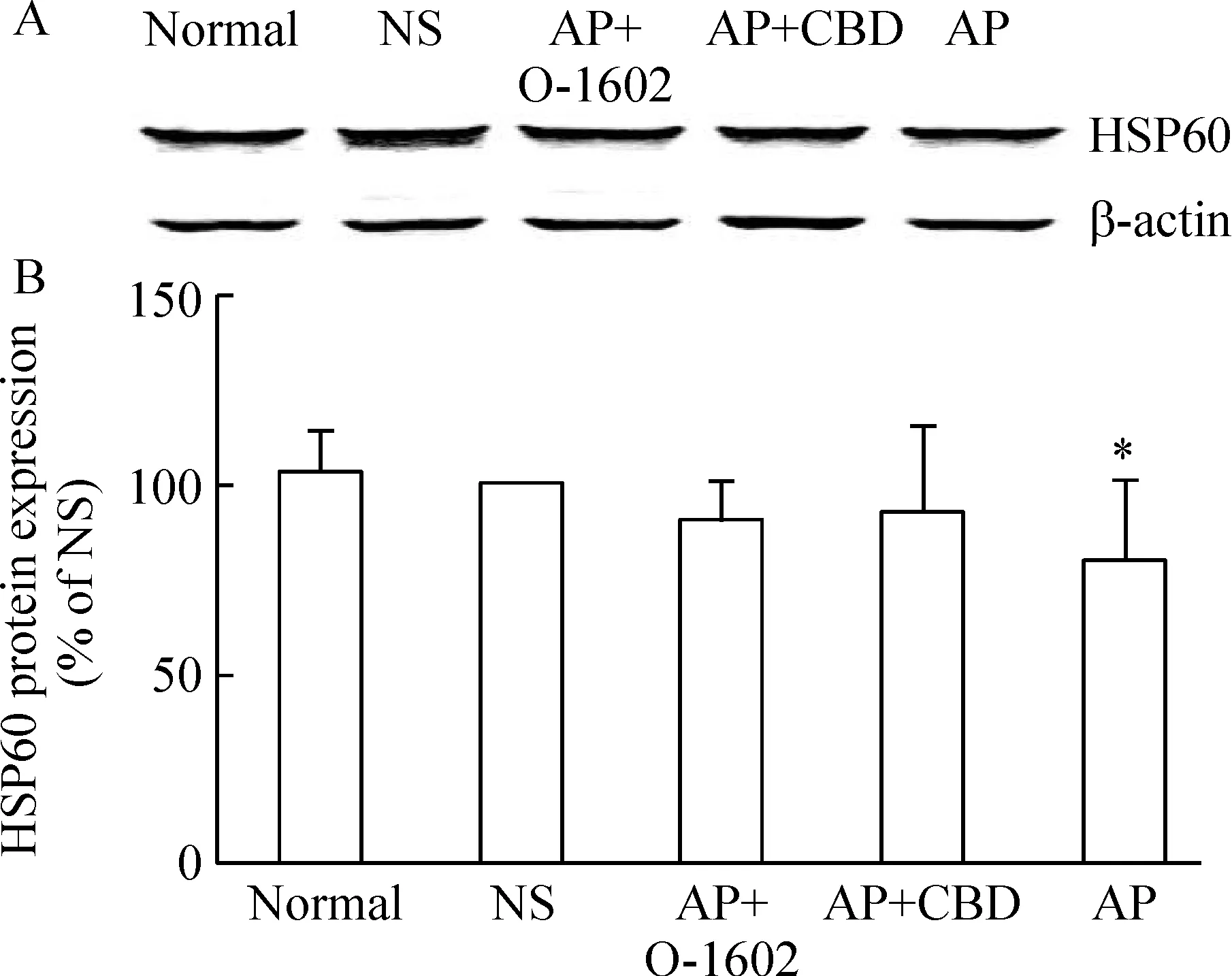

图7O-1602或CBD对急性胰腺炎小鼠胰腺组织HSP60蛋白表达的影响
讨 论
AP是发生在胰腺组织的急性炎症性疾病,有时亦累及胰腺临近脏器和远隔器官,其病理生理过程与许多因素有关,包括胰腺消化酶的激活、炎症介质、细胞因子的大量产生等[12]。CAE是胆囊收缩素(cholecystokinin, CCK)的类似物,有研究揭示它可与胰腺细胞的CCK-A低亲和受体结合,引起胰酶分泌,大剂量时可诱导AP发生[13]。因此,目前已被广泛应用于AP实验研究[4,9,14]。本实验结果证实,经CAE诱发AP,胰腺局部出现明显炎症及损伤,大量胰酶释放入血,同时有血浆促炎细胞因子水平增高,肺部组织也受累,MPO活性增高,提示有明显的炎细胞浸润。
大麻素系统主要包括机体内源性大麻素系统(endo-cannabinoid system,ECS)和外源性大麻类物质。ECS包括大麻素受体、大麻素受体的内源性配体以及相关合成和降解的酶类,在疼痛、炎症、细胞生长死亡以及各种胃肠功能的生理和病理生理过程中起有重要的调节作用[15-20]。大量研究表明,大麻类物质具有抗炎镇痛的作用,其机制与抑制炎症介质、细胞因子的产生密切相关[18-20]。Michalski等[4]用大麻类制剂HU210(CB1和CB2受体激动剂)治疗CAE诱导的急性胰腺炎,发现其不但能减轻胰腺炎引起的腹部疼痛,而且能控制炎症反应,减轻胰腺组织的损伤。Matsuda等[5]研究发现,CB1受体特异性拮抗剂AM251可使牛磺胆酸钠诱导的坏死性胰腺炎大鼠生存时间延长,但其对AP的血清指标(淀粉酶、IL-6等)以及组织局部损伤程度无影响。已有研究发现,CB的另一种受体(非CB1、CB2受体)GPR55存在于人脑与控制记忆、学习和运动功能相关的区域(背侧纹状体,尾状核和壳),也存在于人类回肠、脾、扁桃体、乳房等周围组织[21];我们课题组最近研究发现,胰腺中存在GPR55基因和蛋白的表达,主要在胰腺的腺泡细胞(结果待发表)。本实验应用的新型大麻制剂O-1602认为是GPR55的特异激动剂,它的结构与CBD相似,是否也有CBD一样的控制炎症的作用尚不得知。
本实验看到,给予O-1602及CBD的AP实验组,胰腺局部炎症及损伤均有所改善,血浆淀粉酶、脂肪酶以及细胞因子TNF-α、IL-6水平明显下降,肺组织MPO活性明显降低,全身炎症反应得到缓解,揭示O-1602及CBD均有抗炎作用,其作用相当;同时证实GPR55涉及到炎症的过程,其活性上调具有抑制炎症的作用。目前,已有许多研究证实,大麻类制剂的抗炎作用与其对细胞因子的调节密切相关。Berdyshev等[22]研究显示CB1、CB2受体激动剂Δ9-四氢大麻酚(Δ9-tetrahydrocannabinol,Δ9-THC)及WIN 55212-2均在脂多糖(Lipopolysaccharide, LPS)诱导的小鼠支气管炎模型中起作用,包括剂量依赖性地降低肺泡灌洗液中TNF-α的水平,并伴有中性粒细胞募集作用的减低。由本实验结果也可推测,O-1602及CBD这2种新型大麻制剂可能通过调节促炎细胞因子的产生,控制AP的发生发展。
具有细胞保护效应的热休克蛋白家族(heat shock proteins,HSPs)在AP中的作用目前已有一定的报道。HSP60是热休克蛋白家族中的一员,在胰腺腺泡细胞中,有较多量的HSP60表达[23],且在胰酶分泌通路中HSP60与胰酶关系密切[24,25]。我们近期的研究发现,实验性AP其胰腺组织HSP60表达降低[11],干扰HSP60的表达胰腺组织更易受到CAE、LPS引起的损伤[26]。Lee等[27]预先冷水浸渍诱导大鼠HSP60的高表达可以减轻CAE引起的AP大鼠胰腺的损害,且其机制为HSP60表达增高可使腺泡细胞内组织蛋白酶B移行受阻,从而抑制胰蛋白酶原的胞内激活。有趣的是,大麻素与HSPs之间也有着十分密切的关系。Chen等[28]通过微阵列分析发现,Δ9-THC的神经保护作用与其对HSP60的调节有关。我们的实验揭示,AP时胰腺组织HSP60的基因或蛋白水平表达降低,这与我们以前的实验结果相似;而经O-1602或CBD大麻类制剂处理的AP小鼠,胰腺组织中HSP60的基因和蛋白表达都有明显升高。由此我们推测,这2种大麻类制剂不仅通过已知的大麻素抗炎机制减轻AP的病变程度,也通过促进HSP60的表达以拮抗损伤因子的作用,增加对胰腺的保护效应。
综上所述,2种针对GPR55的大麻类新型制剂O-1602及CBD都能够拮抗CAE诱导的AP及其引发的全身性炎症反应,该作用机制可能与其抑制炎症介质和促炎细胞因子的产生,增强HSP60的表达及其对的细胞保护作用有关。
[1] Pacher P, Batkai S, Kunos G. The endocannabinoid system as an emerging target of pharmacotherapy[J]. Pharmacol Rev, 2006, 58(3):389-462.
[2] Begg M, Pacher P, Bátkai S, et al. Evidence for novel cannabinoid receptors[J]. Pharmacol Ther, 2005, 106(2):133-145.
[3] Smith SR, Terminelli C, Denhardt G. Effects of cannabinoid receptor agonist and antagonist ligands on production of inflammatory cytokines and anti-inflammatory interleukin-10 in endotoxemic mice[J]. J Pharmacol Exp Ther, 2000, 293(1):136-150.
[4] Michalski CW, Laukert T, Sauliunaite D, et al. Cannabinoids ameliorate pain and reduce disease pathology in cerulein-induced acute pancreatitis[J]. Gastroenterology, 2007, 132(5):1968-1978.
[5] Matsuda K, Mikami Y, Takeda K, et al. The cannabinoid 1 receptor antagonist, AM251, prolongs the survival of rats with severe acute pancreatitis[J]. Tohoku J Exp Med, 2005, 207(2):99-107.
[6] Sawzdargo M, Nguyen T, Lee DK, et al. Identification and cloning of three novel human G protein-coupled receptor genes GPR52, ψGPR53 and GPR55: GPR55 is extensively expressed in human brain[J]. Mol Brain Res, 1999, 64(2):193-198.
[7] Esposito G, De Filippis D, Maiuri MC, et al. Cannabidiol inhibits inducible nitric oxide synthase protein expression and nitric oxide production in β-amyloid stimulated PC12 neurons through p38 MAP kinase and NF-κB involvement[J]. Neurosci Lett, 2006, 399(1-2):91-95.
[8] Costa B, Colleonni M, Conti S, et al. Oral anti-inflammatory activity of cannabidiol, a non-psychoactive constituent of cannabis, in acute carrageenan-induced inflammation in the rat paw[J]. Naunyn Schmiedebergs Arch Pharmacol, 2004, 369(3):294-299.
[9] Ryberg E, Larsson N, Sjögren S, et al. The orphan receptor GPR55 is a novel cannabinoid receptor[J]. Br J Pharmacol, 2007, 152(7):1092-1101.
[10]Ding SP, Li JC, Jin C. A mouse model of severe acute pancreatitis induced with caerulein and lipopolysaccharide[J]. World J Gastroenterol, 2003, 9(3):584-589.
[11]Li XL, Li K, Li YY, et al. Alteration of Cpn60 expression in pancreatic tissue of rats with acute pancreatitis[J]. Cell Stress Chaperones, 2009, 14(2):199-206.
[12]Pandol SJ, Saluja AK, Imrie CW, et al. Acute pancreatitis:bench to the bedside[J]. Gastroenterology, 2007, 132(3):1127-1151.
[13]Nakada S, Tsuneyama K, Kato I, et al. Identification of candidate genes involved in endogenous protection mechanisms against acute pancreatitis in mice [J]. Biochem Biophys Res Commun, 2010, 391(3):1342-1347.
[14]Li YY, Ochs S, Gao ZR, et al. Regulation of HSP60 and the role of MK2 in a new model of severe experimental pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297(5):G981-G989.
[15]Marchalant Y, Rosi S, Wenk GL. Anti-inflammatory property of the cannabinoid agonist WIN-55212-2 in a rodent model of chronic brain inflammation[J]. Neuroscience, 2007, 144(4):1516-1522.
[16]Pertwee RG. Cannabinoids and the gastrointestinal tract[J]. Gut, 2001, 48(6):859-867.
[17]Klein TW, Newton C, Larsen K, et al. The cannabinoid system and immune modulation[J]. J Leukoc Biol, 2003, 74(4):486-496.
[18]Sofia RD, Knobloch LC, Vassar HB. The anti-edema activity of various naturally occurring cannabinoids[J]. Res Commun Chem Pathol Pharmacol, 1973, 6(3):909-918.
[19]Sofia RD, Nalepa SD, Harakal JJ, et al. Anti-edema and analgesic properties of Δ9-tetrahydrocannabinol (THC)[J]. J Pharmacol Exp Ther, 1973, 186(3):646-655.
[20]Sofia RD, Nalepa SD, Vassar HB, et al. Comparative anti-phlogistic activity of Δ9-tetrahydrocannabinol,hydrocortisone, and aspirin in various rat paw edema models[J]. Life Sci, 1974, 15(2):251-260.
[21]Godlewski G, Offertáler L, Wagner JA, et al. Receptors for acylethanolamides-GPR55 and GPR119[J]. Prostaglandins Other Lipid Mediat, 2009, 89(3-4):105-111.
[22]Berdyshev E, Boichot E, Corbel M, et al. Effects of cannabinoid receptor ligands on LPS-induced pulmonary inflammation in mice[J]. Life Sci, 1998, 63(8):PL125-PL129.
[23]Cechetto JD,Soltys BJ,Gupta RS.Localization of mitochondrial 60-kD heat shock chaperonin protein(Hsp60) in pituitary growth hormone secretary granules and pancreatic zymogen granules[J].J Histochem Cytochem,2000,48(1):45-56.
[24]李永渝,张 红,张锦生.急性胰腺炎胰酶胞内激活机制中Cpn60的可能作用[J]。中国病理生理杂志,2004, 20(2):170-174.
[25]Li Y, Gingras D, Londono I, et al.Expression differences in mitochondrial and secretory chaperonin 60(Cpn60) in pancreatic acinar cells[J].Cell Stress Chaperons, 2003, 8(3):287-294.
[26]Li YY, Lu S, Li K, et al. Down-regulation of HSP60 expression by RNAi increases lipopolysaccharide- and cerulein-induced damages on isolated rat pancreatic tissues[J]. Cell Stress Chaperones, 2010, 15(6):965-975.
[27]Lee HS,Bhagat L,Frosard JL,et al.Water immersion stress induces heat shock protein 60 expression and protects against pancreatitis in rats[J].Gastroenterology, 2000, 119(1):220-229.
[28]Chen J, Lee CT, Errico SL, et al.Increases in expression of 14-3-3 eta and 14-3-3 zeta transcripts during neuroprotection induced by Δ9-tetrahydrocannabinol in AF5 cells[J]. J Neurosci Res, 2007, 85(8):1724-1733.
EffectsofnewkindsofcannabispreparationsO-1602andcannabidiolonexperimentalacutepancreatitis
FENG Jia-yan, LI Kun, LIN Xu-hong, YU Liang-ying, LI Yong-yu
(DepartmentofPathophysiology,InstituteofDigestiveDisease,TongjiUniversitySchoolofMedicine,Shanghai200092,China.E-mail:liyongyu@tongji.edu.cn)
AIM: To investigate the therapeutic effects of O-1602 and cannabidiol (CBD), the new kinds of cannabis preparations, on caerulein (CAE)-induced acute pancreatitis (AP) in mice.METHODSAP was induced by intraperitoneal injection (ip) of CAE in mice (50 μg/kg hourly with a total of 6 times), and the mice in control group were given normal saline (NS) ip in stead of CAE in the same way. The AP mice were administrated O-1602 or CBD for the therapeutic evaluation by observing the following parameters: pathological changes of pancreatic tissue, plasma activity of amylase and lipase (biochemical methods), the levels of TNF-α and IL-6 in the plasma (ELISA), and the activity of myeloperoxidase (MPO) in the lung (biochemical methods). Meanwhile, real-time PCR and Western blotting were used to evaluate the expression of heat shock protein 60 (HSP60) at mRNA and protein levels, respectively.RESULTSThe pancreatic tissues in AP group appeared obvious edema and neutrophil infiltration, which were significantly improved by treating with AP+O-1602 or AP+CBD. The activity of amylase, lipase and MPO, as well as the levels of TNF-α and IL-6 in AP group significantly increased compared with NS group (P<0.05), while these parameters were significantly lower in AP+O-1602 group and AP+CBD group than those in AP group. Meanwhile, the expression of HSP60 at mRNA and protein levels in pancreas tissues was reduced in AP group (P<0.05), and was improved to some extent after treating with O-1602 or CBD (P<0.05).CONCLUSIONThe O-1602 and CBD show anti-inflammatory effects on CAE-induced AP in mice and the mechanisms might be related to the effects of cannabinoids on inhibiting inflammatory mediators and cytokines, and increasing the expression of cytoprotective factor HSP60.
Acute pancreatitis; Cannabinoids; Heat-shock protein 60
R363.2
A
1000-4718(2011)03-0539-06
2010-10-27
2011-01-11
国家自然科学基金资助项目(No.30971168)
△通讯作者Tel:021-65981021;E-mail:liyongyu@tongji.edu.cn
10.3969/j.issn.1000-4718.2011.03.023

