荧光光度法快速定量大肠杆菌的实验方法研究
管 骁,农卫良,曹 慧,姚 远
(上海理工大学医疗器械与食品学院,上海 200093)
荧光光度法快速定量大肠杆菌的实验方法研究
管 骁,农卫良,曹 慧,姚 远
(上海理工大学医疗器械与食品学院,上海 200093)
研究比较了菌体渗透处理方式与培养方式对大肠杆菌荧光光度法检测效果的影响,以及考察了培养条件对荧光强度的影响,结果表明仅采用渗透处理方式处理菌液会造成荧光检测值偏小,灵敏度偏低;但经LST-MUG(pH7.0)培养液44℃培养7h后的荧光值能对100.9~106.8cells/mL范围内的大肠杆菌进行定量,结果与国标方法无显著性差异。该法进一步缩短了大肠杆菌的检测时间至8h左右,且重现性良好,适合于大肠杆菌的定量检测。
大肠杆菌,快速检测,荧光光度法
大肠杆菌是国际公认的环境水质监测和食品安全中的重要指示菌,世界各国也普遍将大肠杆菌作为公共卫生、环境保护和食品安全领域中强制性的检测内容[1]。目前大肠杆菌的标准定量检测方法主要以多管发酵法和滤膜法为主,这两种方法均存在操作繁琐、检测周期长等不足,很难适应公共卫生、食品安全事件应急处理与快速反应的需要[2]。基于大肠杆菌细胞内存在特异性β-D-葡糖醛酸糖苷酶(β-D-glucuronidase,GUS),并能分解4-甲基伞形酮β-D-葡萄糖苷酸(4-Methylumbelliferyl-β-DGlucuronide,MUG)进而产生荧光产物这一原理,国外已成功建立了环境、食品、水体和临床标本中大肠杆菌的MUG快速检测方法,并将其作为检测大肠杆菌的主要方法之一[3-4]。MUG 快速检测法可将传统方法6~10d的检测时间缩短至16~18h以内,并具有特异性强等优点[4],然而该方法仍存在一些缺陷,如18h左右的检测时间仍偏长,检测限仍有待提高等。为进一步推广该方法的应用,以上缺陷亟需改进,本实验拟从提高GUS的生成释放量及酶解底物效率两个角度出发,分别研究在菌体渗透条件与培养条件下大肠杆菌的荧光检测结果,以及培养条件对荧光强度的影响,为进一步缩短大肠杆菌荧光定量检测时间,降低检测限进行一些探索性研究。
1 材料与方法
1.1 材料与仪器
大肠杆菌标准菌株(ACTT-8099) 由中国科学院微生物研究所提供;4-甲基伞形酮(MU)、4-甲基伞形酮-β-D-葡萄糖醛酸苷(MUG) 购自Sigma公司;曲拉通X-100 购自Farco公司。
VersaFluor荧光分光光度计 美国 bio-rad;TOMY SS-325高温蒸汽灭菌锅;JY92-Ⅱ超声波细胞破碎仪;荧光分光光度计 970CRT;PHSJ-4A pH计。
1.2 试剂及培养基配制
MUG溶液:取50mg MUG溶于50m L已灭菌的0.05mol/L PBS缓冲液中(pH=6.5),避光保存备用。
月桂基硫酸盐胰蛋白肉汤-MUG(LST-MUG)培养液:32g LST培养基溶于1000m L双蒸水,121℃灭菌15m in。冷却后,取1mg/m L MUG溶液25m L加入200m L上述培养基中制得LST-MUG培养基。
脱氧胆酸钠-MUG(DOC-MUG)培养液:分别称取胰蛋白胨4.0g,酵母膏3.0g,氯化钠5.0g,十二烷基硫酸钠0.1g,脱氧胆酸钠1.0g,加蒸馏水至1000m L,充分溶解后调pH至7.8,121℃灭菌15min。冷却后,取1mg/m L MUG溶液25m L加入200m L上述培养基中制得DOC-MUG培养基。
麦康凯培养液:胰蛋白胨20.0g,乳糖10g,氯化钠5.0g,1%结晶紫0.1m L,溶于1000m L双蒸水,调pH至7.4,121℃灭菌15m in。冷却后,加入1%中性红溶液3~4m L。取1mg/m L MUG溶液25m L加入200m L上述培养基中制得麦康凯-MUG培养基。
LB-MUG培养液:胰蛋白胨10.0g,酵母膏5.0g,氯化钠 10.0g,溶于 1000m L双蒸水,调 pH至 7.0,121℃灭菌15m in。冷却后,取1mg/m L MUG溶液25m L加入200m L上述培养基中制得LB-MUG培养基。
菌悬液的制备:将大肠杆菌保存菌株接种于营养琼脂斜面上,37℃培养18h,用生理盐水稀释制成不同浓度菌悬液待用。
1.3 实验方法
1.3.1 大肠杆菌产生荧光光谱分析 将大肠杆菌菌液接入LST-MUG培养液中,同时将不接菌的培养液作为空白对照,然后置于37℃水浴中恒温培养7h后,用970CRT型荧光分光光度计扫描荧光光谱。另将0.375mg/L 4-甲基伞形酮(MU)标准溶液进行荧光扫描以供光谱比对用。
1.3.2 菌体细胞渗透处理条件下荧光光度法检测大肠杆菌 为加快释放大肠杆菌内源性GUS进而酶解底物MUG产生荧光,可对菌体进行渗透处理,包括选用机械裂解(超声方法等)[7]和化学裂解(曲拉通X-100等)[8]等方法破坏细胞膜,促使大肠杆菌内容物释放。
1.3.2.1 超声法处理对荧光强度的影响 取大肠杆菌悬液(约106cells/m L)用超声细胞破碎仪对菌体细胞进行破碎。破碎在冰浴环境中进行,超声程序为:200W工作30s,然后间隙60s,共进行8次。取两份(每份1m L)上述超声处理过的菌悬液,各加入8m L PBS缓冲液(pH=6.5)与1m L MUG溶液,44℃分别保温10、20m in,用NaOH调节pH至10.0。以不接菌种的空白溶液作参比,荧光分光光度计激发波长355nm,发射波长450nm处进行检测。
1.3.2.2 曲拉通X-100处理对荧光强度的影响 取两份1m L大肠杆菌菌悬液(约106cells/m L),各加入8m L PBS与1m L MUG溶液,并添加0.1m L曲拉通X-100使最终曲拉通浓度为1%,混匀后在44℃分别保温10、20m in调pH至10.0,测其荧光强度。
1.3.2.3 超声结合曲拉通X-100处理对荧光强度的影响 取两份1m L超声处理过的菌悬液(约106cells/m L),各加入8m L PBS与1m L MUG溶液,再添加0.1m L曲拉通X-100使最终曲拉通浓度为1%,混匀后在44℃分别保温10、20min调pH至10.0,测其荧光强度。
1.3.3 菌体培养条件下荧光光度法检测大肠杆菌
1.3.3.1 不同培养条件对荧光强度的影响
a.不同培养基对荧光强度的影响 将大肠杆菌菌悬液(1.0×104cells/m L)分别接入DOC-MUG培养液、麦康凯-MUG培养液、LB-MUG培养液和LSTMUG培养液中,同时将对应的不接菌培养液作空白对照,置于37℃恒温培养,每隔1h测其荧光强度。
b.培养液pH对荧光强度的影响 将大肠杆菌菌悬液接入不同 pH(5.0、6.0、7.0、8.0、9.0、10.0)的LST-MUG培养液中,44℃培养,7h后测定培养液的荧光强度。
在另一组实验中,将大肠杆菌菌悬液接入LSTMUG培养液中,44℃培养7h后,再将培养液的pH调至 5.0、6.0、7.0、8.0、9.0、10.0、11.0 后测定荧光强度。
c.培养温度及时间对荧光强度的影响 将大肠杆菌菌悬液接入LST-MUG培养液中,分别置于33、37、40、44、48℃恒温培养1、3、5、7 和9h 后,将培养液pH调至10.0后,测定培养液荧光强度。
1.3.3.2 菌体培养结合细胞渗透处理对荧光强度的影响 将1m L约104cells/m L浓度的大肠杆菌菌悬液接入9m L LST-MUG培养基中,37℃水浴培养7h后,再按1.3.2中步骤分别进行超声处理、曲拉通X-100处理以及超声结合曲拉通X-100处理,将不接菌的LST-MUG培养液作为空白对照检测其荧光强度。
1.3.4 大肠杆菌接种量与荧光强度的关系 将不同浓度(100~105cells/m L)的大肠杆菌接种于 LSTMUG培养液中(pH7.0~7.2),44℃培养7h后加入NaOH调pH至10左右,测定荧光强度。同时将对应的菌悬液采用最大可能数法(GB/T4789.38-2008)进行计数,根据实验结果绘制大肠杆菌总数与荧光强度的对应关系标准曲线。
1.3.5 确证实验 根据所选定的检测条件,检测3份未知浓度的大肠杆菌菌悬液的荧光强度,利用计数标准曲线进行定量,每份样品平行测定5次。同时采用最大可能数法进行定量,验证荧光光度法的准确性。数据分析采用STATISTIC 18.0软件进行。
2 结果与分析
2.1 菌体细胞渗透处理条件下与菌体培养条件下荧光光度法检测大肠杆菌的对比
MUG本身无荧光特性,但其酶解产物MU是一种荧光物质,用紫外灯照射可产生荧光[5]。本实验中MU标准品经荧光扫描,证明激发波长和发射波长分别在325及450nm左右;大肠杆菌的LST-MUG培养液经荧光扫描也发现有荧光产生(激发波长和发射波长分别为355及455nm),但大肠杆菌菌悬液和不接菌的MUG培养液无任何荧光,这说明大肠杆菌在培养过程中产生的酶能分解MUG并产生MU,这是荧光法定量大肠杆菌的理论基础。其中激发波长发生红移现象可能是由培养液自身颜色、菌体浊度及其他因素干扰造成的。因此后面的实验将确定激发波长和发射波长分别为355和450nm。
超声波具有空化效应,曲拉通X-100则是一种非离子表面活性剂兼荧光增敏剂,这两种方式均能有效破坏生物膜,从而促使细胞内容物的释放[6-7]。由图1结果可知,未进行任何处理的大肠杆菌液与MUG共孵育,在20m in内未见明显荧光;但经超声法或曲拉通X-100等处理后荧光明显,结果如图1所示,证实了这两种处理都可使大肠杆菌释放出内源性β-D-葡萄糖醛酸酶并分解MUG而产生荧光物质。若超声法与曲拉通同时使用,比单独使用任一方式的荧光值均略有升高。虽然通过这两种菌体渗透处理方式能检测到荧光,并很大程度上缩短了检测时间(0.5h内就可检出),但总体而言检测效果并不理想,检测到的荧光值均偏小(低于700),且测定过程中发现荧光不稳定,测定误差较大,这可能是由于菌液中大肠杆菌量少,产生的GUS过少且活性不高造成的。
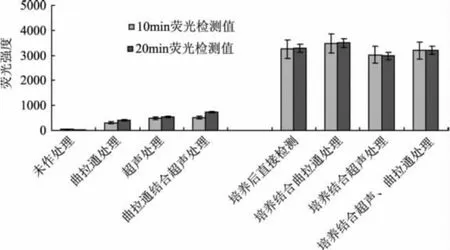
图1 不同处理条件下的大肠杆菌荧光检测结果
为进一步增大荧光强度,减小误差,对大肠杆菌在LST-MUG中进行了7h的培养后检测荧光值,结果如图1所示,培养液的荧光强度比不培养显著增强,由此说明大肠杆菌在培养期间有大量的GUS产生,并能从菌体中释放出来且活性较高。但在培养基础上再进行超声破碎、添加曲拉通等处理与培养后直接检测荧光强度差异不显著(最大偏差4.29%),这说明在菌体培养期间GUS已大量释放,进一步使用超声破碎、添加曲拉通等处理对促进GUS的释放没有明显效果,而且培养结合超声处理的荧光值比培养后直接检测的还低,由此说明超声、曲拉通等可能会造成酶的失活以及影响荧光检测等,所以下一步的实验采用菌体培养后直接检测的方法进行,此方法比菌体渗透处理方式更为灵敏,有利于检测限的降低。
2.2 培养条件对荧光检测的影响
2.2.1 不同培养基对大肠杆菌生长及荧光强度的影响 考察了四种不同培养液(DOC培养液、麦康凯培养液、LB培养液和LST培养液)分别培养大肠杆菌对荧光强度的影响,结果如图2所示。从图中可以看出培养基的选择对荧光强度有很大影响,培养3h后LST培养液荧光强度显著增强,DOC培养液和LB培养液也有所增加,但麦康凯培养液几乎没有增长;培养5h后LST培养液的荧光强度接近一个高值,进一步延长培养时间荧光强度不再增加,DOC培养液和LB培养液荧光值在5h后也渐趋稳定。在培养5h时对四种培养液中的大肠杆菌数进行了测定,发现LST培养液中菌数达到约4×107cells/m L,其次是DOC培养液(约7×106cells/m L),麦康凯培养液中菌数(约1.2×106cells/m L)甚至比LB培养液中还大(0.8×106cells/m L)。根据大肠杆菌的生长结果与荧光强度的变化趋势,说明在不同培养基条件下荧光强度并非和大肠杆菌数量呈严格的一一对应关系,同时还会受其他因素的干扰。如麦康凯培养液尽管对大肠杆菌5h的增殖效果比LB培养液更理想,但反映出的荧光强度反而较小,可能是由于麦康凯培养基中的一些成分抑制β-D-葡萄糖醛酸酶的产生与释放[8],而大肠杆菌在LST培养液中生长最好,且荧光强度也明显强于其他几种培养基,是一种理想的荧光检测用培养液。
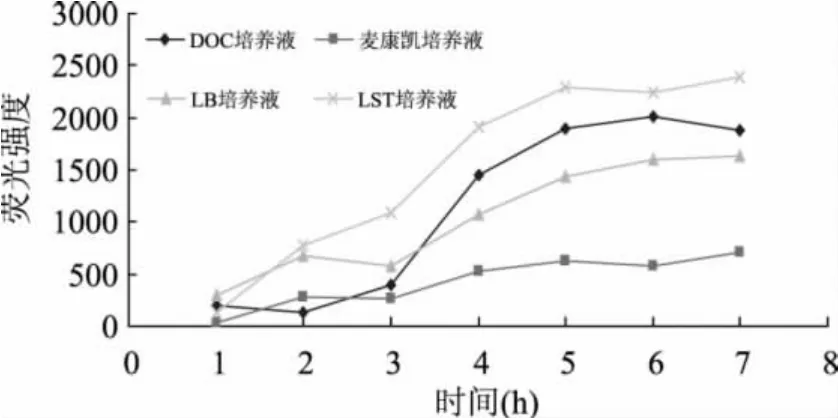
图2 不同培养基对荧光强度的影响
2.2.2 培养基pH对荧光强度的影响 采用不同pH的LST-MUG培养液培养大肠杆菌后检测其荧光强度,结果如图3所示。从图中可看出,pH低于7时随pH的升高荧光强度明显增加,在pH7.0左右荧光强度最高,进一步提高pH荧光强度又急剧降低,这是由于不适当的pH会显著抑制大肠杆菌的生长,并影响GUS的产生;另外,GUS的最适pH在6.5左右[8],pH过高或过低会降低酶的活性,甚至失活。
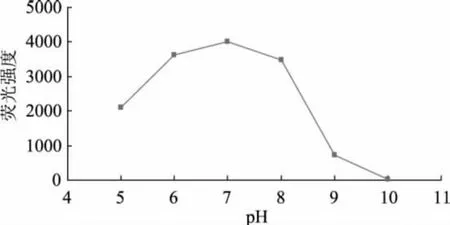
图3 不同pH条件下培养对荧光强度的影响
大肠杆菌接种到LST-MUG培养液(pH7.0)中培养7h后再调整到不同的pH进行荧光强度的测定,结果如图4所示。从图4中可看出,培养液的荧光强度在pH为5~10范围内明显发生变化,随着pH的增加而上升;当pH>10时,荧光强度趋于稳定。由此可知荧光产物MU在碱性条件下有较强荧光,因此菌体培养结束后可通过提高培养液的pH来增强荧光强度,进而提高检测灵敏度,这与Maddocks[8]等人的研究结果类似。由此可见,采用pH为7.0的LST培养基对大肠杆菌进行培养,待培养结束后,再调整pH至10进行荧光强度检测是较好的操作条件。
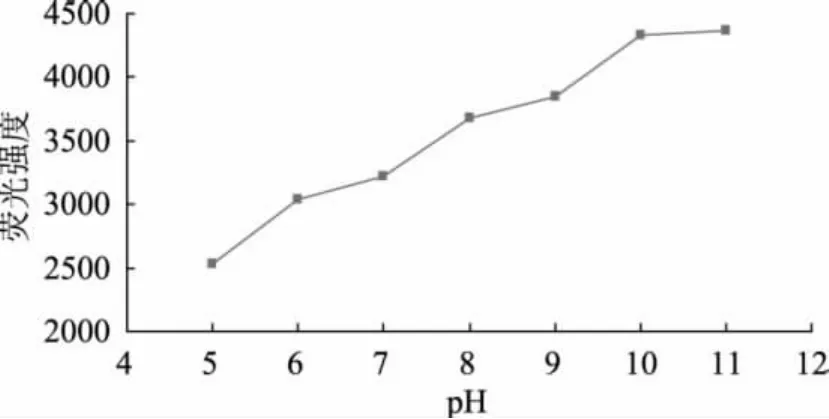
图4 pH对荧光强度测定的影响
2.2.3 培养温度及时间对荧光强度的影响 大肠杆菌的生长温度为10~45℃,最适温度为37℃[9]。大肠杆菌在LST-MUG培养液中进行不同温度的培养,荧光强度变化如图5所示。由图5可看出,在33与37℃的培养条件下荧光强度在4h内快速增加,超过4h后趋于稳定;而在40℃下培养,其荧光值明显偏低;44℃培养时,培养液荧光强度不断增加,7h左右达到稳定且强度超过33与37℃的高值;48℃下培养液基本无荧光现象。出现这种现象的可能原因是:温度不仅关系着大肠杆菌的生长状况,进而影响GUS的生成与释放量,同时还关系到GUS对MUG的酶解作用,因此对荧光强度影响较大。44℃尽管不是大肠杆菌的最适生长温度,但此温度可能更有利于GUS从大肠杆菌中的释放,以及GUS在此温度下能表现出高活性[10-11],MUG 被分解得最彻底,荧光强度故而最大。由此可见采用44℃培养是最佳反应条件。
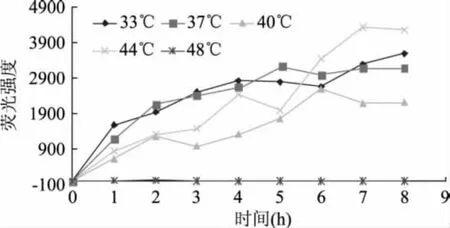
图5 培养温度对荧光强度的影响
2.3 大肠杆菌接种量与荧光强度的关系
为确证在优化的实验条件下荧光光度法定量检测大肠杆菌的可行性,对大肠杆菌接种量与荧光强度的对应关系进行了实验,结果如图6所示。在100.9~106.8cells/m L的菌浓范围内,荧光强度与大肠杆菌接种量表现出良好的线性关系Y=731.03 lgX-783.69(R2=0.9567);若接种量在 102.5~105.5cells/m L范围内,两者的线性关系进一步提高(R2=0.9893,数据未显示),说明在本实验确定的最优检测条件下,荧光强度大小与大肠杆菌呈一一对应关系,因此采用荧光光度法对大肠杆菌进行定量是完全可行的。
2.4 确证实验
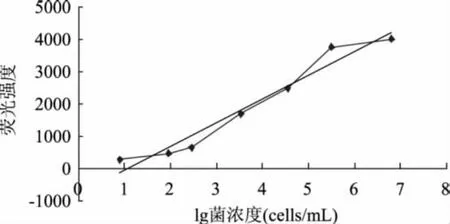
图6 大肠杆菌接种量与荧光强度的关系
分别采用荧光光度法和最大可能数法(GB/T4789.38-2008)对三份未知浓度的大肠杆菌菌悬液进行定量测定,结果如表1所示。三份样品的测定结果表明,两种测定方法之间无显著性差异,且荧光光度法平行测定的相对标准偏差最大为27.1%,低于最大可能数法的31.4%,表明荧光光度法在大肠杆菌的快速定量中准确度与精度均较高,结果可信。
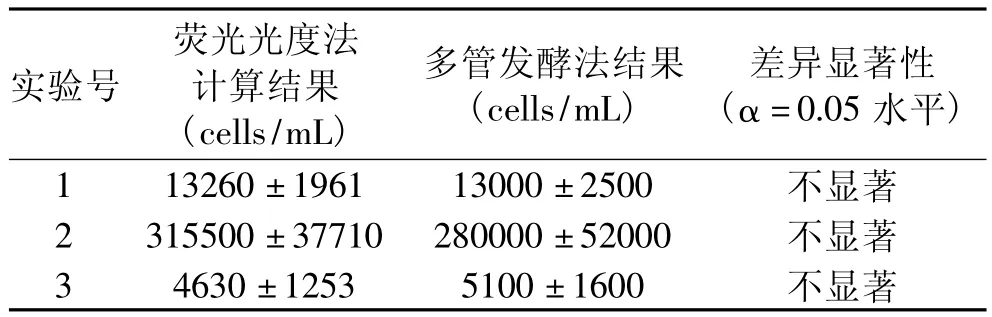
表1 荧光光度法与最大可能数法定量结果比较
3 结论
根据本实验分析结果可知,大肠杆菌在超声处理或曲拉通X-100等渗透处理条件下均可释放出GUS并分解MUG产生荧光,但荧光效应偏弱,误差较大,无法满足常规的大肠杆菌定量要求。而将菌体进行培养后再检测能很好解决这一问题,最佳操作条件为:采用pH为7.0的LST-MUG培养基在44℃对菌体培养7h后,调整pH至10,此时培养液的荧光强度与大肠杆菌接种量(100.9~106.8cells/m L范围内)呈良好的线性关系。该处理条件进一步缩短了检测时间,包括前处理及测定步骤整个过程约8h,最低检测限降至100.9cells/m L。当然,由于本次实验采用的是标准大肠杆菌菌悬液为测试样本,干扰因素较少取得了理想的效果,但对组成复杂的环境或食品测试样本效果如何以及可行的解决措施,有待于下一步的研究。
[1]Elmund G K,Allen M J,Rice E W.Comparison of Escherichia coli,total coliform,and fecal coliform populations as indicators of wastewater treatment efficiency[M].Water Environment Research,1999,71(3):332-339.
[2]陈盼,贺稚非,龚霄,等.食品中大肠杆菌的快速检测方法[J].食品工程,2008(1):58-61.
[3]Ibrahim C,Hilal B D,Kadir H,et al.An alternative approach for enumeration of Escherichia coli in foods [J].International Journal of Food Microbiology,2001,68(3):217 -223.
[4]Dogan H B,Cakir I,Baspinar E.Comparison of LST+MUG broth technique and conventional method for the enumeration of Escherichia coli in foods [J].Letters in Applied Microbiology,2002,34(4):274-278.
[5]Garcia-Armisen1 T,Lebaron P,Servais1 P.β -D -glucuronidase activity assay to assess viable Escherichia coli abundance in freshwaters[J].Letters in Applied Microbiology,2005,40:278-282.
[6]刘绍荣,董灵英.离子表面活性剂曲拉通X-100对荧光增敏作用机理的探讨 [J].分析化学,1987,12(15):1086 -1089.[7]张荆,童群义.超声波破碎提取D-甘露糖异构酶条件的研究[J].食品工业科技,2009,10(30):247-249.
[8]Maddocks J L,Greenan M J.A rapid method for identifying bacterial enzymes[J].Journal of Clinical Pathology,1975,28:686-687.
[9]郑晶,黄晓蓉,汤敏英,等.荧光法快速检测蔬菜中大肠杆菌[J].食品科学,2006,27(10):480-484.
[10]Caruso G,Crisafi E,Mancuso M.Development of an enzyme assay for rapid assessment of Escherichia coli in seawaters.[J]Journal of Applied Microbiology,2002,93:548-556.
[11]Garcia-Armisen1 T,Lebaron P,Servais1 P.β -D -glucuronidase activity assay to assess viable E.coli abundance in freshwaters[J].Letters in Applied Microbiology,2005,40:278-282.
Study on the rapid enumeration of Escherichia coli with fluorescent method
GUAN Xiao,NONG Wei-liang,CAO Hui,YAO Yuan
(School of Medical Instrument and Food Engineering,University of Shanghai for Science and Technology,Shanghai200093,China)
The effect of osmotic treatment and culture on the detection of E.coli with fluorescent method were discussed respectively,and the effect of culture conditions on fluorescent intensity also investigated.The results indicated that only osmotic treatment for E.coli would cause small fluorescent intensity and low detection sensitivity.However,fluorescent intensity obtained under the conditions of cultured for 7h at 44℃ in the LST-MUG culture medium could quantified the E.coli in the range of 100.9~106.8cells/m L,and the results obtained by this method and standard method showed no significant difference.Optimized fluorescent method shortened the detection time to 8h,and showed good reproducibility.Therefore,the method described is applicable to the rap id enumeration of E.coli.
Escherichia coli;rapid detection;fluorescence method
TS207.4
A
1002-0306(2011)09-0403-05
2010-09-20
管骁(1979-),男,博士,讲师,研究方向:食品安全快速检测。
上海市联盟计划项目(09LM42);上海市研究生创新基金项目(JWCXSL0902);上海市松江区博士后创新基地项目。

