苹果多酚的提取及抗氧化活性研究
郭娇娇,方 敏,林利美,宫智勇,*
(1.武汉工业学院食品科学与工程学院,湖北 武汉 430023;2.华中科技大学同济医学院公共卫生学院营养与食品卫生系,湖北 武汉 430030)
苹果多酚的提取及抗氧化活性研究
郭娇娇1,方 敏2,林利美1,宫智勇1,*
(1.武汉工业学院食品科学与工程学院,湖北 武汉 430023;2.华中科技大学同济医学院公共卫生学院营养与食品卫生系,湖北 武汉 430030)
通过单因素及正交试验,对苹果多酚的提取工艺进行研究。确定苹果多酚的最佳提取工艺为乙醇体积分数30%、温度70℃、料液比1:6、提取时间45min,此时苹果多酚的含量为9.032mg/g。采用DPPH法和亚铁还原能力(ferric reducing ability of plasma,FRAP)法对苹果多酚的抗氧化活性进行研究,结果显示,它对DPPH自由基的清除率达到94.6%,此时其FRAP值为546.4μmol/L。
苹果多酚;抗氧化;DPPH自由基;亚铁还原能力(FRAP)
苹果,蔷薇科落叶乔木。苹果中含有丰富的营养成分,位于我国四大水果之首[1]。苹果成分复杂,含有多酚类、黄酮类、色素类等多种成分[2],苹果多酚是从苹果中提取出来的天然的抗氧化剂,其主要成分为类黄酮类化合物。很多研究表明,苹果多酚具有重要的生物活性物质和多种药理功能,具有减少和消除自由基、抗氧化、抗脂质过氧化、抗菌、保护软骨、增强骨质、抗肿瘤、防辐射、抗动脉硬化等生理活性[3-6]。因此,开发和利用苹果多酚具有一定实用价值。
近来年,关于苹果中多酚的提取及抗氧化活性的研究较多,但是方法和结果都不尽相同。为此,本实验在前人研究的基础上,通过采用乙醇回流法[7-8]提取苹果中的生物活性物质-多酚,采用Folin-ciocalteu法[9]对多酚的含量进行检测,探讨此方法提取的最优条件,为苹果中活性物质的提取提供参考。同时采用DPPH法和亚铁还原能力(ferric reducing ability of plasma,FRAP)法初步研究苹果多酚提取液的抗氧化活性,为进一步开发利用苹果提供可靠的科学依据。
1 材料与方法
1.1 材料与试剂
红富士苹果 市购。
DPPH(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl))、TPTZ(1,3,5- tri(2-pyridyl)-2,4,6-triazine) 美国Sigma公司;没食子酸 中国药品生物制品检定所;所用试剂均为分析纯。
1.2 仪器与设备
7200可见分光光度计、UV型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;Ar2140型电子天平 沈阳龙腾电子有限公司;HH-2数显恒温水浴锅 国华电器有限公司;SHZ-D(Ⅲ)型循环水式真空泵 巩义市英峪予华仪器厂;旋转蒸发器、SZ-93自动双重纯水蒸馏器 上海亚荣生化仪器厂;KQ-250DB型数控超声波清洗器 昆山市超声仪器有限公司;DNP-9082型电热恒温培养箱 上海精密试验设备有限公司。
1.3 方法
1.3.1 材料处理
新鲜红富士苹果,实验前切碎匀浆,现制现用。
1.3.2 没食子酸标准曲线的绘制
采用Folin-ciocalteu法[9],利用紫外可见分光光度计在760nm波长处、以1cm比色皿,测定吸光度。以吸光度为纵坐标,质量浓度(mg/mL)为横坐标,绘制没食子酸标准曲线,其线性回归方程为:Y=121.14x+0.0171,R2= 0.9991。
1.3.3 苹果多酚的提取及含量测定
精确称取切碎匀浆后的新鲜苹果8.00g,用40mL 20%乙醇在70℃回流提取45min,过滤,真空浓缩干燥得粗多酚样品,用双蒸水定容至50mL,即为所得多酚提取液。然后按照绘制标准曲线的方法操作,测定样品中的吸光度,带入回归方程,计算出苹果中多酚的含量。
1.3.4 苹果多酚提取的单因素和正交试验
利用乙醇回流法,选取提取温度、提取时间、料液比(g/mL)、乙醇体积分数为影响因素,进行单因素试验,然后根据单因素试验结果设计正交试验,依据标准曲线的测定方法测定提取液的吸光度,并根据线性回归方程计算苹果多酚提取率,以苹果多酚提取率为考察指标,确定苹果多酚提取最佳工艺条件。
1.3.5 苹果多酚抗氧化活性的测定
1.3.5.1 对DPPH自由基的清除作用[10-12]
DPPH法是利用DPPH溶液的特征紫红色团的吸收峰,以分光光度法测定加抗氧化剂或植物提取液后吸光度吸收的下降表示其对有机自由基清除能力[13]。本实验在正交试验最佳提取工艺条件下提取苹果多酚,过滤,真空浓缩干燥得粗多酚样品,用双蒸水配制成一定浓度的苹果多酚溶液,依据参考文献[7]中的方法测定苹果多酚对DPPH自由基的清除率。测定时每个样品进行3次平行实验。

式中:Ai为2mL DPPH溶液+2mL苹果多酚提取液的吸光度;Aj为2mL苹果多酚提取液+2mL无水乙醇的吸光度;Ac为2mL DPPH溶液+2mL无水乙醇的吸光度。
1.3.5.2 FRAP 法测定苹果多酚的总抗氧化能力[14]
苹果多酚的总抗氧化能力测定采用FRAP法。Fe3+吡啶三吖嗪可被样品中的还原物质还原为二价铁形式,呈现出蓝色,于593nm波长处具有最大吸收光,根据所得吸光度的大小计算样品抗氧化活性的强弱。TPTZ工作液的配制[15]:将2.5mL 20mmol/L FeCl3·6H2O,2.5mL 10mmol/L TPTZ(以40mmol/L盐酸溶解),25mL 0.3mmol/L的醋酸缓冲液(pH3.6),临用前混合。
FeSO4标准曲线绘制:分别取不同质量浓度的FeSO4溶液各0.3mL,各加入2.7mL预热至37℃的TPTZ工作液,摇匀后放置10min,于593nm处测其吸光度。以吸光度为纵坐标,FeSO4质量浓度为横坐标绘制标准曲线,结果如图2,其线性回归方程为:Y=0.0041X+0.0197,R2= 0.995。
样品总抗氧化能力的测定:准确吸取苹果多酚样品溶液0.3mL,加入2.7mL 预热至37℃的TPTZ工作液。摇匀后放置10min,于593nm 波长处测其吸光度(用无水乙醇作为参比)。以无水乙醇代替样品加入FRAP工作液作为空白,每个稀释度做3次平行试验。由反应后A值在标准曲线上获得的相应的FeSO4浓度(μmol/L)定义为FRAP值。FRAP值越大,抗氧化活性越强[16]。
2 结果与分析
2.1 苹果多酚提取单因素试验
2.1.1 提取温度对苹果多酚提取效果的影响
准确称取8g新鲜苹果匀浆5份,加入20%乙醇40mL,分别在40、50、60、70、80℃下,回流提取45min,过滤,真空浓缩干燥得粗多酚样品,用双蒸水定容至50mL,即为所得多酚提取液,然后按照绘制标准曲线的方法操作,测定样品中的吸光度,结果见图1。

图1 提取温度对苹果多酚提取效果的影响Fig.1 Effect of extraction temperature on yield of apple polyphenols
由图1可知,随着温度的升高,苹果多酚的提取效果先降低后升高,然后又降低,在提取温度为70℃,苹果多酚的提取效果最好。
2.1.2 提取时间对苹果多酚提取效果的影响
准确称取8g新鲜苹果匀浆5份,加入20%乙醇40mL,在70℃分别回流提取30、45、60、75、90min,过滤,真空浓缩干燥得粗多酚样品,用双蒸水定容至50mL,即为所得多酚提取液,然后按照绘制标准曲线的方法操作,测定样品中的吸光度,结果见图2。

图2 提取时间对苹果多酚提取效果的影响Fig.2 Effect of extraction time on yield of apple polyphenols
由图2可知,在提取时间45min时,苹果多酚的提取效果最好,随着时间的延长,吸光度有所降低,原因可能是随着时间的延长,苹果中其他醇溶性物质同时被溶解提取,这些物质的存在影响试验的提取效果。
2.1.3 料液比对苹果多酚提取效果的影响
准确称取8g新鲜苹果匀浆5份,分别加入20%乙醇16、24、32、40、48mL,在70℃回流提取45min,过滤,真空浓缩干燥得粗多酚样品,用双蒸水定容至50mL,即为所得多酚提取液,然后按照绘制标准曲线的方法操作,测定样品中的吸光度,结果见图3。

图3 料液比对苹果多酚提取效果的影响Fig.3 Effect of material/liquid ratio on yield of apple polyphenols
由图3可知,随着提取液用量逐渐增加,苹果多酚的提取效果越来越好,当料液比为1:6(g/mL)时,提取效果最好。
2.1.4 乙醇体积分数对苹果多酚提取效果的影响
准确称取8g新鲜苹果匀浆5份,分别加入0%、10%、20%、30%、40%乙醇40mL,在70℃回流提取45min,过滤,真空浓缩干燥得粗多酚样品,用双蒸水定容至50mL,即为所得多酚提取液,然后按照绘制标准曲线的方法操作,测定样品中的吸光度,结果见图4。

图4 乙醇体积分数对苹果多酚提取效果的影响Fig.4 Effect of ethanol concentration on yield of apple polyphenols
由图4可知,随乙醇体积分数的升高,提取率先增后减,苹果多酚最佳提取效果对应的乙醇体积分数20%。原因可能是提取溶剂中乙醇含量不同,极性也不同。
2.2 苹果多酚提取的正交试验结果
以提取温度、提取时间、料液比、乙醇体积分数4因素进行正交试验设计,确定苹果多酚提取的最佳条件,试验因素水平见表1,根据表1进行正交设计,选用正交表L9(43),正交试验结果和方差分析见表2和表3。

表1 苹果多酚提取正交试验因素水平表Table 1 Factors and their coded levels in orthogonal array design
由表2可知,各影响因素的影响次序为乙醇体积分数>提取温度>料液比>提取时间,其中乙醇体积分数为最主要的影响因素,最佳组合为A3C1B1D1,即用30%乙醇、料液比1:6、温度70℃的条件提取45min最合适,此时,苹果多酚的含量为9.032mg/g。由于提取时间(D)对提取率影响最小,故其在方差分析表中作为误差项。
由表3可知,FA>F0.05(2,2),FB<F0.05(2,2),FC<F0.05(2,2),所以乙醇体积分数(A)对提取率影响显著,料液比(B)和提取温度(C)对提取率影响不显著。

表2 苹果多酚提取L9(43)正交试验设计及结果Table 2 Orthogonal array design L9(43) and corresponding experimental results

表3 正交试验方差分析表Table 3 Variance analysis of yield of apple polyphenols with various extraction conditions
2.3 苹果多酚对DPPH自由基的清除作用
设计稀释倍数为0、1、10、20倍,清除率见图5。
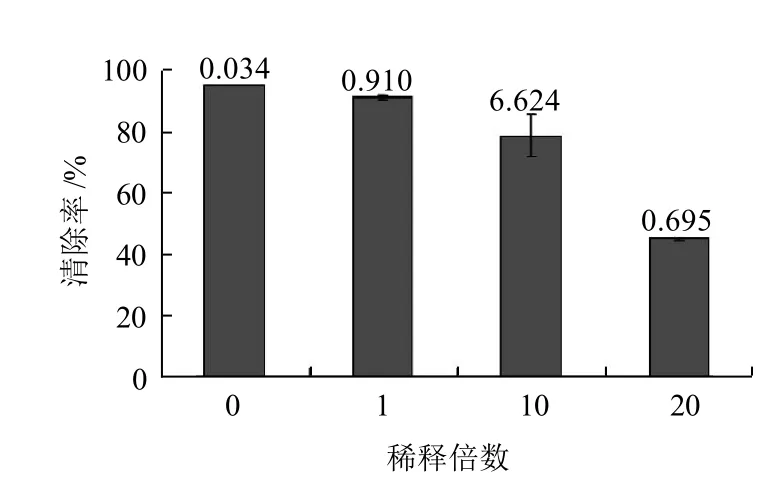
图5 不同浓度的苹果多酚对DPPH自由基的清除率Fig.5 DPPH free radicals scavenging rates of apple polyphenols at different concentrations
由图5可知,苹果多酚提取液对DPPH自由基的清除率随着稀释倍数的增加,清除率逐渐下降。
2.4 FRAP法测定苹果多酚的总抗氧化能力设计稀释倍数为0、1、10、20倍,FRAP值见图6。由图6可知,随着稀释倍数的增加,FRAP值逐渐降低,但都比空白对照组的值要高。

图6 不同浓度苹果多酚的FRAP值Fig.6 FRAP values of apple polyphenols at different concentrations
3 结 论
本实验对苹果多酚的提取工艺进行探讨,得出苹果中多酚的最佳提取条件为:乙醇体积分数30%、提取温度70℃、料液比1:6、提取时间45min,此时苹果多酚的含量为9.032mg/g,其中乙醇体积分数对多酚提取的影响显著,提取温度和料液比对其影响不显著。然后对在最优条件下提取得到的苹果多酚提取液进行抗氧化实验,得出其对DPPH自由基的清除率为94.6%,并且随着稀释倍数的增加,清除率逐渐降低,其总抗氧化能力FRAP值为546.4μmol/L,随稀释倍数的增加,FRAP值也逐渐降低,均表现出良好的抗氧化作用。
[1] 边文华. 果品南北货实用手册[M]. 上海: 上海科学出版社, 1982.
[2] 梁峙. 苹果多酚的功效研究与应用[J]. 农牧产品开发, 1998(6): 18-19.
[3] 唐传核, 彭志英. 苹果多酚的开发与应用[J]. 中国食品添加剂, 2001(2): 41-44.
[4] YINRONG L, YEAP F L. Antioxidant and radical scavenging activities of plyphenols from apple pomace[J]. Food Chemistry, 2000, 68(1): 81-85.
[5] 戚向阳, 王小红, 容建华. 不同苹果多酚提取物清除·OH效果的研究[J]. 食品工业科技, 2001, 22(4): 7-9.
[6] YANGGAIDA A, KANDA T, TANABE M, et al. Inhibitory effects of apple polyphenols and related compounds on cariogenic factors of mutans streptococci[J]. Journal of Agricultural and Food Chemistry, 2000, 48(11): 5666-5671.
[7] 高晓明, 吕磊, 王瑞, 等. 苹果多酚的乙醇提取和大孔树脂纯化工艺研究[J]. 食品研究与开发, 2009, 30(11): 21-25.
[8] 陈莹, 徐抗震, 聂威, 等. 苹果生果中苹果多酚提取工艺的优化研究[J]. 应用化学, 2009, 38(11): 1582-1585.
[9] SUAREZ B, ALVAREZ A L, GARCIA Y D, et al. Phenolic profiles,antioxidant activity and in vitro antiviral properties of apple pomace[J].Food Chemistry, 2010, 120(1): 339-342.
[10] 胡喜兰, 韩照祥, 陶莹, 等. DPPH·法测定17种植物的抗氧化活性[J]. 食品科技, 2006, 31(2): 4-5.
[11] LARRAURI J A, SANCHEZ-MORENO C, SAURA-CALIXTO F.Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. Agric Food Chem, 1998, 46(7): 2694-2697.
[12] YOKOZAWA T, DONG E, NATAGAWA T, et al.In vitroandin vivostudies on the radical-scavenging activity of tea[J]. Agric Food Chem,1998, 46(6): 2143-2150.
[13] 彭长连, 陈少薇, 林植芳, 等. 用清除有机自由基DPPH法评价植物抗氧化力[J]. 生物化学与生物物理, 2006, 27(6): 15-17.

[15] 刘芸, 仇农学, 杨玺玉. 葡萄皮渣提取物总酚含量及体外抗氧化活性、抑菌活性[J]. 食品科学, 2011, 32(1): 5-9.
[16] 方敏, 占才贵, 宫智勇. 玉米须总黄酮的提取与抗氧化活性研究[J].食品科学, 2009, 30(18): 206-208.
Extraction and Antioxidant Properties of Polyphenols from Apple
GUO Jiao-jiao1,FANG Min2,LIN Li-mei1,GONG Zhi-yong1,*
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China;2. Department of Nutrition and Food Hygiene, School of Public Health, Tongji Medical College,Huazhong University of Science and Technology, Wuhan 430030, China)
One-factor-at-a-time coupled with orthogonal array design method was employed to optimize the extraction of polypehnols from apple. The optimal extraction conditions were determined as follows: 30% ethanol as the extraction solvent at a material/liquid ratio of 1:6, 70 ℃ temperature and 45 min extraction time. Under these conditions, the extraction yield of polyphenols from apple was 9.032 mg/g. The DPPH radical scavenging rate of apple polyphenols extracted was 94.6% and the FRAP 546.4 μmol/L.
apple polyphenols;antioxidant properties;DPPH free radicals;FRAP assay
R284.2
A
1002-6630(2011)20-0095-04
2011-06-28
国家“863”计划项目(2010AA023003)
郭娇娇(1985—),女,硕士研究生,研究方向为食品安全。E-mail:guojiaojiao3344@126.com
*通信作者:宫智勇(1966—),男,副教授,博士,研究方向为食品营养与毒理。E-mail:gongzycn@yahoo.com

