直接竞争化学发光酶免疫法检测猪肉中磺胺嘧啶
楚金申,许 杨*,何庆华,王刘花,卢 江
(食品科学与技术国家重点实验室,南昌大学中德联合研究院,江西 南昌 330047)
直接竞争化学发光酶免疫法检测猪肉中磺胺嘧啶
楚金申,许 杨*,何庆华,王刘花,卢 江
(食品科学与技术国家重点实验室,南昌大学中德联合研究院,江西 南昌 330047)
建立一种检测猪肉中磺胺嘧啶的简便、快速、高特异性的直接竞争化学发光酶免疫法。采用改良的过碘酸钠法制备酶标抗体,以辣根过氧化物酶催化鲁米诺-过氧化氢作为化学发光体系。经优化该方法检测条件为:利用柠檬酸缓冲液稀释抗原包被质量浓度为0.8μg/mL,酶标抗体2000倍稀释,竞争反应25min;所建立的方法分析灵敏度为2.96ng/mL,批内变异系数小于8.32%,批间变异系数小于13.4%,以猪肉为样品的分析回收率为75.6%~103.7%,与其他结构类似物未见明显交叉,所建立的标准曲线相关系数为0.9922、检测线性范围为4.14~244ng/mL、检测时间为25min,可在实际生产中应用。
磺胺嘧啶;直接竞争化学发光酶免疫法;辣根过氧化物酶;猪肉
磺胺类药物是人工合成的一类具有对氨基苯磺酰胺共同母核结构的广谱抗菌药物,广泛应用于畜禽抗感染治疗,有时也作为动物饲料添加剂促进生长[1]。该类药物的毒副作用非常明显,据报道它与痘疮的发病紧密相关,具有肾毒性[2],而且可以在动物体内残留,通过动物源性食品进入食物链直接威胁人类的身体健康。磺胺嘧啶是磺胺类药物残留物中典型的一种[3],其分子结构式如图1所示。我国与欧盟规定动物源性食品中磺胺类药物总量的最高残留限量为100μg/mL[4-5]。

图1 磺胺嘧啶结构式Fig.1 Chemical structure of sulfadiazine
目前常用的检测磺胺嘧啶(sulfadiazine,SD)的方法主要有高效液相色谱(high performance liquidchromatography,HPLC)法[6]、气相色谱-质谱联用法(gas chromatograph-mass spectrometry,GC-MS)[7]和酶联免疫吸附法(engyme-linked immuno-sorbent assay,ELISA)[8]等。前两种方法灵敏、准确,但耗时、费力、成本高且需要昂贵的设备和专业的人员操作;酶联免疫吸附法快速、特异性好,但灵敏度不够高。直接竞争化学发光酶免疫法省略了间接竞争方法中加二抗的步骤,节约检测时间,既具有放射免疫法的高灵敏度,又具有酶联免疫法操作简便、快速的特点,线性范围宽、测试中无需使用对人体有害的试剂[9]。
本研究制备抗磺胺嘧啶酶标抗体,建立直接竞争酶联免疫分析法(direct competitive-engyme-linked immunosorbent assay,DC-ELISA),并采用鲁米诺化学发光体系建立直接竞争化学发光酶免疫法(direct competitive chemiluminescence enzyme immunoassay,DC-CLEIA)。
1 材料与方法
1.1 材料、试剂与仪器
猪肌肉 市购。
磺胺嘧啶单克隆抗体腹水 自制;磺胺嘧啶(sulfadiazine,SD)、磺胺二甲嘧啶(sulfamethazine,SM2)、磺胺对甲氧嘧啶(sulfamethoxydiazine,SMD)、磺胺间甲氧嘧啶(sulfamonomethoxine,SMM)、磺胺甲噁唑(s u l f a m e t h o x a z o l e,S M Z)、磺胺喹恶啉(sulfaquinoxaline,SQ)、对氨基苯甲酸(4-aminobenzoic acid,PABA)、磺胺甲二唑(sulfamethizole,SMT)、磺胺吡啶(sulphapyridine,SP)、庆大霉素(gentamicin,GTM)、氯霉素(chloramphenicol,CAP) 中国兽医药品监察所;磺胺(sulfanilamide,SN)、对氨基苯磺酸(sulfanilic acid,p-ASA) 阿拉丁试剂(上海)有限公司;辣根过氧化物酶(horseradish peroxidase,HRP)(RZ>3)上海生工生物工程技术服务有限公司;化学发光底物液美国Pierce公司。
化学发光检测仪、酶标仪 美国Thermo公司;96孔化学发光板条 深圳金灿华有限公司;Ultrospec紫外分光光度计 美国Amersham公司。
1.2 方法
1.2.1 抗体的纯化及鉴定
采用辛酸-硫酸铵联合沉淀法[10]对腹水进行初步纯化。采用Protein G亲和层析柱进一步纯化后用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定其纯度,稀释n倍,紫外分光光度计分别测定OD280nm和OD260nm,根据式(1)计算IgG含量:

1.2.2 酶标抗体的制备
采用改良的过碘酸钠法[11]将HRP与已纯化的单抗相连制备酶标抗体IgG-HRP。用紫外分光光度计分别测定OD403nm和OD280nm,根据公式计算酶量、抗体量和克分子比:

1.2.3 直接竞争酶联免疫分析法(DC-ELISA)
用0.05mol/mL磷酸缓冲液稀释检测抗原(SD-OVA)至1.2μg/mL,向微孔板中每孔加100μL,4℃过夜包被,PBST洗涤液洗3次,每孔加300μL封闭液(5%的脱脂牛奶),37℃封闭1h后,甩去封闭液洗涤3次,在吸水纸上拍干,每孔中分别加入SD标准品或样品50μL,酶标抗体溶液50μL,混匀,37℃温育35min,洗涤4次,拍干,加100μL TMB显色液,显色反应5min后加 2mol/L硫酸50μL终止反应,并于450nm波长处检测光密度(OD450nm)。未加SD标准品孔的OD450nm值为B0,添加了SD标准品孔的OD450nm值为B,按式(2)计算结合率,结合率为50%时所对应的SD标准品质量浓度即是IC50。

1.2.4 直接竞争化学发光免疫法(DC-CLEIA)
用0.06mol/mL柠檬酸缓冲液稀释检测抗原(SD-OVA)至0.8μg/mL向微孔板中每孔加100μL,4℃过夜包被,然后用PBST洗涤液洗3次,每孔加300μL封闭液(5%的脱脂牛奶),37℃封闭1h后,甩弃封闭液洗涤3次,在吸水纸上拍干,每孔中加入SD标准品或样品50μL,酶标抗体溶液50μL,混匀,37℃温育25min,洗涤4次,拍干,每孔加发光底物液100μL,用化学发光检测仪测量相对发光强度单位(relative light units,RLU)。未加SD标准品孔的RLU值为B0,添加了SD标准品孔的RLU值为B,IC50的计算同1.2.3节。
1.2.5 检测条件的确定
采用方阵滴定[12]确定DC-ELISA抗原和抗体反应的稀释倍数。
文献[13]表明,RLUmax/IC50越大,DC-CLEIA的灵敏度和重复性越好,因此引入RLUmax/IC50评价各种因素的影响。按照1.2.4节方法分别对抗原包被液及包被质量浓度、酶标抗体稀释倍数和竞争反应时间优化。
1.2.6 样品提取
参照国家标准[15]。HPLC方法的样品提取参照测定标准[14]。
1.2.7 方法学分析
标准曲线:称取4mg SD标准品溶于1mL 蒸馏水配制成4mg/mL SD标准品母液,将SD标准品母液分别稀释至终质量浓度为5、10、20、50、100、200、500ng/mL,参照文献[12]的方法建立DC-ELISA标准曲线,参照文献[13]的方法建立DC-CLEIA 标准曲线。将SD标准品母液分别稀释至终质量浓度为10、25、50、100、200、400、800、2000、4000ng/mL,参照文献[14]用HPLC分别测定计算峰面积,并建立HPLC标准曲线。
灵敏度:对零标准点平行测定10次,计算发光或OD450nm平均值及其标准偏差,再由平均值减去两倍标准偏差后的值代入校准曲线所求得的质量浓度即是灵敏度,重复实验3次,计算平均灵敏度。HPLC方法的灵敏度为以色谱峰面积响应值等于3倍信噪比的进样量计算,求出灵敏度。
批内批间变异:随机抽取板条分别进行3个批次的包被,每批次6个平行进行测定,分别计算IC50的批内及批间变异。
回收率:在经HPLC检测为阴性猪肉样品中分别添加 40、80、120μg/kg的SD标准品,依照1.2.6节进行样品提取,分别用DC-ELISA和DC-CLEIA检测样品质量浓度。
特异性:本研究选取与SD结构类似的6种磺胺类药物和其他两种常见的兽药——磺胺二甲嘧啶(SM2)、磺胺对甲氧嘧啶(SMD)、磺胺间甲氧嘧啶(SMM)、磺胺甲噁唑(SMZ)、磺胺喹恶啉(SQ)、对氨基苯甲酸(PABA)、氯霉素(CAP)和庆大霉素(GTM),采用DC-ELISA与DCCLEIA两种方法分别测定与SD的交叉反应率,交叉反应率按式(3)计算:

2 结果与分析
2.1 抗体的纯化与鉴定

图2 抗体纯化SDS-PAGE电泳图Fig.2 SDS-PAGE electrophoresis of purified anti-SD McAb
腹水经纯化后通过SDS-PAGE检测纯度,结果如图2所示。未纯化的抗体杂蛋白带较多,使用辛酸-硫酸铵沉淀法提取纯化的抗体仍然有一些杂质蛋白,而经过Protein G亲和层析柱纯化的抗体IgG有两条清晰的条带:一条为轻链,约25kD;另一条为重链,约50kD,纯度较好。
2.2 酶标抗体的制备
采用改良的过碘酸钠法将制备好的单抗和HRP连接制备酶标抗体IgG-HRP,调整HRP/IgG物质的量投料比为1:1、2:1、4:1获得3组酶标抗体,经计算得它们的HRP/IgG克分子比分别为1.04、1.22、0.84,它们的效价如图3所示。

图3 不同HRP/IgG物质的量投料比酶标抗体的效价Fig.3 The titers of IgG-HRP at different HRP/IgG molecular ratios
由图3可知,HRP/IgG物质的量投料比为2:1时效价最高,达到1:25600以上。
2.3 化学发光免疫分析法的建立
2.3.1 抗原包被液的选择
分别使用磷酸缓冲液、柠檬酸缓冲液及碳酸缓冲液稀释抗原至0.8μg/mL进行包被,其他步骤参照1.2.4节,实验结果如图4所示。经计算用3种缓冲液包被时IC50分别为53.5、36.6、37.8ng/mL,可见,柠檬酸缓冲液包被时,标准品竞争抑制效果最好,因此选择柠檬酸缓冲液作为包被缓冲液。

图4 抗原稀释液的选择Fig.4 Screening of optimum dilution buffer for coating antibody
2.3.2 抗原包被质量浓度的选择
采用柠檬酸缓冲液分别稀释抗原至1.2、1.0、0.8、0.6μg/mL,其他步骤参照1.2.4节,结果如图5所示。IC50随着抗原包被质量浓度的增大而增大,RLUmax/IC50随着抗原质量浓度的增大先是增大然后减小,在抗原质量浓度为0.8μg/mL时达到最大,因此选用0.8μg/mL作为抗原包被质量浓度。

图5 DC-CLEIA抗原包被质量浓度的优化Fig.5 Screening of optimum coating antibody concentration
2.3.3 酶标抗体稀释倍数的选择
用磷酸缓冲液将酶标抗体分别稀释1000、1500、2000、3000倍,其他步骤参照1.2.4节,结果如图6所示。随着酶标抗体稀释倍数的增大,IC50逐渐减小并趋于恒定,RLUmax/IC50也逐渐减小。综合考虑IC50与RLUmax/IC50,将酶标抗体的稀释倍数定为2000倍。

图6 DC-CLEIA酶标抗体稀释度的优化Fig.6 Screening of optimum IgG-HRP concentration
2.3.4 酶标抗体竞争反应时间的选择

图7 DC-CLEIA抗原包被质量浓度的优化Fig.7 Screening of optimum reaction time
按照1.2.4节操作步骤分别选择竞争反应时间为10、15、20、25、30、35min进行实验,结果如图7所示。随着温育时间的延长,IC50呈现逐渐增大的趋势,RLUmax/IC50在25min时达到最大,选定25min作为竞争反应时间。
2.4 DC-ELISA与DC-CLEIA的方法学评价
2.4.1 标准曲线
采用方阵滴定法确定最佳抗原包被质量浓度为1.2 μg/mL,酶标抗体的稀释倍数为1:3200,建立DC-ELISA标准曲线线性回归方程为Y=-15.1829lnX+117.31(R2=0.9982),IC50=84.21ng/mL,检测范围(IC20~IC80)为11.67~607.4ng/mL。
按照1.2.7节绘制DC-CLEIA标准曲线见图8。线性回归方程为Y=-14.717lnX+100.94(R2=0.9922),IC50=31.87ng/mL,检测范围(IC20~IC80)为 4.14~244.6ng/mL。

图8 DC-CLEIA的标准曲线Fig.8 Standard calibration curve of the DC-CLEIA
2.4.2 灵敏度和精密度
按照1.2.7节计算的DC-ELISA平均灵敏度为8.41ng/mL,DC-CLEIA平均灵敏度为2.96ng/mL,较DC-ELISA提高了2.84倍。
按照1.2.7节分别计算IC50的批内及批间变异,结果见表1。

表1 两种检测方法对SD测定的精密度(n=6)Table 1 Precision of DC-CLEIA and DC-ELISA (n=6)
2.4.3 回收率
1.2.7节的回收率检测实验结果见表2。与DC-ELISA相比,DC-CLEIA的加标回收率较高。

表2 两种检测方法对SD测定的加标回收率(n=3)Table 2 Recoveries of SD from spiked blank pork (n=3)
2.4.4 特异性实验
本研究选取与SD标准品结构类似的6种磺胺类药物和其他两种常见的兽药——磺胺二甲嘧啶(SM2)、磺胺对甲氧嘧啶(SMD)、磺胺间甲氧嘧啶(SMM)、磺胺甲噁唑(SMZ)、磺胺喹恶啉(SQ)、对氨基苯甲酸(PABA)、氯霉素(CAP)和庆大霉素(GTM),采用DC-ELISA与DCCLEIA两种方法分别测定与SD的交叉反应率,结果(表3)未见有交叉反应。

表3 DC-ELISA与DC-CLEIA两种方法的交叉反应率Table 3 Cross-reactivities to SD analogues analyzed by DC-ELISA or DC-CLEIA
2.5 DC-CLEIA样品测定与HPLC的比较
按照1.2.7节中方法进行HPLC测定发现,在10~4000μg/kg范围内,线性关系良好,线性回归方程为Y=0.063X-0.048,线性相关系数为0.999,灵敏度为10 μg/kg。与DC-CLEIA方法相比,线性范围较宽,但灵敏度较大。
分别采用DC-CLEIA和HPLC测定市场上随机购买的26份猪肌肉样品,两种方法的所测结果见表4,以DC-CLEIA的测定值为X轴、HPLC测定值为Y轴作图得相关曲线如图9所示,线性拟合的方程为Y=0.7498X-3.788,相关系数为0.956。
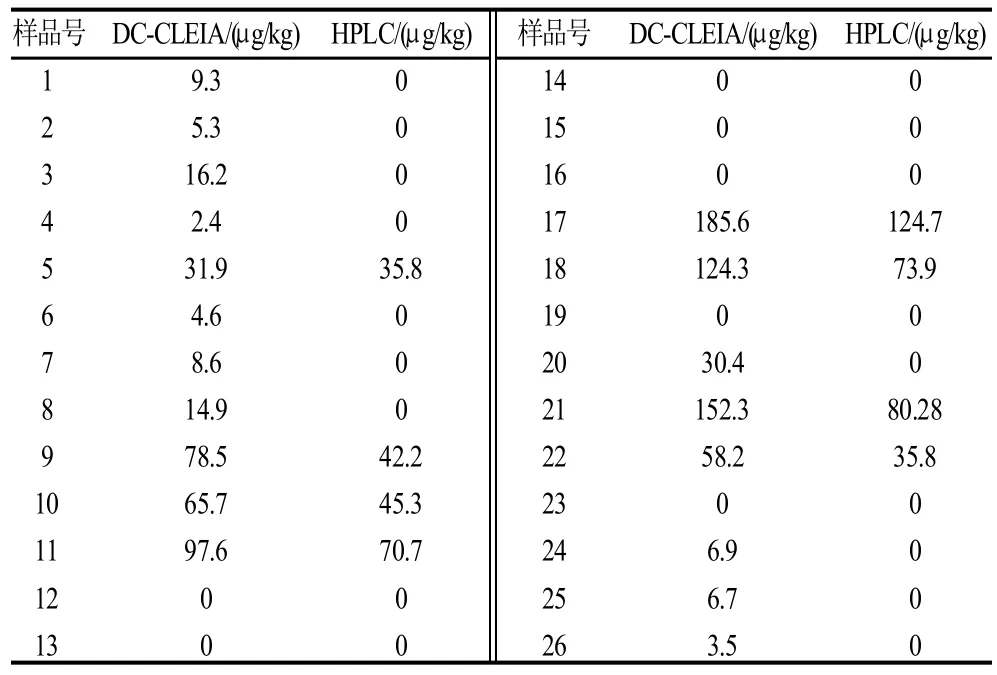
表4 DC-CLEIA和HPLC的样品测定结果Table 4 SD concentrations in real samples analyzed by DC-ELISA and DC-CLEIA

图9 DC-CLEIA的测定值与HPLC测定值的相关性Fig.9 Correlation between DC-CLEIA and HPLC results
3 结 论
3.1 采用Protein G亲和层析柱对腹水进行纯化,得到纯度比较高的单抗,通过改良的过碘酸钠法制备了酶标抗体,抗体效价达到 1:25600。
3.2 优化了化学发光酶免疫反应的各种条件,采用HRP催化鲁米诺-过氧化氢化学发光体系,建立了一种测定猪肉中SD化学发光酶免疫分析方法,方法分析灵敏度为2.96ng/mL,批内变异系数小于8.32%,批间变异系数小于13.4%,以猪肉为样品的分析回收率为75.6%~103.7%,与其他结构类似物未见明显交叉,所建立的标准曲线相关系数为0.9922,检测线性范围为4.14~244ng/mL,样品检测时间仅为25min。
3.3 建立的DC-CLEIA与DC-ELISA相比灵敏度提高了2.84倍。采用DC-CLEIA和HPLC测定了26份市场样品,并进行对照,两者的线性相关系数为0.956。
[1] MITEMA E S, KIKUVI G M, WEGENER H C, et al. An assessment of antimicrobial consumption in food producing animals in Kenya[J]. Journal of Veterinary Pharmacology and Therapeutics, 2002, 24(6): 385-390.
[2] GEDDES A M, KLUGMAN K P, ROLINSON G N. Introduction:historical perspective and development of amoxicillin/clavulanate[J].International Journal of Antimicrobial Agents, 2007, 30(2): 109-112.
[3] WANG Xiliang, LI Kui, SHI Deshi, et al. Development and validation of an immunochromatographic assay for rapid detection of sulfadiazine in eggs and chickens[J]. Journal of Chromatography B, 2007, 847(2): 289-295.
[4] 农业部畜牧兽医局. 农业部发布动物性食品中兽药最高残留限量(续)[J]. 中国兽药杂志, 2003, 37(4): 15-20.
[5] EEC Council Regulation No.508/1999. Community procedure for the establishment of maximum residue limits of veterinary medicinal products in foodstuffs of animal origin[J]. Official Journal of the European Communiity, 1999, L60: 26.
[6] STOEV G, MICHAILOVA A. Quantitative determination of sulfonamide residues in foods of animal origin by high-performance liquid chromatography with fluorescence detection[J]. Journal of Chromatography A, 2000, 871(1/2): 37-42.
[7] REEVES V B. Confirmation of multiple sulfonamide residues in bovine milk by confirmation of multiple sulfonamide residues in bovine milk by gas chromatography-positive chemical ionization mass spectrometry[J]. Journal of Chromatography B, 1999, 723(1/2): 127-137.
[8] CLIQUET P, COX E, HAASNOOT W, et al. Extraction procedure for sulfachloropyridazine in porcine tissues and detection in a sulfonamidespecific enzyme-linked immunosorbent assay (ELISA)[J]. Analytica Chimica Acta, 2003, 494(1/2): 21-28.
[9] JIMENEZ A, NZVAS M. Chemiluminescence methods (present and future)[J]. Grasasy Aceites. 2002, 53(1): 64-75.
[10] 丹陈, 孙广瑞, 柳增善. 辛酸-硫酸铵联合沉淀法在单克隆抗体纯化中的应用[J]. 安徽农业科学, 2007, 35(26): 8105-8108.
[11] 郭春祥, 郭锡凉. 介绍一种简单、快速、高效的辣根过氧化物酶标记抗体的过碘酸钠法[J]. 上海免疫学杂志, 1983, 3(2): 97-100.
[12] 章英. 建立IAC-HPLC检测谷物中的玉米赤霉烯酮和赭曲霉毒素A[D]. 南昌: 南昌大学, 2007.
[13] QUAN Ying, ZHANG Yan, WANG Shuo, et al. A rapid and sensitive chemiluminescence enzyme-linked immunosorbent assay for the determination of fumonisin B1 in food samples[J]. Analytica Chimica Acta,2006, 580(1): 1-8.
[14] 农业部畜牧兽医局. [2001]38号公告: 动物源食品中兽药残留检测方法[B].
[15] 农业部. 动物性食品中磺胺类药物残留检测: 酶联免疫吸附法[S].2008.
Determination of Sulfadianzine Residues in Pork by Direct Competitive Chemiluminescence Enzyme Immunoassay
CHU Jin-shen,XU Yang*,HE Qing-hua,WANG Liu-hua,LU Jiang
(State Key Laboratory of Food Science and Technology, Sino-Germany Joint Research Institute, Nanchang University,Nanchang 330047, China)
A direct competitive chemiluminescence enzyme immunoassay (DC-CLEIA) was developed to determine sulfadiazine (SD) residues in pork. Assay parameters including coating antigen (OVA-SD) and enzyme labeled antibody concentrations concentrations and reaction time were optimized to be 0.8 μg/mL, 2000-fold dilution and 25 min, respectively. The analytical sensitivity of the developed method was 2.96 ng/mL, and the intra-assay and inter-assay coefficients of variation were below 8.32% and 13.4%, respectively. The recoveries for SD in negative pork spiked at three levels ranged from 75.6% to 103.7%. The McAb had no noticeable cross-reactivity to SD analogues. The standard curve displayed good linearity over the range of 4.14 to 244 ng/mL with a correlation coefficient of 0.9922. This DC-CLEIA may be used for routine detection and monitoring of SD in pork.
sulfadiazine;direct competitive chemiluminescence enzyme immunoassay;horseradish peroxidase;pork
TS207.3
A
1002-6630(2011)10-0124-06
2010-07-23
江西省科技支撑计划项目(2007BS12501);国家“863”计划项目(2007AA10Z427)
楚金申(1985—),男,硕士研究生,研究方向为工业微生物。E-mail:chujinshen@126.com
*通信作者:许杨(1951—),女,教授,博士,研究方向为食品生物技术。E-mail:xuyang1951@163.com

