液相色谱-串联质谱法同时测定蜂蜜中4种四环素族抗生素及其3种差向异构体
刘蓉蓉,吴黎明,周金慧,曾明华*
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.中国农业科学院蜜蜂研究所,北京 100093)
液相色谱-串联质谱法同时测定蜂蜜中4种四环素族抗生素及其3种差向异构体
刘蓉蓉1,2,吴黎明2,周金慧2,曾明华1,*
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.中国农业科学院蜜蜂研究所,北京 100093)
采用液相色谱-质谱联用技术,建立同时测定蜂蜜样品中4种四环素族抗生素及其3种差向异构体的方法。蜂蜜样品中残留的药物用EDTA-McIlvaine缓冲液提取,提取液依次经OASIS HLB及羧酸弱阳离子柱固相萃取柱富集、净化后,用流动相洗脱。洗脱液经微孔滤膜过滤,用流动相甲酸水-乙腈梯度分离,电喷雾-串联质谱进行测定。在多反应监测模式下,22min内7种药物基本实现分离以及定性定量。样品在10~500μg/kg添加范围内,回收率均在64.9%~91.0%之间,相对标准偏差(RSD)不大于10.5%。土霉素及差向土霉素、四环素及差向四环素的检测限为1μg/kg,金霉素及差向金霉素、强力霉素的检测限为2μg/kg。本方法灵敏、可靠,可用于蜂蜜中7种四环素类抗生素的同时检测(其中包括3种毒性代谢产物)。
液相色谱-串联质谱法;蜂蜜;四环素类抗生素;差向异构体
四环素族抗生素药物具有广谱抗菌作用,几十年来在药品和食品添加剂中被广泛应用。在养蜂业,被用来防止蜜蜂感染幼虫腐臭病[1-2],使用较多的有四环素(tetracycline,TC)、土霉素(oxytetracycline,OTC)、金霉素(chlortetracycline,CTC)、强力霉素(doxycycline,DC)[1]。
从结构式来看,四环素族分子中含有酚羟基、烯醇和二甲氨基,属于酸碱两性物质,在强酸碱环境下不稳定。在酸性(pH<2)溶液中,C环C6位上的仲羟基与C5的氢发生反式消去形成双键,C11-C11a-C12上双键发生位移,使碳环发生芳构化,生成脱水四环素(ATC)或脱水金霉素(ACTC)。在碱性溶液中,在OH-作用下C6位上的羟基形成氧负离子,进攻分子内的C11(羧基碳),经电子转移导致碳环开裂,生成无活性的内置异构体,称为异四环素类。在弱酸性(pH2~6)溶液中[2],由于不对称碳C4的构型改变(图1),发生差向异构化,反应是可逆的,平衡时差向异构体的比例可达40%~60%。蜂蜜具有稳定的弱酸环境及17%~19%的水分含量,在加工贮存过程中,蜂蜜中残留四环素族抗生素(tetracyclines,TCs)极易发生代谢,且主要产物为差向异构体。四环素族抗生素差向异构体(epitetracycline,ETCs)的药效极低或消失,但毒副作用增加[3],并且具有在特定环境下转化回本药的可能性[3-4]。

图1 四环素差向异构化反应示图Fig.1 Epimerization of tetracycline
对四环素族抗生素药物的分离检测一直是药物分析中令人关注的研究课题。对于TCs及其立体异构体的分离检测也已有文章述及[5-8],包括有对于牛奶中,液体猪饲料中。而且国内外研究更多只是对母体四环素的论述。在保健食品行业,蜂蜜产品质量倍受关注,对其中农兽药残留物的检测技术日渐成熟,但对降解产物的毒性研究及残留测定则少有报道。本实验在前人工作的基础上提出了基于高效液相串联质谱检测技术,实现对蜂蜜中4种常用TCs(TC、OTC、CTC和DC)及3种代谢物(差向四环素[epitetracycline,ETC]、差向土霉素[e p i o x y t e t r a c y c l i n e,E O T C]、差向金霉素[epichlortetracycline,ECTC])的同时测定,使得方法满足蜂蜜中四环素类抗生素的残留分析,同时可以对二级有毒代谢产物进行痕量监测,更准确的考察出蜂蜜产品中四环素类抗生素的残留情况,进而为蜂场合理使用四环素族抗生素药物提供参考。
1 材料与方法
1.1 试剂与仪器
TC、OTC、CTC、DC、ETC、EOTC、ECTC对照品 中国药品生物制品检定所。对照品标准溶液:准确称取适量TC、ETC、OTC、EOTC、CTC、ECTC和DC标准品,用甲醇溶解配制成 100mg/L(其中CTC、DC、ECTC为200mg/L)的标准储备液,于-22℃保存。根据需要用流动相逐级稀释成适当质量浓度的混合标准工作溶液,混合标准工作溶液在4℃保存,可使用3d。
0.2mol/L磷酸氢二钠(优级纯)溶液、0.1mol/L柠檬酸溶液、Mcllvaine缓冲溶液pH5.0±0.05、0.1mol/L Na2EDTA-Mcllvaine缓冲乙腈、乙酸乙酯、甲醇和甲酸铵(均为色谱纯);其余未注明为分析纯;水为Millipore超纯水。
6460A 三重四级杆液质联用仪(配有Jet Stream喷雾电离源)、 ZORBAX SB-C18液相色谱柱(2.1mm×50mm,1.8μm) 美国安捷伦公司;Oasis HLB小柱(500mg,6mL)(使用前分别用 5mL甲醇和 10mL水预处理,保持柱体湿润) 美国Waters公司;Supelclean LC-WCX SPE 小柱(500mg,3mL)(使用前用5mL乙酸乙酯预处理)、固相萃取装置 美国Supelco公司;CR22G高速离心机 日本Hitachi公司;QB-210试管旋转摇床 江苏海门其林贝尔公司;N-EVAP 112氮吹仪 德国OA-SYS公司;JA2003电子天平(0.001g) 上海楚定科技公司;FE20pH计 瑞士Mettler-Toledo公司。
1.2 样品前处理
1.2.1 提取
准确称取 6.0g待测蜂蜜样品(精确至0.01g)于50mL离心管中,加入30mL 0.1mol/L Na2EDTA-Mcllvaine缓冲溶液(pH5),手摇萃取5min后,在12000r/min下离心5min,取上清液待净化。如果遇到蜂蜜样品结晶,在低于60℃水中加热使其完全溶解,混匀后再称样。
1.2.2 净化
将离心管中上清液倒入下接Oasis HLB固相萃取柱的贮液器中,使上清液以小于等于3mL/min的流速通过Oasis HLB固相萃取柱,用5mL甲醇-水(5:95,V/V)淋洗去除柱内杂质后,在65kPa负压下减压抽干30min。最后取15mL乙酸乙酯洗脱并将洗脱液通过预先活化的羧酸阳离子柱,用5mL甲醇淋洗后,减压抽干5min。再用4mL流动相洗脱收集洗脱液于样品管中,并用流动相定容至4mL,待测。
1.3 分析条件
色谱条件:色谱柱:ZORBAX SB-C18(2.1mm×50mm,1.8μm);流动相:A为0.1%甲酸水溶液,B为乙腈,梯度洗脱程序:见表1。流速:0.3mL/min;进样量:5μL;柱温:3 0℃。

表1 梯度洗脱表Table 1 Gradient elution table
质谱条件:雾化气、脱溶剂气、锥孔气为氮气,碰撞气为高纯氮气。雾化气压力45psi;鞘气温度:350℃;鞘气流量10L/min;干燥气温度350℃;干燥气流量6L/min;喷嘴电压1000V;毛细管电压4000V;电离方式:ESI+;采集方式:MRM;驻留时间30ms;扫描范围m/z 100~600。定性离子对、定量离子对和碰撞气能量见表2。

表2 7种四环素类药物的质谱分析条件Table 2 ESI-MS/MS analysis conditions of tetracyclines
2 结果与分析
2.1 前处理条件优化

图2 四环素族抗生素测定的主要前处理步骤Fig.2 Pre-treatment procedures for the determination of tetracyclines
2.1.1 提取条件的优化
四环素抗生素在醇类中的溶解度较大[22],在乙酸乙酯、丙酮、乙腈等有机溶剂中溶解度较小,在水中溶解度在mg/mL水平。由于TCs中活性基团众多,易与金属离子形成配合物,又可以与生物样本中的蛋白键合,所以样品提取时需加入金属络合剂和强酸或酸性去蛋白试剂,但四环素溶液在pH<2时可发生脱水反应物,因此用含有金属络合剂的弱酸作为提取液,包括草酸及Mcllvaine。首先考虑到盐类缓冲溶液在质谱体系中造成毛细管接口聚集可损害质谱寿命[23],采用0.1mol/L Na2EDTA- McIlvaine缓冲液作为提取液,回收率最好。
为了考察提取液pH值对回收率的影响,分别配制pH2.5~6.0的Na2EDTA- McIlvaine缓冲液,对标准添加蜂蜜进行提取、净化,计算回收率,比较提取效果。
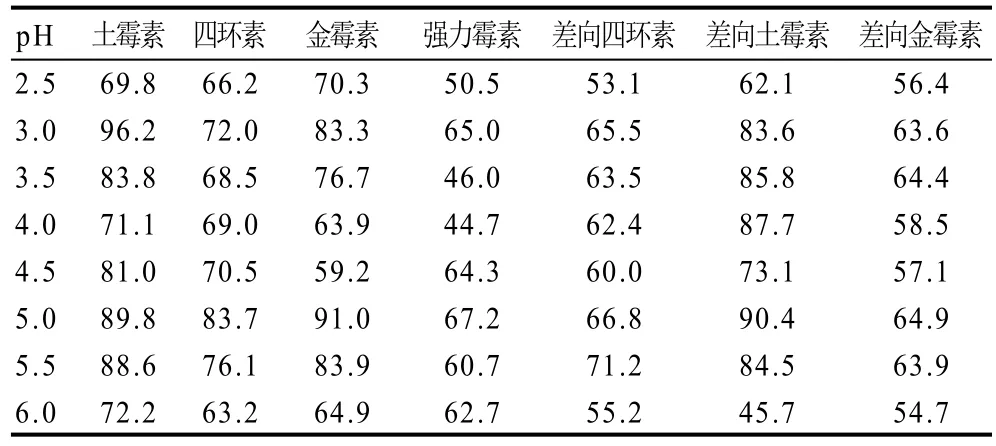
表3 提取液pH值对回收率的影响(n=6)Table 3 Effect of pH on recovery rate(n=6)%
从表3可以看出,当pH5.0时,其回收率较好。因此,本方法选择pH 5.0的0.1mol/L Na2EDTA-Mcllvaine缓冲溶液做为提取液。在此弱酸环境下,缓冲液当天提取时形成的差向四环素类可以忽略,并且在-20℃避光保存3d稳定[24],不影响测定方法重现性。
2.1.2 净化条件的优化
蜂蜜基质成分复杂,尤其是相对肉制品,饲料等。由于共流物可能造成严重的基质效应,影响分析物的电离效应,比如说糖类、盐类、蛋白质类、脂质。本实验采用了OASIS HLB固相萃取柱及离子交换萃取柱两次固相萃取操作对样品充分净化,其标准溶液的柱回收率都很高,且重现性良好。
对于Oasis HLB固相萃取柱,对比乙腈、甲醇、甲醇-乙酸乙酯混合液、乙酸乙酯,等各种洗脱剂的效果。甲醇、乙腈洗脱能力较强,容易洗下过多杂质,15mL乙酸乙酯可以满足回收率及净化条件。对于羧酸弱阳离子柱使用流动相作洗脱剂,洗脱效果令人满意,省去浓缩复溶环节,直接上机。因此,本方法选用流动相作为羧酸离子柱的洗脱剂,洗脱剂用量对回收率的影响见表4。

表4 洗脱剂用量对回收率的影响(n=6)Table 4 Effect of eluent amount on recovery rate (n=6)%
从表4可以看出,使用羧酸离子柱,用4mL流动相洗脱,可获得理想的净化富集效果。
2.2 仪器分析条件的优化
文献中报道的高效液相分离方法中,多采用反向分离柱,流动相多为甲醇、乙腈及草酸溶液。使用ZORBAX SB-C18(2.1mm×50mm,1.8μm),0.1%甲酸-乙腈流动相梯度洗脱,除差土霉素和差向四环素不能完全分离外,其余可以达到较好的基线分离。
在质谱分析中,首先在一级全扫描质谱中得到TCs的准分子离子峰,确定母离子[M+H]+,再选择[M+H]+进行二级质谱分析。通过优化碰撞能,选择子离子中相对丰度较大的特征离子作为优化后定性离子对、定量离子对。准分子离子可生成的主要碎片离子为[M+H-NH3]+和[M+H-NH3-H2O]+,丢失的NH3来自图1中第4个环,丢失的H2O来自第2个环。色谱条件下未分离的差向土霉素和差向四环素通过监测离子在MRM模式下仍然不影响分别定量。
2.3 定性定量分析
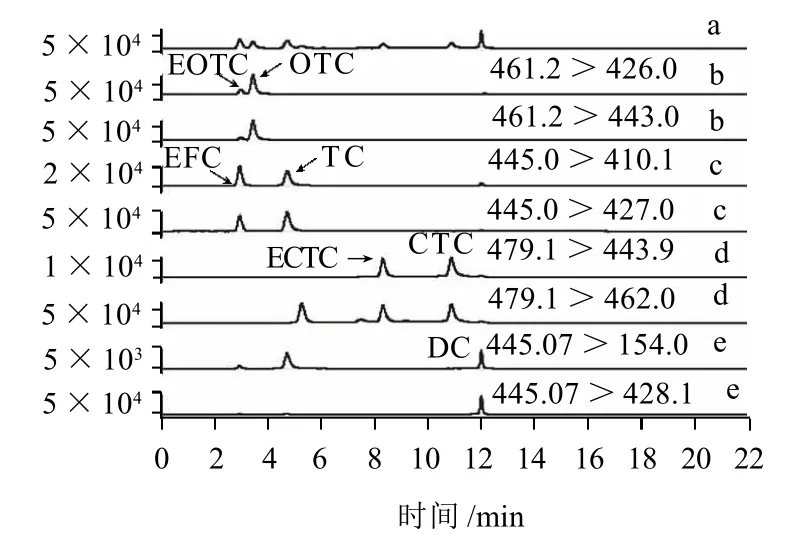
图3 标样定性、定量离子的MRM图(100μg/L)Fig.3 MRM chromatogram of standard sample at the concentration of 100μg/L and blank sample spiked with TC and ETC at the concentration of 100μg/L
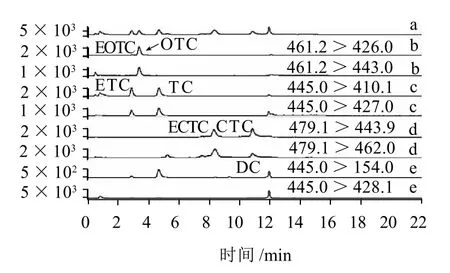
图4 空白添加样(10μg/kg)的定性离子和定量离子MRM图Fig.4 MRM Chromatogram of negative sample spiked with TCs and ETCs (10μg/kg)
按照1.3节所述方法分别对单标溶液(添加水平分别为100μg/L)进行全扫描,根据子离子相对丰度选择定性定量离子。按照1.2节述及方法对空白蜂蜜样品及添加TCs及ETCs后的空白蜂蜜中样品进行测定。其总离子流色谱图及提取离子色谱图见图3、4,未添加TCs及ETCs的空白蜂蜜样品的色谱图略)。
2.4 标准曲线
用流动相将各药物标准储备液稀释成TCs、ETCs浓度分别为4、40、200、400、600、800、1000μg/L的系列混合标准溶液,在1.2节条件下,以药物的质量浓度/(μg/L)为横坐标(x),以其峰面积为纵坐标(y)进行线性回归。结果见表5。
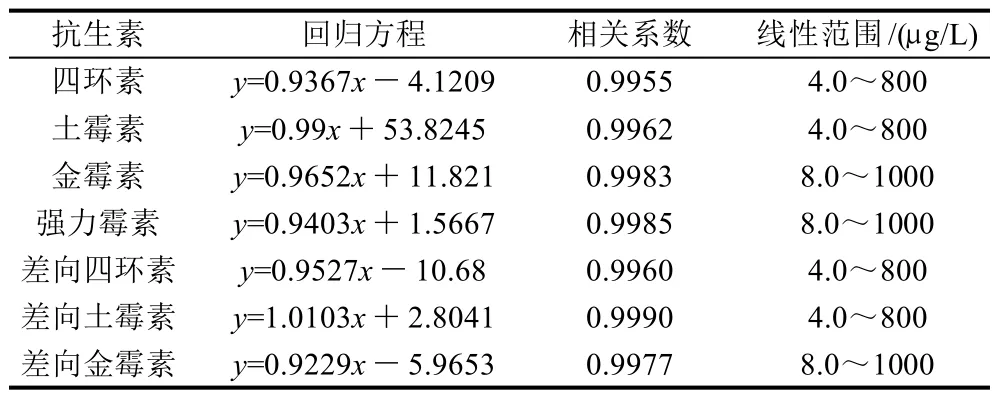
表5 7种四环素类抗生素校正曲线的回归分析Table 5 Regression analysis for calibration curves of 7 tetracyclines
2.5 检测限与定量限
检测限:添加1mg/L标准溶液60μL于6g空白蜂蜜样品中(即添加水平为10μg/kg),经提取、净化后测定,OTC、EOTC、TC、ETC的信噪比(RSN)大于30,CTC、ECTC和DC的RSN大于15,根据检出限含量处的RSN等于3的原则,计算方法的检测限分别为1μg/kg和2μg/kg。
定量限:添加1mg/L标准溶液150μL于6g空白蜂蜜样品中(即添加水平为25μg/kg),经提取、净化后测定,OTC、EOTC、TC、ETC的RSN大于90,CTC、ECTC和DC的RSN大于45,根据定量限含量处的RSN等于10的原则,方法的定量限分别为3.3μg/kg和6.7μg/kg。
2.6 回收率实验
取空白蜂蜜样品添加TCs、ETCs药物标准溶液适量,制得10、50、500μg/kg(即1/2的最高残留限量[maximum residue limits for veterinary drugs,MRLVDs]、MRLVDs和2倍的MRLVDs)3个水平的标准添加蜂蜜样品,进行回收率实验(每个水平下做6个平行实验),结果见表6。样品在10~500μg/kg添加范围内,回收率均在64.9%~91.0%之间(差向异构体水溶性较高,提取净化环节的回收率较低),相对标准偏差(RSD)不大于10.5%。

表6 TCS和ETCs回收率和精密度实验结果(n=6)Table 6 Recovery rates of oxytetracycline, tetracycline, chlortetracycline and doxycycline in honey (n=6)%
2.7 实际样品的测定
应用本方法测定了来自不同地区的34个蜂蜜样品,其中一个蜂蜜样品检出有10-9级四环素及差向物残留 (分别为5.4、4.9μg/kg),一个有土霉素及差向物残留(分别为10.6、3.8μg/kg),表明商品蜜中残留四环素确实在蜂蜜的加工储存上架期内发生差向异构,残留检测和危害分析工作中应该纳入差向代谢物。
3 结 论
在样品净化时采用OASIS HLB固相萃取柱和羧酸型弱阳离子交换柱净化,同时对其他分析参数做了进一步优化,改进了净化效果。从而提高了方法的灵敏度(检测限达到1~2μg/kg),增加了方法的稳定性(RSD≤10.5),提高了样品回收率(64.9%~91.0%)。在对不同地区的不同样品分析时,阳性样品的分析值稳定,空白样品标准添加回收率实验及精密度实验显示方法定量准确,重现性好,可以作为实际样品中四环素及其差向物残留测定项目的分析方法,并取得满意效果。
[1] OKA H, ITO Y, MATSUMOTO H. Chromatographic analysis of tetracycline antibiotics in foods[J]. J Chromatogr A, 2000, 882(1/2): 109-133.
[2] KHNE M, IHHEN D, MLLER G, et al. Stability of tetracycline in water and liquid manure[J]. J Vet Med, 2000, 47(6): 379-384.
[3] BERGNER-LANG B, MIKISCH E. On the importance of the 4-epimers of oxytetracycline, tetracycline and chlortetracycline residues in HPLC analysis on food stuffs of animal origin[J]. Deutsche Lebensmittel-Rundschau, 1994, 90(2): 39-41.
[4] POSYNIA K, MITROWSKA K, ZMUDZKI J, et al. Analytical procedure for the determination of chlortetracycline and 4-epi-chlortetracycline in pig kidneys[J]. Journal of Chromatography A, 2005, 1088(1/2): 169-174.
[5] FRITZ J W, ZUO Yuegang. Simultaneous determination of tetracycline,oxytetracycline, and 4-epitetracycline in milk by high-performance liquid chromatography[J]. Food Chemistry, 2007, 105(3): 1297-1301.
[7] 岳振峰, 邱月明, 林秀云, 等. 高效液相色谱串联质谱法测定牛奶中四环素类抗生素及其代谢产物[J]. 分析化学, 2006, 34(9): 1255-1259.
[9] HAMSCHER G, SCZESNY S, HPERPER H, et al. Determination of persistent tetracycline residues in soil fertilized with liquid manure by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry[J]. Anal Chem, 2002, 74(7): 1509-1518.
[10] KOLPIN D W, FURLONG E T, MEYER M T, et a1. Pharmaceuticals,hormones, and other organic wastewater contaminants in US streams,1999/2000: a national reconnaissance[J]. Environ Sci Techno, 2002, 36(6): 1202-1211.
[11] ANDERSON C R, RUPP H S, WU W H. Complexities in tetracycline analysis-chemistry, matrix extraction, cleanup, and liquid chromatography[J]. Journal of Chromatography A, 2005, 1075(1/2): 23-32.
[12] 张艺, 李瑞萍, 张兴华, 等. 固相萃取-亲水作用色谱法测定废水中四环素类抗生素[J].分析化学, 2009, 9(6): 840-844.
[13] 刘虹, 张国平, 刘丛强. 固相萃取-色谱测定水、沉积物及土壤中氯霉素3种四环素类抗生素[J]. 分析化学, 2007, 35(3): 315-319.
[14] 刘艳华, 张纯萍, 门立强, 等. 液相色谱-串联质谱法测定鸡肌肉组织中的四环素类药物残留[J]. 色谱, 2006(2): 171-173.
[15] HU Xiangang, LUO Yi, ZHOU Qixing, et al. Determination of thirteen antibiotics residues in manure by solid phase extraction and high performance liquid chromatography[J]. J Anal Chem, 2008, 36(9): 1162-1166.[16] MARTNEZ-CARBALLO E, GONZLEZ-BARREIRO C, SCHARF S, et al. Environmental monitoring study of selected veterinary antibiotics in animal manure and soils in Austria[J]. Environ Pollut, 2007,148(2): 570-579.
[17] WANG Q, YATES S R. Laboratory study of oxytetracycline degradation kinetics in animal manure and soil[J]. J Agric Food Chem, 2008, 56(5):1683-1688.
[18] AUST M O, GODLINSKI F, TRAVIS G R, et al. Distribution of sulfamethazine, chlortetracycline and tylosin in manure and soil of Canadian feed lots after subtherapeuticuse in cattle[J]. Environ Pollut, 2008,156(3): 1243-1251.
[19] 郭黎明, 朱奎, 江海洋. 超高效液相色谱-串联质谱法同时测定鸡肝中残留的四环素类、磺胺类和喹诺酮类药物[J]. 色谱, 2009(4): 412-416.[20] 马丽丽, 郭昌胜, 胡伟, 等. 固相萃取-高效液相色谱-串联质谱法同时测定土壤中氟喹诺酮、四环素和磺胺类抗生素[J]. 分析化学,2010(1): 21-26.
[21] 孙广大, 苏仲毅, 陈猛, 等. 固相萃取-超高压液相色谱-串联质谱同时分析环境水样中四环素类和喹诺酮类抗生素[J]. 色谱, 2009(1):54-58.
[22] MITSCHER L A. Chemistry of the tetracycline antibiotic[M]. New York: Marcel Dekker, 1978: 54.
[23] 李瑞萍, 张艺, 黄应平. 环境样品中四环素类抗生素的检测技术[J].化学进展, 2008(12): 2075-2081.
[24] PENA A L S, LINO C M, SILVERIA I N. Determination of oxytetracycline, tetracycline, and chlortetracycline in milk by liquid chromatography with postcolumn derivatization and fluorescence detection[J]. AOAC Int, 1999, 82(1): 55-60.
Simultaneous Determination of 4 Tetracyclines and 3 Epimers in Honey by HPLC Coupled with Tandem MS
LIU Rong-rong1,2,WU Li-ming2,ZHOU Jin-hui2,ZENG Ming-hua1,*
(1. School of Animal Science and Technology, Anhui Agricultural University, Hefei 230036, China;
2. Bee Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100093, China)
A method for simultaneous determination of 4 tetracyclines and 3 epimers in honey samples was developed by high performance liquid chromatography coupled with tandem mass spectrometry. The residues in honey samples were extracted by EDTA-Mcllvaine buffer, and cleaned up and condensed by OASIS hydrophilic-liphophilic balance (HLB) column and weak cation exchange (WCX and carboxylic acid) sequentially. Sample solution eluted from the WCX SPE column by mobile phase was filtered by micro-pours membrane, separated by LC-MS/MS with gradient elution using acetonitrile-formic acid solution as mobile phase and then qualitatively and quantitatively analyzed by ESI-MS/MS in a MRM mode. Baseline separation of 7 target drugs was achieved within 7 min, and qualitative and quantitative analysis was completed. The recovery rates of the spiked samples at trace levels were in the range of 64.9% to 91.0% with the relative standard deviation (RSD) less than 10.5%(n = 7). The detection limits were 1μg/kg for oxytetracycline, tetracyclines, 4-epitetracycline, 4-epioxytetracycline and 2 μg/kg for chlortetracycline, doxycycline and epichlortetracycline. The developed method was sensitive and reliable, and can be successfully applied to the simultaneous detection of 7 target tetracyclines residues including toxic metabolites in honey.
high performance liquid chromatography-tandem mass spectrometry;honey;tetracyclines;epimers
TS252.1
A
1002-6630(2011)10-0232-05
2010-11-04
国家现代农业(蜂)产业技术体系项目(nycytx43-kxy9)
刘蓉蓉(1985—),女,硕士研究生,研究方向为动物源性食品安全。E-mail:liurongrong9301@yahoo.com.cn
*通信作者:曾明华(1956—),男,副教授,硕士,研究方向为兽医药理学和动物毒理学。E-mail:zmhzmh@ahau.edu.cn

