壳聚糖澄清甜叶菊水提液及其澄清机理探讨
谢 捷,刘小景,朱兴一,叶海燕,王 平*
(浙江工业大学药学院,制药工程省部共建教育部重点实验室,浙江 杭州 310014)
壳聚糖澄清甜叶菊水提液及其澄清机理探讨
谢 捷,刘小景,朱兴一,叶海燕,王 平*
(浙江工业大学药学院,制药工程省部共建教育部重点实验室,浙江 杭州 310014)
研究壳聚糖絮凝剂在甜叶菊提取液澄清过程中的作用。分别以甜叶菊水提液的澄清率和甜菊苷的损失率为指标,考察不同因素对絮凝效果的影响。通过正交试验法确定壳聚糖絮凝的较优工艺条件为:1%壳聚糖溶液投加量2mL/g甜叶菊干叶、甜叶菊提取液质量浓度1g生药/10mL提取液、pH6.0、温度45℃,絮凝时间4h。在该条件下,甜叶菊水提液的澄清率为86.63%,甜菊苷的损失率为6.89%,与膜分离法澄清的效果相近,且无需特殊设备。与传统化学絮凝法相比,壳聚糖絮凝法能更有效地保留水提液中的有效成分,具有絮凝效果好、易生物降解、对环境安全、无二次污染等优点。
甜叶菊;甜菊苷;壳聚糖;絮凝;澄清
甜叶菊(Stevia rebaudianaBertoni)属菊科多年生草本植物,原产于南美巴拉圭和巴西[1],我国于1976年引种成功,现已成为世界上最大的甜菊糖生产国和出口国,主产区是黑龙江、山东、安徽、江苏、江西等省市[2]。甜菊糖苷是从甜叶菊叶子中提取的九种四环二萜糖苷的混合物,占干叶质量4%~20%,其主要成分是甜菊苷,其他低含量成分是:甜菊双糖苷、莱鲍迪苷A、莱鲍迪苷B、莱鲍迪苷C、莱鲍迪苷D、莱鲍迪苷E、莱鲍迪苷F和杜尔可苷A[3-5]。甜菊糖苷具有高甜度、低热量、易溶解、耐热、稳定、安全、无毒、非发酵性等特点,其甜度为蔗糖的200~300倍,而热量仅为蔗糖的1/300,是一种可替代蔗糖的理想天然甜味剂,被誉为世界第3糖源,对高血压、糖尿病、肥胖症、心脏病、龋齿等病症有一定的辅助疗效,被广泛应用于饮料和食品行业[6-7]。
目前,甜菊糖苷的制备工艺主要包括水提、除杂、大孔吸附树脂分离纯化和离子交换树脂脱色[8]。甜叶菊水提液呈深褐色,含有大量胶体颗粒、蛋白质、色素和可溶性多糖等杂质[9-10],必须在分离纯化前对水提液进行除杂预处理,以提高甜菊糖苷产品的质量,并延长树脂使用寿命。传统的化学絮凝法通常采用铁盐或铝盐等无机低分子作为絮凝剂,以石灰作为助凝剂,进行酸碱中和反应,形成絮凝沉淀[11-12]。该法会给被处理液带入大量无机离子,不利于人类健康。同时,后续处理工艺复杂,甜菊糖苷的损失率也较大,约10%~20%[13]。壳聚糖作为一种新型的有机高分子絮凝剂,主要通过电性中和作用和大分子的架桥作用,除去提取液中较大的悬浮颗粒,具有原料来源广泛、天然无毒、可生物降解、用量少、除杂效果好等特点,广泛应用于中药药液及制剂的澄清精制[14-15]。
本实验采用壳聚糖絮凝法澄清甜叶菊水提液,以甜叶菊水提液的澄清率和甜菊苷损失率为指标对絮凝工艺进行考察,并与传统的化学絮凝剂澄清法进行比较,为甜叶菊水提液的除杂预处理提供一定参考。
1 材料与方法
1.1 材料与试剂
安徽明光产甜叶菊,60℃烘干,粗粉碎至50目,干燥保存;壳聚糖 山东临沂生物制品厂;甜菊苷对照品(纯度>98%) 上海融禾医药科技发展有限公司;甲醇(色谱纯) 美国Fisher公司;庚烷磺酸钠、氯化铁、氧化钙、冰醋酸、磷酸、氢氧化钠、盐酸(均为分析纯)。
1.2 仪器与设备
Agilent-1100型高效液相色谱仪 美国安捷伦公司;HX-200高速中药粉碎机 浙江省永康市溪岸五金药具厂;HHS电热恒温水浴锅 上海博迅实业有限公司;电子分析天平 上海棱谱仪器仪表有限公司;SP-752PC紫外-可见分光光度计 上海笛柏实验设备有限公司;DELTA320 pH计 上海树信仪器仪表有限公司;DHG-9240A鼓风干燥箱 上海一恒科技有限公司;RE-52AA旋转蒸发仪 上海亚莱生化仪器厂;SHB-AⅢ循环水式多用真空泵 河南太康科教器材厂。
1.3 方法
1.3.1 色谱条件
色谱柱:XTerra PR18柱(150mm×4.6mm,5μm);流动相配比为甲醇-0.03%庚烷磺酸钠缓冲液(磷酸调pH3.8)(75:25,V/V);流速:1.0mL/min;柱温:30℃;进样量:10μL,检测波长为210nm。
1.3.2 对照品溶液的制备
精密称取对照品10mg,置10mL容量瓶中,用流动相溶液溶解并稀释至刻度,摇匀。经0.45μm微孔滤膜过滤,制成1mg/mL的溶液,作为对照品溶液。
1.3.3 标准曲线的绘制
精密吸取甜菊苷对照品溶液2、4、6、8、10、12、14、16μL注入高效液相色谱仪中,按上述色谱条件测定峰面积,以峰面积(A)为纵坐标,甜菊苷含量(C/μg)为横坐标,绘制标准曲线,回归方程为A=407.39C-8.3851(R2=0.9998)。甜菊苷含量在1.86~14.88μg范围内与峰面积呈良好的线性关系。
1.3.4 提取液的制备
取适量甜叶菊粗粉,按料液比1:10(g/mL)加水,70℃浸提1h,过滤后重复提取2次,合并滤液,将其体积减压浓缩一半使提取液质量浓度为1g生药/10mL提取液,得深褐色液体,即为甜叶菊提取液。
1.3.5 壳聚糖溶液的制备
准确称取1.0g壳聚糖,用100mL 1%醋酸溶液溶解,得到1%壳聚糖醋酸溶液。为了防止壳聚糖在稀酸溶液中水解而影响澄清效果,壳聚糖充分溶胀后,需立即使用。
1.3.6 甜叶菊提取液的絮凝澄清
1.3.6.1 壳聚糖絮凝法
量取甜叶菊水提液100mL,加入壳聚糖溶液,搅拌5min,调节pH值至规定值,水浴静置一定时间,减压抽滤,滤液冷却后定容至100mL,即为壳聚糖絮凝法处理后的样品溶液。
1.3.6.2 化学絮凝法[16]
量取甜叶菊水提液100mL,加入絮凝剂和助凝剂,调节pH10.0,搅拌10min,置于65℃水浴中静置40min,减压抽滤,滤液冷却后定容至100mL,即为化学絮凝法处理后的样品溶液。
1.3.7 提取液澄清率的测定[9-10]
以蒸馏水做参比,测定甜叶菊提取液在670nm处的吸光度A0及样品溶液在上述波长处的吸光度A1,澄清率B(%)按下式计算:
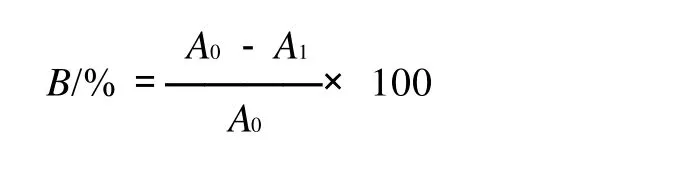
1.3.8 甜菊苷损失率的测定
量取提取液和絮凝后的样品溶液各1.0mL,置10mL容量瓶中,加蒸馏水稀释至刻度,摇匀,HPLC法测定甜菊苷的含量,损失率P(%)按下式计算:

式中:P为损失率;C0、C1分别为提取液和样品溶液中甜菊苷的含量。
1.3.9 单因素试验
分别以壳聚糖的投加量、提取液质量浓度、提取液pH值、体系温度及絮凝时间作单因素试验,考察各单因素对絮凝效果的影响。
1.3.10 壳聚糖絮凝法工艺优化正交试验
根据单因素试验的结果,选定壳聚糖投加量、提取液质量浓度、提取液pH值和体系温度4个因素进行L9(34)正交试验,以甜叶菊水提液的澄清率和甜菊苷损失率为指标,考察上述4个因素对澄清效果的综合影响。试验因素水平见表1。

表1 壳聚糖絮凝法澄清甜叶菊水提液正交试验因素水平表Table 1 Factors and their coded levels in orthogonal array design
2 结果与分析
2.1 壳聚糖絮凝法单因素试验
2.1.1 壳聚糖投加量对澄清效果的影响
取甜叶菊水提液600mL,平均分成6份,分别按0.8、1.2、1.6、2.0、2.4、2.8mL/g(壳聚糖溶液体积/甜叶菊干叶质量)的投加量加入壳聚糖溶液,调节pH6.0,搅拌5min,于45℃水浴中静置4h后,减压抽滤,测定提取液和样品溶液的吸光度和甜菊苷含量,并计算澄清率和甜菊苷的损失率。结果如图1所示。

图1 壳聚糖投加量对澄清效果的影响Fig.1 Effect of chitosan dosage on clarification rate and stevioside loss rate
由图1可知,随壳聚糖投加量的增加,溶液的澄清率逐渐提高,但甜菊苷的损失率也不断增加。当壳聚糖投加量超过2.0mL/g时,溶液的澄清率开始下降,继续增加壳聚糖投加量至2.8mL/g时,溶液的澄清率下降至45.08%,此时,甜菊苷的损失率增加至14.08%。壳聚糖用量较少时,不足以和胶体颗粒、蛋白质、鞣质等杂质分子发生吸附架桥和电中和作用,不能充分使杂质絮凝沉淀;随着壳聚糖加入量的增加,吸附架桥和电中和作用加强,提高了溶液的澄清率,同时,少量甜菊苷也被絮凝沉淀,使甜菊苷的损失率缓慢增加。加入过量的壳聚糖后,溶液的澄清率反而降低,这是因为过量的絮凝剂会使胶体颗粒表面发生二次吸附,使胶粒表面覆盖一层絮凝剂分子,而使其产生再稳定现象,溶液浊度升高,同时,过量的絮凝剂会增加甜菊苷的絮凝损失。因此,综合考虑提取液的澄清率和甜菊苷的损失率,选择壳聚糖投加量以2.0mL/g为宜。
2.1.2 甜叶菊提取液质量浓度对澄清效果的影响
取甜叶菊水提液600mL,平均分成6份,其中一份稀释至1/12(甜叶菊提取液质量浓度,g/mL),一份不变,其余4份则分别浓缩至1/8、1/6、1/4、1/2(g/mL)。按2.0mL/g的投加量分别加入壳聚糖溶液,调pH6.0,搅拌5min,于45℃水浴中放置4h,减压抽滤,测定提取液和样品溶液的吸光度和甜菊苷含量,并计算澄清率和甜菊苷损失率。结果如图2所示。

图2 甜叶菊提取液质量浓度对澄清效果的影响Fig.2 Effect of concentration of water extract from Stevia rebaudiana Bertoni leaves on clarification rate and stevioside loss rate
由图2可知,随甜叶菊水提液质量浓度的提高,澄清率变化不大,而甜菊苷的损失有明显增加。提取液质量浓度较高时,甜菊苷易被所形成的沉淀吸附、包裹,当提取液质量浓度超过1/10(g/mL)时,损失率增加明显。因此,甜叶菊水提液质量浓度以1/10(g/mL)为宜。
2.1.3 体系pH值对絮凝效果的影响

图3 体系pH值对絮凝效果的影响Fig.3 Effect of flocculation pH on clarification rate and stevioside loss rate
取甜叶菊水提液600mL,平均分成6份,按2mL/g的投加量加入壳聚糖溶液,调pH值至3.0、4.0、5.0、6.0、7.0、8.0,搅拌5min,于45℃水浴中放置4h,减压抽滤,测定提取液和样品溶液的吸光度和甜菊苷含量,并计算澄清率和甜菊苷损失率。结果如图3所示。
由图3可知,当提取液pH值小于6.0时,澄清率随pH值的增大而提高,甜菊苷的损失随pH值的增大而减少。这是因为壳聚糖分子上有大量的氨基,在弱酸性(pH6)条件下,氨基显示阳离子性质,与提取液中带负电荷的胶体颗粒、鞣质、蛋白质、色素结合而沉降。酸性越强,壳聚糖氨基所带的正电荷越多,絮凝能力越强,另一方面,也会导致减弱甚至逆转胶体颗粒、鞣质、蛋白质、色素表面的负电性,使其与壳聚糖的结合能力减弱甚至相互排斥,因此,随pH值从6.0下降至3.0,澄清率下降,并伴随着甜菊苷损失的明显增加。当提取液pH值大于6.0时,随着pH值的增大,氨基显示非离子性质,壳聚糖的电中和作用受到抑制,削弱了絮凝作用,故澄清率下降。因此,提取液pH6.0为宜。
2.1.4 体系温度对絮凝效果的影响
取甜叶菊水提液600mL,平均分成6份,按2mL/g加入壳聚糖溶液,调pH6.0,搅拌5min,分别于25、35、45、55、65、75℃恒温水浴中放置4h,减压抽滤,测定提取液和样品溶液的吸光度和甜菊苷含量,计算澄清率和损失率。结果如图4所示。

图4 体系温度对澄清效果的影响Fig.4 Effect of flocculation temperature on clarification rate and stevioside loss rate
由图4可知,当水浴温度低于35℃时,随温度的提高,溶液中的大分子杂质与壳聚糖分子相互碰撞的几率增大,加速了絮凝沉淀的过程,有利于提取液的澄清。温度升高也使甜菊苷的水溶性增强,帮助吸附在絮凝体上的甜菊苷重新返回溶液,减少其损失。当温度过高时(>65℃),易使壳聚糖分子发生老化,影响澄清效果。因此,体系温度选择35~65℃为宜。
2.1.5 絮凝时间对絮凝效果的影响
取甜叶菊水提液600mL,平均分成6份,按2mL/g的投加量加入壳聚糖溶液,调pH6.0,搅拌5min,于45℃水浴中分别放置1、2、3、4、5、6h,减压抽滤,测定提取液和样品溶液的吸光度和甜菊苷含量,计算澄清率和损失率。结果如图5所示。

图5 絮凝时间对澄清效果的影响Fig.5 Effect of flocculation time on clarification rate and stevioside loss rate
由图5可知,随絮凝时间的延长,壳聚糖与胶体颗粒、蛋白质等大分子杂质形成的絮凝沉淀越多且结构稳定,澄清效果好,被吸附的甜菊苷略有增加;当絮凝时间超过4h,澄清率达到最高并稳定在85%以上,溶液中甜菊苷的含量基本保持不变。因此,选择絮凝4h为宜。
2.2 壳聚糖絮凝法澄清甜叶菊水提液正交试验

表2 壳聚糖絮凝法澄清甜叶菊水提液正交试验设计及结果Table 2 Orthogonal array design and corresponding experimental results

表3 澄清率正交试验结果方差分析Table 3 Analysis of variance of clarification rate

表4 损失率正交试验结果方差分析Table 4 Analysis of variance of stevioside loss rate
由表2~4可知,影响提取液澄清率和甜菊苷损失率的4因素的重要程度均依次为壳聚糖投加量(A)>提取液pH值(C)>提取液质量浓度(B)>体系温度(D)。从澄清率角度分析,壳聚糖投加量是影响澄清率的显著因素,最优组合是A2B1C2D3;从损失率角度分析,壳聚糖投加量为极显著因素,pH值是显著因素,最优组合为A1B3C3D3。絮凝除杂是甜菊苷分离纯化前的重要工序,综合考虑澄清率和损失率,较优的工艺组合为A2B2C2D3,即壳聚糖投加量2mL/g、提取液质量浓度1/10(g/mL)、pH6.0、温度45℃、絮凝时间4h。
2.3 壳聚糖絮凝法和膜分离法的比较

表5 壳聚糖絮凝法与膜分离法的比较Table 5 Comparison between chitosan flocculation and membrane separation
Reis[17]等和Silva等[10]采用膜分离法澄清甜叶菊提取液,提取液的澄清率可达到90%以上,甜菊苷损失率低于10%。前者冷水浸提后直接用膜分离法澄清;后者冷水浸提后,经分子筛除杂预处理,再用膜分离法澄清。赵永良等[18]采用膜分离法处理浸提的甜叶菊提取液,提取液澄清率81.13%,损失率11.04%。分析原因可能是当提取液杂质较多时,膜容易污染,影响膜的流通量和分离效果。而壳聚糖絮凝法用于热水浸提液的澄清也能达到相近效果,两者都不会引入无机离子。此外,膜分离法通常需要特殊的设备,单独一次膜分离很难达到理想的效果。如Zhang等[19]通过微滤、超滤、纳滤3次膜处理来澄清甜叶菊提取液,而壳聚糖絮凝法无需特殊的仪器,操作简便。
2.4 壳聚糖絮凝法和传统絮凝法的比较
按照优化的壳聚糖絮凝法和传统化学絮凝法工艺条件对甜叶菊水提液进行预处理,其中化学絮凝法选取了澄清效果较好的絮凝剂与助凝剂组合FeCl3:CaO(质量比,1:2.5)。
壳聚糖絮凝法预处理试验重复验证3次,得甜叶菊提取液的平均澄清率为86.63%,甜菊苷的平均损失率为6.89%。化学絮凝法预处理结果如表6所示。

表6 化学絮凝法澄清试验结果Table 6 Clarification rates and stevioside loss rates using different amounts of FeCl3:CaO as the floccutant
由表6可知,虽然化学絮凝剂的絮凝能力较强,但同时对有效成分的吸附能力也较强,造成了甜菊苷的损失率较高。在取得相近澄清效果的条件下为化学絮凝法85.38%,壳聚糖絮凝法86.63%),两者甜菊苷的损失率差异明显(化学絮凝法26.27%,壳聚糖絮凝法6.89%)。壳聚糖絮凝法能有效的保留溶液中的有效成分,投加量少,安全无毒,完全可以替代传统化学絮凝法。
3 结 论
通过单因素和正交试验优化,得到了壳聚糖絮凝法澄清甜叶菊提取液的较佳工艺条件为壳聚糖投加量2mL/g、提取液质量浓度1/10(g/mL)、提取液pH6.0、体系温度45℃、絮凝时间4h。在上述条件下,甜叶菊提取液的平均澄清率为86.63%,甜菊苷的平均损失率仅为6.89%。壳聚糖絮凝法和膜分离法的澄清效果相近,且无需特殊设备;与传统化学絮凝法相比,壳聚糖絮凝法能更有效的保留甜菊苷,应用过程中不会带入无机离子,具有投加量少,操作简单,安全无毒等优点,是一种适用于工业化生产的絮凝工艺。
[1]HANSON J R, DEOLIVEIRA B H. Stevioside and related sweet diterpenoid glycosides[J]. Natural Product Reports, 1993, 10(3): 301-309.
[2]孙传范, 李进伟. 甜菊糖苷研究进展[J]. 食品科学, 2010, 31(9): 338-340.
[3]GEUNS J M C. Stevioside[J]. Phytochemistry, 2003, 64(5): 913-921.
[4]CHATSUDTHIPONG V, MUANPRASAT C. Stevioside and related compounds: therapeutic benefits beyond sweetness[J]. Pharmacology & Therapeutics, 2009, 121(1): 41-54.
[5]STARRATT A N, KIRBY C W, POCS R, et al. Rebaudioside F, a diterpene glycoside fromStevia rebaudiana[J]. Phytochemistry, 2002, 59(4): 367-370.
[6]倪军明, 李军平. 甜菊糖工业发展现状与前景[J]. 广州食品工业科技, 2004, 20(3): 156-158.
[7]邵佩霞. 蔗糖对酶法改性甜菊糖的影响研究[J]. 食品工业科技, 2010, 31(3): 187-189; 192.
[8]伏军芳, 黄新异, 宋玉民, 等. 甜叶菊水提取液的除杂工艺研究[J].化学世界, 2010, 51(2): 126-128.
[9]MORAES E D P, MACHADO N R C F. Clarification ofStevia rebaudiana(Bert.) Bertoni extract by adsorption in modified zeolites[J]. Acta Scientiarum Universidade Estadual de Maringa, 2001, 23(6): 1375-1380.
[10]SILVA F V, BERGAMASCO R, ANDRADE C M G, et al. Purification process of stevioside using zeolites and membranes[J]. International Journal of Chemical Reactor Engineering, 2007(5): 7.
[11]邵佩霞, 徐仲伟, 王永华, 等. 甜叶菊水提液的高效絮凝新工艺研究[J]. 食品工业, 2009, 30(2): 11-14.
[12]MALSAGOV M, KUALA L, TUGAN T, et al. Process for manufacturing a sweetner and use thereof: US, 0082103 A1[P]. 2007-04-12.
[13]顾正荣, 刘露露. 毛细管电泳法应用于甜菊叶的絮凝工艺[J]. 光谱实验室, 2008, 25(6): 1080-1083.
[14]刑佶勇, 张爱丽, 周集体, 等. 壳聚糖作为絮凝剂的研究进展[J]. 环境科学与技术, 2004, 27(增刊1): 153-155.
[15]陈英, 李永吉, 程淑云, 等. 壳聚糖絮凝法精制红花水提液工艺的研究[J]. 时珍国医国药, 2007, 18(5): 1167-1168.
[16]张雪颖, 徐仲伟, 战宇, 等. 甜叶菊水提液的絮凝研究[J]. 现代食品科技, 2006, 23(2): 8-10.
[17]REIS M H M, DA SILVA F V, ANDRADE C M G, et al. clarification and purification of aqueous stevia extract using membrane separation process[J]. Journal of Food Process Engineering, 2009, 64 (5): 913-921.
[18]赵永良, 韩骁, 刘景彬, 等. 膜分离技术改进传统甜菊糖甙生产工艺的研究[J]. 广州化工, 2010, 37(1): 40-41.
[19]ZHANG S Q, KUMAR A, KUTOWY O. Membrane-based separation scheme for processing sweeteners from stevia leaves[J]. Food Research International, 2000, 33(7): 617-620.
Application of Chitosan Flocculation Method in Clarification of Water Extract fromStevia rebaudianaBertoni Leaves and Flocculation Mechanism Analysis
XIE Jie,LIU Xiao-jing,ZHU Xing-yi,YE Hai-yan,WANG Ping*
(Zhejiang Key Laboratory of Pharmaceutical Engineering, College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
The effect of chitosan flocculation on clarifying water extract fromStevia rebaudianaBertoni leaves, prepared by twice repeated water extraction at a solid/liquid ratio of 1:10 (g/mL) followed by pooling and then rotary evaporation concentration of two extracts, was studied. Clarification rate and stevioside loss rate were investigated with respect to different factors. Using orthogonal array design method, the optimal process conditions for chitosan flocculation were determined as follows: ratio between 1% acetic acid solution of chitosan and driedStevia rebaudianaBertoni leaves 2:1 (mL/g), 1-fold concentration of pooled extracts fromStevia rebaudianaBertoni leaves, pH 6.0, flocculation temperature 45 ℃, and flocculation time 4 h. Under these conditions, a clarification rate of 86.63% and a stevioside loss rate of 6.89% were achieved. Chitosan flocculation without the need for special equipment had similar effectiveness to that of membrane separation in clarifying water extract fromStevia rebaudianaBertoni leaves. Compared with the conventional chemical flocculation, chitosan flocculation could more effectively retain effective ingredients in the water extract and had the advantages of effective flocculation, ready biodegradation, environmental safety and non-secondary contamination.
Stevia rebaudianaBertoni;stevioside;chitosan;flocculation;clarification
TS202.3
A
1002-6630(2011)20-0001-06
2010-10-28
浙江省重点国际合作项目(2009C14001)
谢捷(1978—),女,讲师,博士研究生,研究方向为天然产物。E-mail:xiejie97@sohu.com
*通信作者:王平(1969—),女,教授,博士,研究方向为天然产物。E-mail:pharmlab@zjut.edu.cn

