创伤后应激障碍大鼠前额内侧皮质MR表达的变化
张景华李 慢石玉秀*韩芳*
(1中国医科大学基础医学院组织学与胚胎学教研室,沈阳 110001;2沈阳军区总医院神经内科,沈阳 110016)
创伤后应激障碍大鼠前额内侧皮质MR表达的变化
张景华1,2李 慢1石玉秀1*韩芳1*
(1中国医科大学基础医学院组织学与胚胎学教研室,沈阳 110001;2沈阳军区总医院神经内科,沈阳 110016)
目的 观察创伤后应激障碍(PTSD)样大鼠前额内侧皮质(medial prefrontal cortex,mPFC)神经元核受体-盐皮质激素受体(Mineralocorticoid receptors,MR)表达的变化。方法 采用国际认定的单一连续应激(single prolonged stress,SPS)方法建立 PTSD大鼠模型,取成年健康雄性Wistar大鼠90只,随机分为 PTSD模型1d、7d、14d、28d和正常对照组。采用免疫组化、免疫印迹和RT-PCR方法分别进行各组mPFC神经元MR表达变化的观察及检测,进行图像分析和统计学处理。结果 PTSD大鼠mPFC神经元MR的表达在SPS-1d时高于对照组,随后下降,SPS-14d最低,SPS-28d恢复性上调,但仍然低于对照组(P<0.05)。结论 PTSD模型大鼠经SPS处理后,mPFC中出现MR表达的变化,该变化可能参与PTSD的下丘脑-垂体-肾上腺(hypothalamic pituitary adren axis,HPA)轴的变化机制。
创伤后应激障碍; 前额内侧皮质; 盐皮质激素受体; 大鼠
创伤后应激障碍(posttraumatic stress disorder,PTSD)患者及模型动物有下丘脑-垂体-肾上腺(hypothalamic pituitary adren axis,HPA)轴的功能障碍[1],同时血中糖皮质激素(glucocorticoid,GC)处于低水平状态[2]。因此研究 HPA轴的功能对于PTSD患者极为重要,GC对 HPA轴的负反馈是通过其高密度皮质类固醇激素受体(corticosteroid receptor,CsRs)完成的[3]。脑内 CsRs可分为 I型和Ⅱ型。I型对皮质酮有高亲和力并与人类盐皮质激素受体(Mineralocorticoid Receptors,MR)相似,而Ⅱ型对皮质酮亲和力低,相当于人的糖皮质激素受体 (Glucocorticoid Receptors,GR)[4]。MR及GR均参与了 HPA轴的生理调节,MR参与基础水平 HPA轴的负反馈调节,它介导 HPA轴基础活性的维持且与中枢应激反应阈值及敏感性有关[5]。由于脑内的MR的作用与大部分外周的作用不同,对于脑内的MR特别是mPFC的研究较少,因此,我们研究了PTSD大鼠mPFC-MR的变化,为进一步揭示PTSD的HPA轴改变机制提供实验依据。
材料和方法
1.实验动物及分组
成年健康Wistar品系雄性大白鼠90只,体重150-180g(中国医科大学实验动物中心提供)。实验室条件饲养,于实验前在动物房内正常喂养一周后,随机分为5组,对照组、SPS后无干扰地静养1d、7d﹑14d和28d组,每组18只,每组中6只做免疫组化,6只做免疫印迹,6只做RT-PCR。
2.SPS(single prolonged stress)动物模型的建立
采用2005年日本文部省召开的国际PTSD科学会议确定的关于大鼠PTSD模型-SPS建立的方法,其具体方法是将大鼠连续进行下述步骤处理:
2.1 Immobilization(禁锢刺激)2 h,要求仅尾部能活动其他全身各处均不能活动;
2.2 Forced swimming(强迫游泳)20min(水深40cm,水温25℃)之后休息15min;
2.3 Ether anesthesia(乙醚麻醉 )意识丧失后停止麻醉;
2.4 Undisturbed(无干扰喂养)常规喂养。
3.MR免疫组织化学SABC法染色
分别取各组大鼠依次麻醉(用2%戊巴比妥腹腔内注射),4%的多聚甲醛灌流固定,取大脑,于同种固定液中继续固定3h,梯度酒精脱水,二甲苯透明,浸蜡,石蜡包埋,切片5μm厚。根据鼠脑图谱确定mPFC的位置[6]。然后依次经 3%H2O2-dH2O10min,5%BSA封闭20min后,滴加兔多克隆抗体MR(工作浓度为 1∶500,Santa Cruz Biotechnology),0.01mol/L PBS代替一抗作阴性对照,4℃孵育过夜,滴加生物素化山羊抗兔 IgG37℃、30min,滴加 SABC37℃、20min,以上各步间均用0.01mol/LPBS 漂洗 ,之后 DAB(武汉博士德)显色,酒精系列上升梯度脱水(酒精85%5min、90%5min、95%5min、100%10min、100% 10min),二甲苯透明(10min、10min),中性树胶封片。光学显微镜(OL YM PUS,BX60,Japan)下观察 mPFC中 GR的表达,摄片。
4.免疫印迹(Western blot)检测mPFC中MR的表达
冰上直接断头快速取出正常及SPS模型处理后1d、7d、14d和 28d的 mPFC组织,组织经匀浆,超声粉碎后高速低温离心,12000rmp/min,取上清;采用考马斯亮蓝法测定蛋白浓度3mg/ml,10%SDS-PAGE凝胶电泳,浓缩胶90v,分离胶110v;转印,剪裁目的条带,5%脱脂奶粉封闭2h,鼠多克隆抗体MR(工作浓度1:1000),4℃过夜;TBST洗4×10min,HRP标记的羊抗鼠 IgG(工作浓度1:5000)孵育2h,TBST洗4次×10min,ECL显色。应用 Fluorchem Ⅴ2.0系统进行吸光度测定,以目的条带与内参照β-actin的平均吸光度的比值表示蛋白水平,进行分析。
5.RT-PCR检测mPFC的 MR-mRNA
5.1 总 RNA提取:如上法取 50-100mg的mPFC组织.加入1ml Trizol溶液(TaKaRa)充分混匀,室温放置5min使其充分裂解;12000rpm离心5min,弃沉淀;加入200μl氯仿,振荡混匀后室温放置15min;4℃12000rpm离心15min;吸取上层水相,至另一离心管中;加入0.5m1异丙醇混匀,室温放置 10min;4℃12000rpm离心 10min,弃上清,RNA沉于管底;加入lml 75%乙醇,温和震荡离心管,悬浮沉淀;4℃8000rpm离心5min,尽量弃上清;室温干燥 30min;用 50μl的 0.1%DEPC水溶解RNA样品;提取的RNA保存于-80℃超低温冰箱中,或立即用于逆转录,测量OD260/OD280,定量,电泳鉴定RNA质量。
5.2 总RNA逆转录成cDNA:在微量离心管内配制下列反应液,包括①模板 RNA溶液1μg,5×RT Buffer 4μ1, ③dNTP Mixture(lOmM each)2μ1,④Oligo(dT)18 Primer 20U, ⑤AMV Reverse Transcriptase 10U,⑥0.1%DEPC 水调体积至20μl。轻轻搅拌;室温放置10min后移入42℃恒温水浴中;42℃保温1h,在冰水中冷却2min。所得到的反应液可用于PCR反应。
5.3 PCR扩增:引物序列,见附表。扩增体系①TaKaRa Taq(5U/μ1)0.25μ1, ② 10 X PCR Buffer 5μ1,30dNTP Mixture(lOmM each)2μ1 ④模板 cDNA 2.5ng⑤引物 1(20uM)1μ1,⑥引物 2(20μM)1μ1,⑦灭菌蒸馏水调体积至 50μl。扩增条件:循环1,94℃4min,循环2,94℃45s,60℃45s,72℃50s,共36个循环,循环3,72℃10min。反应结束后,扩增产物5μL经1%琼脂糖凝胶电泳,采用凝胶成像系统成像并分析记录。mRNA相对表达=样品扫描值/β-actin扫描值。

表1 MR和内参的引物序列Table 1 The sequence of MR andβ-actin
6.图像分析及统计学处理
采用Motic Images Advanced 3.2图像分析系统,免疫组化结果为每只大鼠选取3张切片,在相应的mPFC内测量每高倍镜(10×40倍)视野内MR的吸光度,即分光密度值(OD),每张切片选3-5个视野,计算每张切片每个视野的OD值,取平均值作为本只大鼠的OD值,然后根据每只大鼠的OD值,计算每组大鼠的平均OD值,数据用(±s)表示,所测数据采用 SPSS13.0 for windows软件进行统计学分析,各组之间ANOVA法进行方差分析,P<0.05表示有差异。Western blot和 RT-PCR的结果进行图像扫描后分析各条带的平均灰度值,计算各组大鼠的平均灰度值,数据用(±s)表示,数据统计方法处理同上。
结 果
1.免疫组化结果
高倍镜观察 MR分布于 mPFC(图1):对照组(图1A)MR分布于神经元的胞体;SPS-1d组(图1B)与对照组相比,MR的阳性表达增强,阳性神经元数量也增多;SPS-7d组(图1C)和 SPS-14d组(图1D)MR的阳性表达逐渐降低,阳性神经元数目也减少,均低于正常对照组,SPS-28d组(图1E)阳性表达恢复性增加,但仍低于对照组(P<0.05),分析结果见(图1F)。
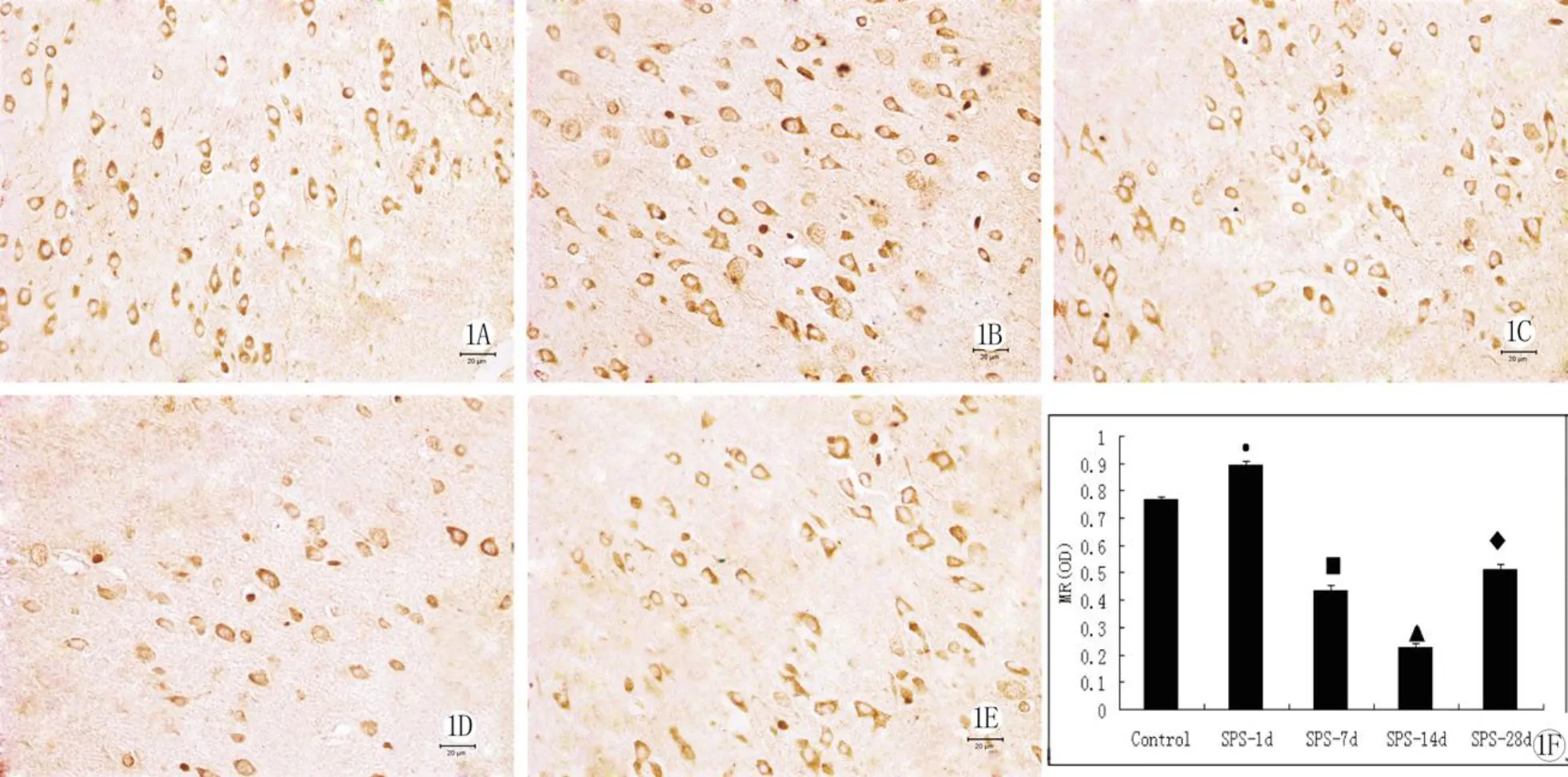
图1A 对照组MR的表达,免疫组织化学染色可见大量棕黄色的阳性细胞 ;图1B SPS刺激1d后MR的表达,免疫组织化学染色可见大量棕黄色的阳性细胞;图1C SPS刺激7d后MR的表达,免疫组织化学染色可见大量棕黄色的阳性细胞;图1D SPS刺激14d后MR的表达,免疫组织化学染色可见大量棕黄色的阳性细胞;图1E SPS刺激28d后MR的表达,免疫组织化学染色可见大量棕黄色的阳性细胞;图1F模型组和对照组免疫组化MR分光密度值的分析结果,、■、▲、◆均代表与对照组相比两者之间的差异(P<0.05).Fig.1A At normal control,MR positive cell brow;Fig.1B At 1d after SPS,MR positive cell brown;Fig.1C At 7d after SPS,MR positive cell brown;Fig.1D At 14d after SPS,MR positive cell brown;Fig1E At 28d after SPS,MR positive cell brown;Fig1F,Immunohistochemistry analysis of MR protein in the model groups and control group, 、■、▲、◆P<0. 05.
2.MR-mRNA免疫印迹的结果
β-actin和MR的分子量分别为42kb和112kb,结果显示SPS后1dmPFC的MR的表达增加,7d和14d大鼠mPFC的MR的表达逐渐下调,28d组MR表达恢复性上调,但仍然高于低于对照组(图2)。蛋白表达随时间变化与免疫组化结果OD值随时间变化一致。

图2 A:mPFC的MR的Western blot分析;B:MR各组条带的灰度值,、■、▲、◆均代表与对照组相比较两者之间差异(P<0.05)。Fig.2 A:Western blot analysis of MR in mPFC of PTSD rats.B: 、■、▲、◆P<0.05 vs control group.
3.RT-PCR 结果
β-actin和 MR在 mPFC都表达,以β-actin作为内参照(图3)。与正常对照组相比,SPS-1d MR的表达上调,4d和7d表达急剧下调。28d有所回调,但仍低于正常。各组随时间变化趋势与Western blotting一致。
讨 论
以往的研究对于大鼠的MR在中枢的作用较GR研究少,以往认为MR主要是在上皮细胞中起调节水盐平衡的作用,目前认为MR在脑内组织存在,尤其是海马大量存在,并且GR和MR可共存于一些脑区,如海马的 CA1、CA2、CA3亚区和齿状回[7]。海马内MR与上皮细胞中MR对盐皮质激素(醛固酮)的选择作用不同。受到刺激后,GC同时与 GR和MR两套受体结合,而且,皮质酮与MR结合亲合力约是与 GR的10倍。低水平 GC首先与MR结合,只有高水平 GC才能在MR饱和后与GR结合。MR是高亲和力和低容量的 GC受体系统,而 GR为低亲和力和高容量的 GC受体系统[8]。

图3 A:mPFC的MR的RT-PCR分析;B:MR各组条带的灰度值,、■、▲、◆均代表与对照组相比两者之间的差异(P<0.05).Fig.3 A:RT-PCR analysis of MR in mPFC of PTSD rats. B: 、■、▲、◆P<0.05 vs control group.
皮质酮通过MR介导的效应,也受到 GR的调节。GR在应激后的 GC的生理节律上升期不断被占领结合,GC再通过负反馈效应作用于PVN(下丘脑室旁核)。MR活动占优势时,海马维持着兴奋性,并经跨突触抑制性投射至 PVN,抑制基础性HPA活动。相反,随着 GC浓度的上升,激活的 GR抑制了海马的信号输出,导致PVN神经元的去抑制。两类受体调节的功能是相互关联的[9]。MR缺陷将使皮质酮反应更快速地出现,并产生更明显的GR介导效应。上述资料说明,MR和GR介导的效应均衡性在 HPA调节中的重要性。因此,越来越多的研究支持受体介导作用的平衡学说,认为MR主要维持GC的作用,而 GR主要参与 GC的负反馈作用[10]。由于MR对 GC的亲合力比 GR的高,故在HPA轴激活初期或基础水平,GC首先与海马的MR结合,维持 HPA的基础活动,称为兴奋前反馈(proactive feedback)。当 GC浓度继续升高,高浓度GC不断与 GR结合,通过 GR的负反馈抑制HPA轴活动,称为反应性反馈(reactive feedback)[11]。GC通过MR、GR介导的两种反馈模式使HPA活动处于适当的水平,MR/GR介导作用失衡将导致疾病的发生。长期异常的皮质类固醇激素水平,不仅影响海马细胞反应,而且在事实上危害细胞生存[12]。因此,海马同样作为 HPA轴的一个调控部位起作用。
有研究证实除海马外前额内侧皮质同样有MR存在,在小鼠前脑选择性的敲除MR,会损伤小数的空间学习能力,相反,在前脑选择性的过表达MR,会导致小鼠应激后焦虑样行为减少[9],说明在脑内海马外区同样有MR的存在,但其作用机制尚不明确,在本实验中可以在mPFC观察到有MR的表达,而且主要在胞质中表达,考虑尚未进入核内发生转录的作用,在SPS后出现MR的快速上调,7天后即出现下调,说明在应激时不仅有海马部位 GR的反馈调节性的增高,同样有 mPFC的 MR改变,此后MR表达逐渐减低,至28天时又有所恢复,但仍与实验前有差别,说明mPFC的MR在 HPA轴的调节中有变化,在PTSD的实验动物中有时间性的改变,但是mPFC中MR的变化是 HPA轴变化的结果,还是 MR的改变导致 HPA轴的变化,由于MR作用与 GR密切相关,即使在相同细胞中也可起到不同的作用,因此仍需大量的实验来证实MR的改变机制。
本实验利用免疫组化和免疫印迹等技术从蛋白水平揭示了mPFC-MR的存在,并且在 PTSD实验动物中有量的变化,为揭示PTSD的发病机制提供了实验依据。对进一步探讨相关作用机制与有效干预措施,揭示 PTSD神经生物学致病机制、开辟治疗新途径可能有重要意义。但是本实验仅局限于对PTSD样大鼠mPFC-MR受体的研究,关于其他部位受体变化及其对HPA-axis的影响有待于进一步研究。
[1]Yehuda R,Holligam SL.The cortisol and glucocorticoicl receptor response to low does dexamethason administration in aging combat veterans and lulocauet survivors with and without posttraumatic stress disorder.Biol psychiatry,2002,52(5):393-403
[2]Bachmann AW,Sedgley TL,Jackson RV,et al.Glucocorticoid receptor polymorphisms and post-traumatic stress disorder. Psychoneuroendocrinology,2005 ,30(3):297-306
[3]Nagalski A,Kiersztan A. Physiology and molecular mechanism of glucocorticoid action.Postepy Hig Med Dosw,2010,18(64):133-145
[4]de KloetER.Stress:a neurobiologicalperspective.Tijdschr Psychiatr,2009,51(8):541-550
[5]Rogalska J.Mineralocorticoid and glucocorticoid receptors in hippocampus:their impact on neurons survival and behavioral impairment after neonatal brain injury.Vitam Horm,2010,3(82):391-419
[6]Paxinos g,Watson c,Emson PC.AChE-stained horizontal sections of the rat brain in stereotaxic coordinates.J Neurosci Methods,1980,3(2):129-149
[7]Zhe D,Fang H,Yuxiu S.Expressions of hippocampal mineralocorticoid receptor(MR)and glucocorticoid receptor(GR)in the single-prolonged stress-rats.Acta Histochem Cytochem,2008,41(4):89-95
[8]De Kloet ER,Vreugdenhil E,Oitzl MS,et a1.Brain corticosteroid receptor balance in health and disease.Endocr Rev,1998,19(3):269-330
[9]Kolber BJ,Wieczorek L,Muglia LJ.Hypothalamic-pituitary-adrenal axis dysregulation and behavioral analysis of mouse mutants with altered glucocorticoid or mineralocorticoid receptor function.Stress,2008,11(5):321-338
[10]Sousa N,Cerqueira JJ,Almeida OF.Corticosteroid receptors and neuroplasticity.Brain Res Rev,2008,57(2):561-570
[11]Nishi M,Kawata M.Dynamics of glucocorticoid receptor and mineralocorticoid receptor:implications from live cell imaging studies.Neuroendocrinology,2007,85(3):186-192
[12]Michael K,Baker DG,Alexander Y,et al.Mineralocorticoid Receptor Function in Patients With Posttraumatic Stress Disorder.Am J Psychiatry,2002,159(56):1938-1940
Change in expression of mineralocorticoid receptors in medial prefrontal cortex of rats with posttraumatic stress disorder
Zhang Jinghua1,2,Li Man1,Shi Yuxiu1*,Han Fang1*
(1Department ofHistology and Embryology,College of B asic Medical Sciences,China Medical University,S henyang110001,Department of Neurology,The General Hospital of S hengyang Military Region,S henyang110016,China)
Objective To observe the expression of mineralocorticoid receptors(MR)in the medial prefrontal cortex(mPFC)of rats with posttraumatic stress disorder(PTSD).Methods The single prolonged stress(SPS)method was used to set up the rat PTSD models.A total of 90 male Wistar rats were randomly divided into 1d,7d,14d,28d of SPS groups and normal control group.Immunohistochemistry,Western blotting,RT-PCR,image analysis and statistical analysis were used to detect the activity of MR.Results The activity of MR in mPFC neurons increased at 1d after exposure to SPS compared with that of the control group,then gradually decreased,reached the minimum at 14d,and restored to 28d,but still lower than that of the control group(P<0.05). Conclusion The expression of MR may be related to the pathogenesis of HPA.
Posttraumatic stress disorders; Medial prefrontal cortex; Mineralocorticoid receptors; Rat
R332.8
A
10.3870/zgzzhx.2011.01.002
2010-08-12
2010-11-23
国家自然科学基金资助(30600341)
张景华,女(1970年),汉族,博士研究生。
*通讯作者(To whom correspondence should be addressed)

