表柔比星-镁体系与DNA相互作用初步研究
张改清 杨曼曼 席小莉 杨 频
(1山西大学分子科学研究所,化学生物学与分子工程教育部重点实验室,太原 030006)
(2吕梁高等专科学校化学化工系,吕梁 033000)(3山西大学化学化工学院,太原 030006)
表柔比星-镁体系与DNA相互作用初步研究
张改清2杨曼曼3席小莉*,1杨 频1
(1山西大学分子科学研究所,化学生物学与分子工程教育部重点实验室,太原 030006)
(2吕梁高等专科学校化学化工系,吕梁 033000)(3山西大学化学化工学院,太原 030006)
表柔比星是临床上用于治疗快速增殖肿瘤的药物。本文应用紫外、荧光、圆二色、黏度、凝胶电泳等方法研究了表柔比星-Mg2+体系与DNA的作用。结果发现:在pH=7.4时,表柔比星可与Mg2+形成稳定体系。加入DNA后表柔比星-Mg2+体系的紫外吸收明显降低;Scatchard图表明表柔比星-Mg2+体系对溴化乙锭(EB)与DNA的结合为竞争性抑制;同时此体系可使DNA-EB体系荧光偏振度增大;使DNA的热变性温度(Tm)上升;黏度增大;凝胶电泳表明表柔比星-Mg2+体系对pBR322DNA有非常好的切割活性;圆二色谱法表明随着表柔比星-Mg2+体系的加入,DNA碱基间作用能迅速减弱,二级结构发生了显著的变化。综上所述:表柔比星-Mg2+体系与DNA之间为嵌插作用;且表柔比星-Mg2+体系具有更好的切割活性。这些结果,可为合理改善药效和设计新药提供依据。
表柔比星-Mg2+体系;CT DNA;Scatchard图
新型抗癌药剂的开发和抗癌机理研究,一直是人们争相研究的前沿课题[1-5]。而许多治疗癌症的药物大都是以DNA为靶分子来设计的[6-7]。全面了解与掌握活性小分子和DNA的作用,对药物的设计具有指导作用。表柔比星是一种新的蒽环类抗生素,具有广谱抗肿瘤活性。细胞培养研究表明,该药可迅速透入细胞,进入细胞核,抑制核酸的合成和有丝分裂,常用于治疗包括L1210和P388白血病、肉瘤SA180(团块性,腹水型)、淋巴瘤、乳腺癌、卵巢癌、胃癌,黑色素瘤B16、乳腺癌、路易斯肺癌以及结肠癌38等。在前面的文章中我们课题组研究了表柔比星铜体系与DNA的作用[8],本文应用光谱等手段研究了表柔比星-Mg2+体系与小牛胸腺DNA的作用,发现生命金属镁与表柔比星形成的稳定体系能够与DNA发生作用,并引起其一系列的性质变化。
1 实验部分
1.1 仪器和试剂
Varian 50bio型紫外分光光度计;Perkin-Elmer LS-50B型荧光光谱仪;Shimadzu FTIR8400S光谱仪,KBr压片;Biologic MOS-450圆二色谱仪;Ubbelodhe黏度计;BECKMANΦ50pH计;小牛胸腺DNA(华美生物工程公司),溶液纯度以A260nm/A280nm>1.8衡量,浓度以260 nm处的吸光度来确定(ε=6 600 L·mol-1·cm-1),于 4 ℃冰箱保存备用;缓冲液由0.1 mol·L-1Tris溶液和 0.1 mol·L-1盐酸配制 (pH=7.2);溴化乙啶 (EB)(舒伯韦公司);盐酸表柔比星(Epirubicin,Scheme 1)由济南富创医药科技有限公司提供纯品(含量不低于99%),其化学名为(7S∶9S)-9-羟乙酰基-4-甲氧基-7,8,9,10-四氢-6,7,9,11-四羟基-7-O-(2,3,6-三去氧-3-氨基-α-L-阿拉伯吡喃糖基)-5,12-萘二酮盐酸盐;pBR322 DNA购自宝生物工程(大连)有限公司,pBR322 DNA为应用最广的质粒DNA,是分子克隆技术中的重要载体呈共价闭合环状超螺旋状态,长度为4363 bp,分子量为2.88×106Da。本次实验所用pBR322 DNA纯度符合两个要求(1)含70%以上的双链Covalently closed circular form Ⅰ(RFI);(2)在 TE Buffer(pH 8.0)条件下:A260nm/A280nm≥1.8。其他试剂均为国产分析纯试剂。

Scheme 1 表柔比星(Epirubicin)结构式
1.2 实验方法
1.2.1 表柔比星-Mg2+体系的吸收光谱特征
1.2.1.1 表柔比星-Mg2+体系的制备及其红外、吸收光谱特征
将MgCl2和药物表柔比星(Epirubicin)分别配成1×10-4mol·L-1的溶液,然后将表柔比星溶液逐滴滴加入MgCl2溶液中,在一定酸度及波长条件下,测定溶液的吸光度。将所得吸光度对cR/cM作图。当药物的量较小时,金属离子没有被完全配合。随着药物的量逐渐增加,金属离子与药物配合、直至饱和,这时药物的量再增多吸光度也不会增大。运用外推法得一交点,从交点向横坐标作垂线,对应的cR/cM比值就是表柔比星镁体系的配合比n。实验发现在pH=7.4时Mg2+可与表柔比星形成1∶1的稳定体系(以下简写为Epirubicin-Mg2+system);同时采用连续变化法作对照,测定了此体系的表观摩尔吸光系数,表观稳定常数及组成比,其具体数据见表1,可见两者都支持Mg2+和表柔比星可形成1∶1的稳定体系;进而应用分子模拟优化得到如图1示出的配位形式。
由图2可看出,表柔比星在 3 427.632 cm-1处的峰值经过与镁作用后变为3 416.667 cm-1;在1 633.771 cm-1处 的 峰 变 为 1 640.351 cm-1;在1407.895 cm-1处的峰值变为 1429.825 cm-1;以上结果表明表柔比星与Mg2+结合后,C=O、-OH峰均发生了一定的变化。同时,在 1537.281 cm-1及 673.112cm-1处又出现了2个新的峰,其中673.112 cm-1处的峰有可能是金属与配合物中的配位键M-L所产生的振动[9]。

表1 表柔比星镁体系的有关参数Table 1 Parameter of Epirubicin metal system
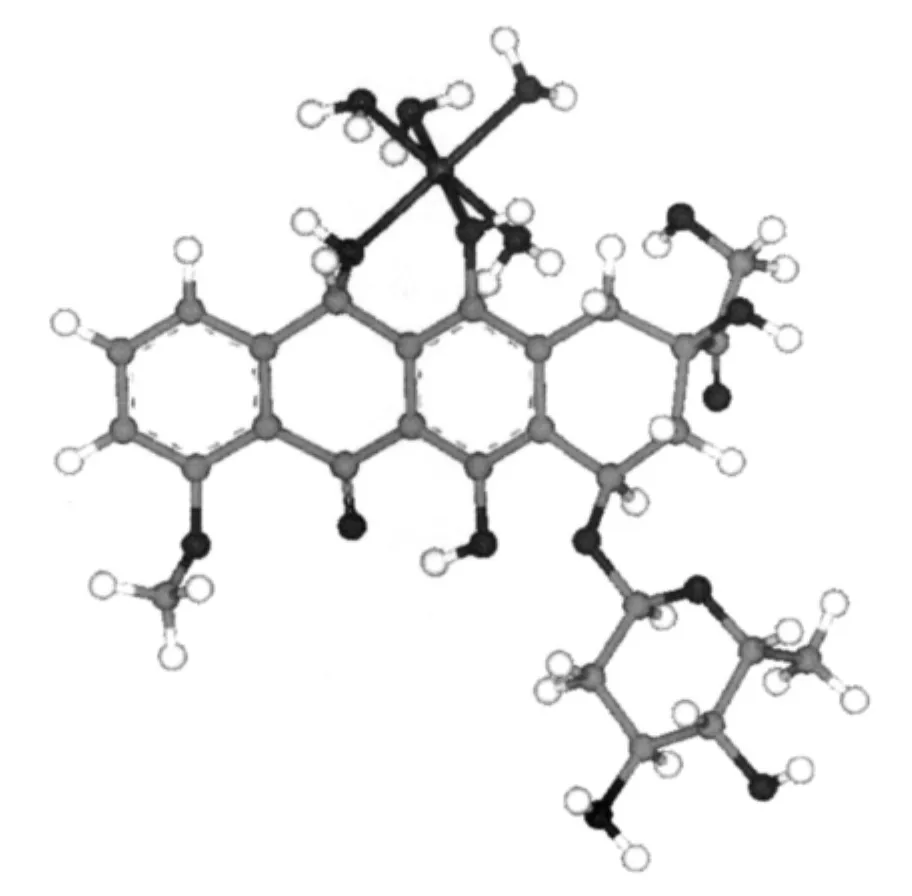
图1 最优化的表柔比星-Mg2+体系的结构Fig.1 Optimized structure of the Epirubicin-Mg2+system
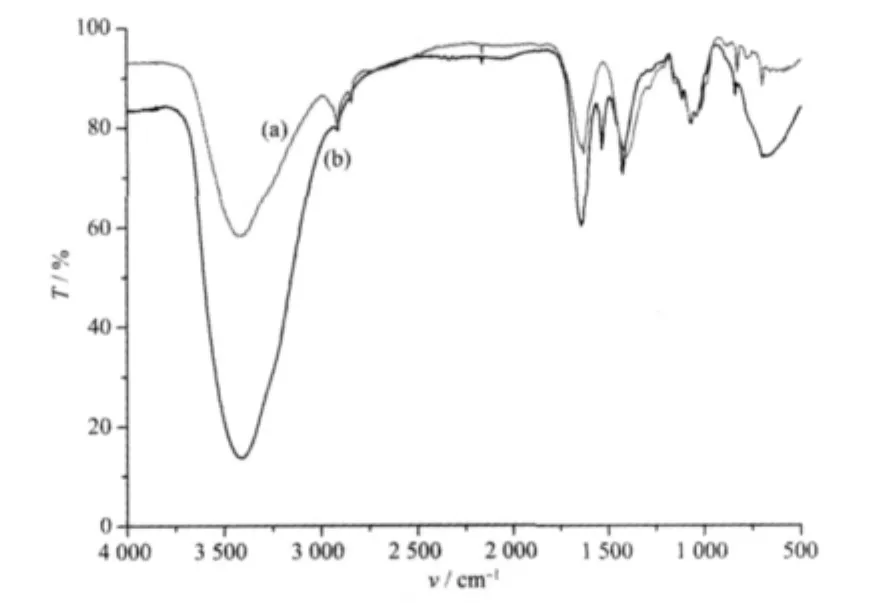
图2 表柔比星及表柔比星-Mg2+体系的IR光谱图Fig.2 IR spectra of Epirubicin(a)and Epirubicin-Mg2+(b)
1.2.1.2 表柔比星及表柔比星-Mg2+体系与DNA的吸收光谱
以缓冲溶液作为空白对照液,样品池为表柔比星或表柔比星-Mg2+,浓度 c 均固定为 15 μmol·L-1,然后向此样品池中逐次加入DNA溶液,使得在室温下,反应30 min后,进行紫外扫描。
1.2.2 Scatchard图及荧光偏振度
在荧光测定中,固定 DNA 浓度为 2.5 μmol·L-1,逐次滴加表柔比星及表柔比星-Mg2+体系,使得室温下,反应30 min后,再将100 μg·mL-1EB溶液加入上述表柔比星及表柔比星-Mg2+体系,激发波长520 nm,狭缝宽度6 nm,测定其荧光发射谱。数据按Scatchard方程[10]处理,以r/c对r作图(r是与DNA分子中每个核苷酸成键的EB分子数,c是游离EB的浓度)。
在荧光偏振度测定中,固定EB-DNA浓度为2.5 μmol·L-1,使得表柔比星及表柔比星-Mg2+体系的浓度分别为9,12,15,18,21,24,27。室温下,反应 30 min 后,利用荧光仪的偏振功能,取激发波长520 nm,狭缝宽度6 nm,测定其荧光发射谱。数据按下式计算[11]

式中,P为偏振度,FVV和FVH分别为垂直偏振光激发下的垂直偏振发射光强度和水平偏振发射光强度;FHV和FHH分别为水平偏振光激发下的垂直偏振发射光强度和水平偏振发射光强度。
1.2.3 热变性研究
配制DNA-EB溶液(cDNA/cEB=20)和DNA-EB-Epirubicin(cDNA/cEB=20,cEB=cEpirubicin)及 DNA-EB-(Epirubicin-Mg2+)(cDNA/cEB=20,cEB=cEpirubicin-Mg2+)溶液,在不同温度下测定其荧光强度。
1.2.4 黏度测定
小牛胸腺DNA浓度固定为1 mmol·L-1,表柔比星及表柔比星-Mg2+体系浓度依次增大,温度恒定在(28±0.1)℃,反应30 min后,进行测量。数据以(η/η0)1/3对表柔比星及表柔比星-Mg2+体系浓度作图。η代表DNA在出现表柔比星及表柔比星-Mg2+体系时黏度,η0代表DNA单独存在时的黏度。
1.2.5 表柔比星-Mg2+体系与质粒pBR322作用的电泳实验
在 20 μL 5 mmol·L-1Tris-HCl(pH 7.40,5mmol·L-1NaCl)缓冲液中,加入一定体积(即不同浓度)的表柔比星及表柔比星-Mg2+和pBR322溶液,混匀,然后在37℃恒温水浴中恒温4 h,通过加入EDTA和溴酚蓝终止反应,然后应用琼脂糖凝胶电泳分析结果、从中选出表柔比星-Mg2+浓度为 1.0×10-5mol·L-1做时间梯度实验, 体系恒温分别为 0.5,1,2,4,6,8 h。然后应用琼脂糖凝胶电泳分析结果(图谱做为支持材料),然后选出4 h为合适时间做羟基自由基清除剂实验。
1.2.6 圆二色谱(CD)的测定
室温下,取 2.5 mL 的 DNA(cDNA=2.59×10-4mol·L-1)溶液于一系列10 mL比色管中,然后依次加入不同体积的表柔比星及表柔比星-Mg2+体系溶液,定容后震荡摇匀,测定圆二色谱;以相应的Tris-HCl缓冲溶液为参比溶液,样品池为1 cm石英吸收池。
2 结果与讨论
2.1 吸收光谱研究
图3中a为表柔比星与DNA作用的紫外吸收光谱,b为表柔比星-Mg2+体系与DNA作用的紫外吸收光谱,每个图中曲线1为表柔比星及表柔比星-Mg2+的紫外吸收光谱,曲线2~10为它们中加入DNA后的紫外吸收光谱,由图可见当加入DNA后表柔比星-Mg2+的最大吸收峰强度减小。根据文献报道[12-14],当小分子以嵌入方式结合于CT-DNA双螺旋碱基对之间时,其吸收光谱表现出减色效应;当小分子以静电方式结合于CT-DNA时,其吸收光谱表现出增色效应;因此,此时表柔比星-Mg2+与CT-DNA之间的相互作用应以嵌入方式为主。
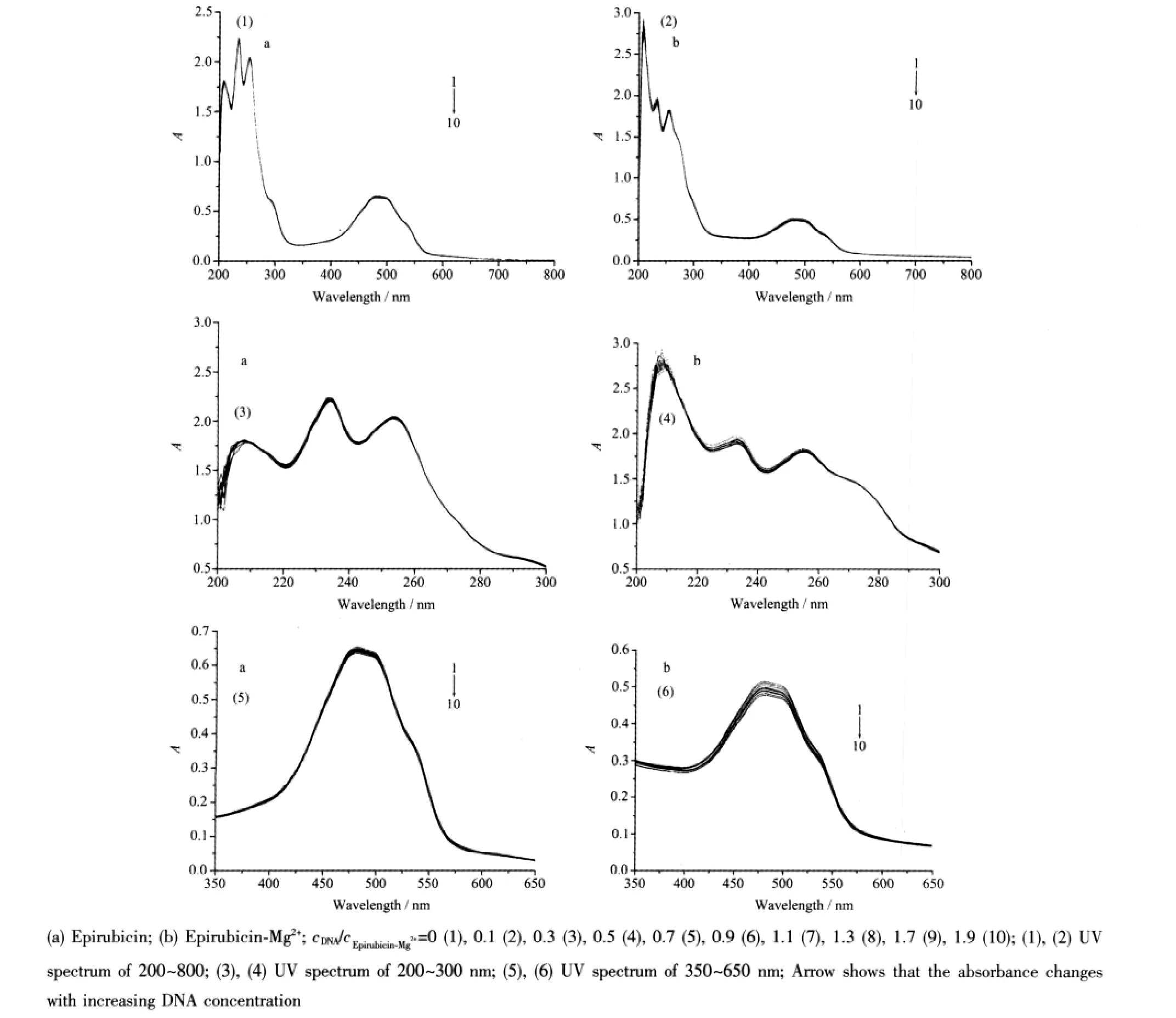
图3 表柔比星及表柔比星-Mg2+与DNA的紫外吸收谱Fig.3 UV absorption spectra of Epirubicin Epirubicin-Mg2+increasing concentration of DNA
2.2 Scatchard图及荧光偏振度研究
2.2.1 表柔比星-Mg2+及表柔比星对DNA-EB抑制作用类型分析
利用表柔比星-Mg2+体系存在下DNA与EB作用的Scatchard图,可判别表柔比星-Mg2+体系的作用方式[10]。每个图中最右侧线为单独EB与DNA的Scatchard线。
图4显示,在不同浓度的表柔比星-Mg2+体系存在下,Scatchard图是几条不平行的直线。表明随着表柔比星-Mg2+体系浓度的增大,DNA与EB的结合常数发生变化,因此,表柔比星-Mg2+体系与EB在DNA上的结合位点是竟争型的。
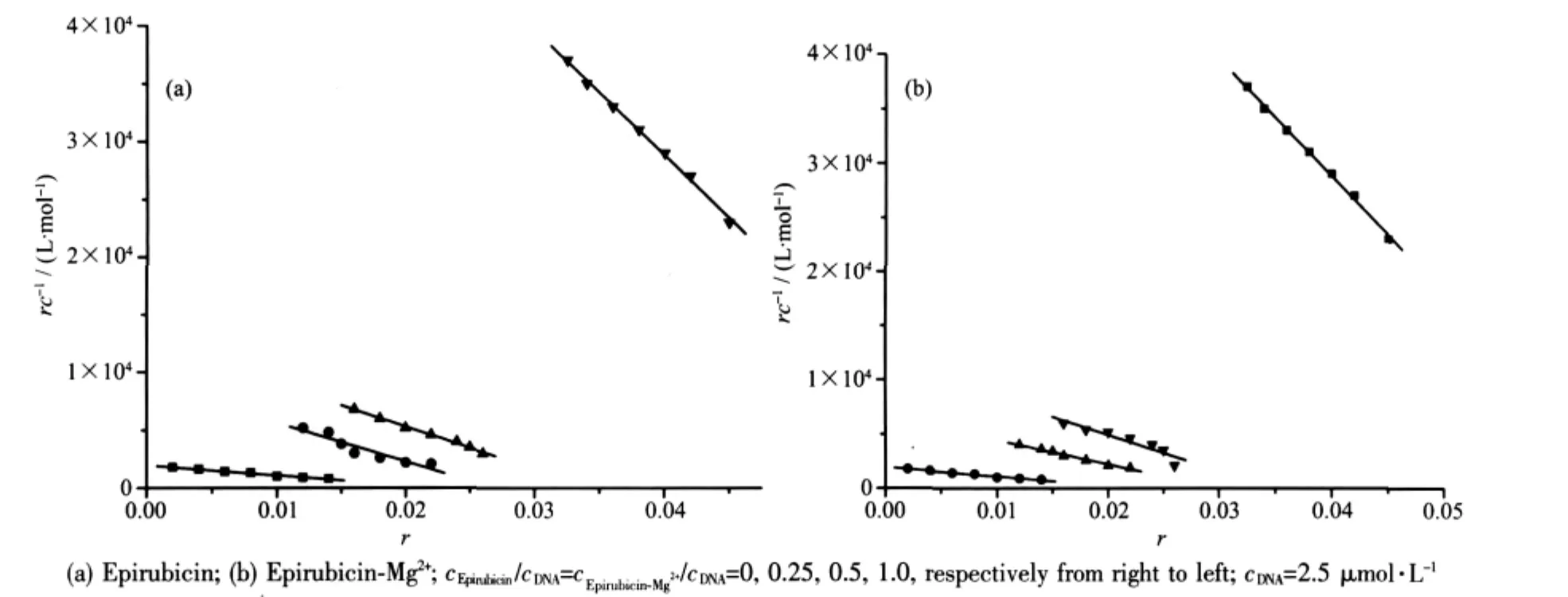
图4 不同浓度的表柔比星及表柔比星-Mg2+体系存在下DNA与EB作用的Scatchard图Fig.4 Fluorescence Scatchard plots of increasing concentration of complex
2.2.2 表柔比星-Mg2+及表柔比星对DNA-EB体系荧光偏振度的影响
偏振荧光强度与分子转动的速度成反比,复合物分子量大,旋转慢,偏振荧光强;游离标记抗原的分子量小,偏振荧光弱。在粘度小的溶剂(如水)中,由于小分子旋转扩散很快,其荧光偏振一般很小。而当小分子荧光体嵌入到DNA的碱基对中时,其转动受阻,导致小分子转动速度变慢,因而荧光偏振会随之变大[15]。由图5可以看出,表柔比星-Mg2+体系加入到DNA-EB体系中时,P值上升,这是由于表柔比星-Mg2+体系和EB竞争,使得少量EB从DNA分子中游离出来,从而使P值上升。
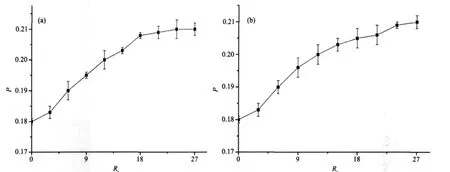
图5 表柔比星及表柔比星-Mg2+体系对DNA-EB体系荧光偏振度的影响Fig.5 Fluorescence polarization of DNA-EB system increased with addition of the Epirubicin and Epirubicin-Mg2+system
2.3 CT-DNA的热变性实验
通过测定DNA的热变性温度(Tm),可以发现表柔比星-Mg2+体系与DNA的作用模式 (嵌插或外部键合)。若它们与DNA发生插入反应,将稳定DNA的双链结构,并使Tm急剧上升;若它们仅与DNA发生外部键合时,则Tm上升幅度较小或不上升[16]。在本实验条件下,DNA的Tm为84℃。当DNA与表柔比星作用后,其Tm为86℃;当DNA与表柔比星-Mg2+体系作用后,其Tm为88.5℃。这表明表柔比星-Mg2+系的加入,增加了双螺旋构象的稳定性。
2.4 黏度研究
具有光学活性的光物理探针对于探讨键合模式一般可以提供必要的但不是充分的证据[17]。在缺乏晶体数据的情况下,黏度测定一般被认为是确定键合模式最有力的证据之一[18]。从图6可以看出,DNA与表柔比星及表柔比星-Mg2+体系相互作用后,黏度值均升高。黏度对分子长度变化非常敏感。当表柔比星-Mg2+体系以经典插入方式与DNA相互作用时,DNA相邻碱基对的距离会增大以容纳插入的表柔比星-Mg2+体系分子,导致DNA螺旋伸长,相应DNA黏度增加。DNA本身是一多聚阴离子,在溶液中,由于负电荷之间的相互静电排斥,使DNA大分子较为伸展,而当表柔比星-Mg2+体系阳离子与DNA带负电荷的磷酸氧基团以静电作用结合时,使得DNA的负电荷被部分中和,导致DNA螺旋收缩,分子长度变小,相应DNA黏度降低。因此,图6表明表柔比星及表柔比星-Mg2+体系均以插入方式与DNA相互作用。
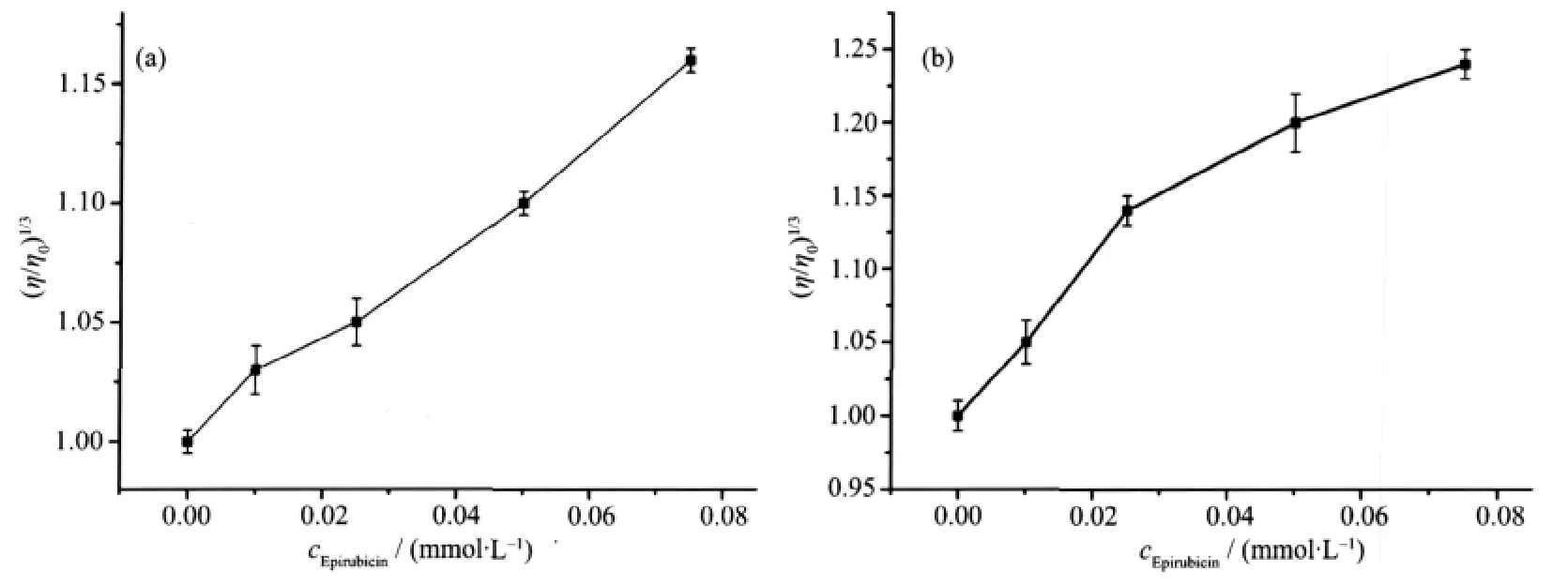
图6 表柔比星及表柔比星-Mg2+体系在不同的浓度下对DNA黏度的影响Fig.6 Effect of the increasing concentration of complex on the relative viscosity DNA
2.5 凝胶电泳分析
为了比较表柔比星及表柔比星-Mg2+体系与DNA的相互作用,设计了3个凝胶电泳实验。在20 μL 5 mmol·L-1Tris-HCl(pH 7.40,5 mmol·L-1NaCl)缓冲液中,加入一定体积的表柔比星或表柔比星-Mg2+和pBR322溶液,混匀,然后在37℃恒温水浴中恒温4 h,通过加入EDTA和溴酚蓝终止反应,然后应用琼脂糖凝胶电泳分析结果,得图7。图7a为表柔比星切割pBR322DNA的凝胶电泳图;图7b为表柔比星-Mg2+体系切割pBR322DNA的凝胶电泳图;图7c为羟基自由基清除剂存在下表柔比星-Mg2+体系切割pBR322DNA的凝胶电泳图;由图7a可看出,当表柔比星浓度达到5 μmol·L-1时有线性出现,但不明显,而当浓度达到20μmol·L-1时线性逐渐减弱,超螺旋DNA(formⅠ,CCC带)又在逐渐增加;由图7b可看出,当表柔比星-Mg2+体系达到5 μmol·L-1时有线性(form Ⅲ,linear带)出现,当表柔比星-Mg2+体系达到 10 μmol·L-1时线性很明显,并且随着表柔比星-Mg2+体系浓度增大,线性逐渐增加,说明表柔比星-Mg2+体系具有较高的切割质粒DNA的活性。由图7c可看出,当0.4 mol· L-1的DMSO,甘油或2.5 mol·L-1的甲醇加入到表柔比星-Mg2+与DNA的反应体系并温育4 h,DNA的切割几乎没受影响(在切割误差范围内)。由此可见,反应没有产生羟基自由基,推测表柔比星-Mg2+对质粒DNA的作用可能是水解切割。

图7 表柔比星及表柔比星-Mg2+体系在不同的浓度下与pBR322DNA作用的电泳图Fig.7 Results of electrophoresis of pBR322 DNA in the presence of varying concentrations of epirubicin and epirubicin-Mg2+system
2.6 CD谱分析
DNA的CD谱主要来自最邻近的碱基间的相互作用,碱基间作用能的减小,意味着“碱基堆积力”变小了,碱基堆积变得疏松了[20-21],因而可以用CD谱来观察。表柔比星-Mg2+体系与DNA中相邻的2个碱基结合后,有可能使原先平行的2个碱基平面相互倾斜,也可能改变碱基相互旋转的角度,这样,就破坏了原先碱基间极其规律的堆积方式,导致碱基堆积无规化,必然减少其相互作用能,使CD峰值改变,峰位移动。与此同时,表柔比星-Mg2+体系的作用也会使碱基间的距离,相对位置稍有改变,这种构型的变化也必然影响碱基的相互作用,使CD谱发生变化。
图8a是CT-DNA溶液的CD光谱,位于277 nm的正峰是由碱基的堆积产生的,而245 nm的负峰则对应于DNA双螺旋结构的B型构象。当向CTDNA溶液中加入表柔比星后(见图8b),DNA CD图谱中的正负峰均发生了一定的变化,其中负峰的变化大于正峰;当向CT-DNA溶液中加入表柔比星-Mg2体系后(见图8c),正负峰也都发生了很大的变化,可以看出,图8c的变化幅度要大于图8b,碱基间作用能递减,特别是245 nm处的负峰向正峰方向的移动的趋势非常明显,因而可以认为此DNA的构象有从B型DNA转向A型DNA的趋势[22],即表柔比星-Mg2+体系的加入使得CT-DNA的二级结构发生了很大的变化。
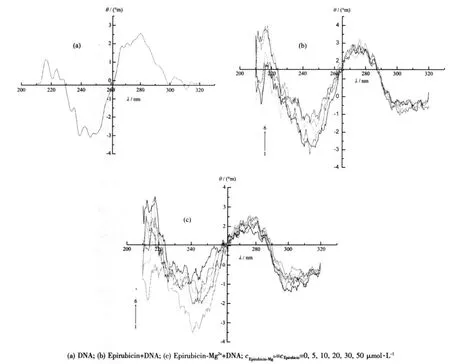
图8 表柔比星及表柔比星-Mg2+体系在不同的浓度下与CT-DNA作用的CD谱Fig.8 Effect of the increasing concentration of Epirubicin and Epirubicin-Mg2+on the CD
3 结 论
本文应用光谱法、粘度法、圆二色谱等方法研究了表柔比星-Mg2+体系与DNA的相互作用。结果表明:在pH=7.4时,表柔比星可与Mg2+形成稳定体系。加入DNA后,表柔比星-Mg2+体系的紫外吸收明显降低;Scatchard图表明表柔比星-Mg2+体系对溴化乙锭(EB)与DNA的结合为竞争性抑制;同时此体系可使DNA-EB体系荧光偏振度增大;使DNA的热变性温度(Tm)上升;黏度增大;圆二色谱法表明随着表柔比星-Mg2+体系的加入,DNA碱基间作用能迅速递减。电泳结果表明:表柔比星-Mg2+体系能在10 μmol·L-1浓度下将pBR322DNA切割出明显的线性。并且通过自由基捕捉剂4 h的温育,未观察到自由基产生。从而表明,表柔比星-Mg2+体系比单纯的表柔比星具有良好的切割活性。综合以上实验现象得出:表柔比星-Mg2+体系与DNA之间为嵌插作用;同时此体系对pBR322DNA有非常好的切割活性;另外它还能使DNA碱基间作用能迅速递减,使DNA的二级结构发生变化,即有可能使DNA的构象由B型转向A型。这些结果,可为合理改善药效和设计新药提供依据,为从分子水平上探讨药物及表柔比星-Mg2+体系抗肿瘤活性不同的成因及其与DNA作用方式之间的联系提供了有价值的信息。
[1]Mokhir A A,Kraemer R.Bioconjugate Chem.,2003,14(5):877-883
[2]Liu F,Wang K,Bai G,et al.Inorg.Chem.,2004,43(5):1799-1806
[3]Okamoto A,Tanabe K,Saito I.J.Am.Chem.Soc.,2002,124(35):10262-10263
[4]Wu J Z,Yuan L.J.Inorg.Biochem.,2004,98(1):41-45
[5]SONG Yu-Min(宋玉民),YANG Pei-Ju(杨培菊),WANG Liu-Fang(王流芳),et al.Acta Chim.Sin.(Huaxue Xuebao),2003,61(8):1266-1270
[6]YANG Pin(杨频),GAO Fei(高飞).The Principle of Bioinorganic Chemistry(生物无机化学原理).Beijing:Science Press,2002:47-53
[7]ZHAO Lin(赵琳),WU Bao-Yan(吴宝燕),GAO Li-Hua(高丽华),et al.Acta Chim.Sin.(Huaxue Xuebao),2006,64(13):1402-1406
[8]XI Xiao-Li(席小莉),YANG Man-Man(杨曼曼),YANG Pin(杨频),et al.Acta Chim.Sin.(Huaxue Xuebao),2008,66(10):1181-1186
[9]YANG Pin(杨频),GAO Fei(高飞).The Principle of Bioinorganic Chemistry(生物无机化学原理).Beijing:Science Press,2002:356
[10]Yang P,Guo M L.Met.-Based Drugs,1998,5(1):41-58
[11]CHEN Guo-Zhen(陈国珍),HUANG Xian-Zhi(黄贤智),XU Jin-Gou(徐金钩).Fluoresomm Spectrometry(荧光光谱).Beijing,Science Press,1990:24
[12]Tu C Y,Luo Z D,Chen G,et al.Crystal.Growth,1995,152(3):235-237
[13]LI Wen-You(李文友),ZHU Shou-Tian(朱守田),HE Xi-Wen(何锡文),et al.Acta Chim.Sin.(Huaxue Xuebao),2002,60(1):105-108
[14]WANG Xing-Ming(王兴明),LI Hong-Bo(黎泓波),HU Ya-Min(胡亚敏),et al.Acta Chim.Sin.(Huaxue Xuebao),2007,65(2):140-146
[15]Mulqueen P T,Horrocks W D.Biochemistry,1985,24(23):6639-6645
[16]JIN Lan(靳兰),YANG Pin(杨频),LI Qing-Shan(李青山).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1996,17(9):1345-1348
[17]Sigma D S,Mazuder A,Perrin D M.Chem.Rev.,1993,93(6):2295-2316
[18]Satyanarayana S,Dabrowiak J C,Chaires J B.Biochemistry,1992,31(39):9319-9324
[19]Pang D W,Abruna H D.Anal.Chem.,1998,70(15):3162-3169
[20]XIAO Mei-Ying(肖枚英).J.Capital Normal Univ.:Nat.Sci.Ed.(Shoudu Shifan Daxue Xuebao:Ziran Kexueban),1996,17(4):43-46
[21]TU Zeng-Hong(屠曾宏),WANG Mei-Ying(王美瑛),SHEN Chun-Yi(沈春镒),et al.Carcinogenesis,Teratogenesis and Mutagenesis(Aibian Jibian Tubian),1993,5(2):15-19
[22]YANG Pin(杨频),GAO Fei(高飞).The Principle of Bioinorganic Chemistry(生物无机化学原理).Beijing:Science Press,2002:343-354
Preliminary Research on the Interaction between Epirubicin-Mg2+System and DNA
ZHANG Gai-Qing2YANG Man-Man3XI Xiao-Li*,1YANG Pin1
(1Key Laboratory of Chemical Biology and Molecular Engineering(MOE),Institute of Molecular Science,Shanxi University,Taiyuan 030006,China)
(2Department of Chemistry,Lüliang High Technological Academy,Lüliang,Shanxi 033000,China)
(3College of Chemistry and Chemical Engineering,Shanxi University;Taiyuan 030006,China)
Epirubicin is used to treat the fast multiplication cancer.The interaction of Epirubicin-Mg2+system with calf thymus DNA has been investigated using UV spectra,fluorescent spectra,CD,viscosity and gel electrophoresis etc.The results show that,Epirubicin can form constant system with Mg2+in pH=7.4 solution.Hypochromism was observed in the UV spectra of the system in the presence of the DNA.The Scatchard plots showed competitive inhibition aganist EB binding to DNA.The relative viscosity and thermal deformation temperature of DNA increased with addition of the Epirubicin-Mg2+system.The fluorescence polarization of the DNA-EB system increased with addition of the Epirubicin-Mg2+system.Then the interaction of the Epirubicin-Mg2+system with pBR322 was studied by the method of gel electrophoresis.The result showed that the Epirubicin-Mg2+system could cleave pBR322 DNA very effectively.The energy of base pair has been weakened with addition of the Epirubicin-Mg2+system.So it can be concluded that the binding mode of the Epirubicin-Mg2+system with CT DNA belongs to intercalation action.This work may be usefully applied to elucidating the mechanisms of natural nucleases and drug design.
epirubicin-Mg2+system;calf thymus DNA;Scatchard plot
O614.22
A
1001-4861(2011)01-0079-08
2010-06-21。收修改稿日期:2010-09-28。
国家自然科学基金资助项目(No.20971081)。
*通讯联系人。E-mail:wanghaiyan@sxu.edu.cn,Tel:13700501823

