水貂α-干扰素基因的克隆、测序与遗传进化分析
张译元 常维山 (山东农业大学动物科技学院 泰安 271000)
水貂α-干扰素基因的克隆、测序与遗传进化分析
张译元 常维山*(山东农业大学动物科技学院 泰安 271000)
根据GenBank发表的序列,应用DNAstart分析软件设计并合成一对引物用于扩增水貂α干扰素(IFN-α)基因,从病死水貂的脾脏中提取总RNA,RT-PCR扩增水貂α干扰素基因,获得了约564bp片段,将其克隆到pEasy-T1载体中,进行序列分析,证实该基因是水貂α干扰素基因。将测序结果与GenBank发表的水貂的IFN-α基因序列进行比较,核苷酸序列同源性为94.3%~95.5%,氨基酸序列同源性为89.3%~91.4%。同时将核苷酸序列、氨基酸序列与其他几种犬科动物进行遗传进化分析,其同源性分别在78.1%~99.3%之间和69.4%~100.0%之间。
水貂 IFN-α基因 克隆测序 遗传进化
干扰素(Interferon, IFN)是一类能诱导动物细胞产生多种广谱抗病毒蛋白的细胞因子,具有阻止病毒繁殖、调节机体免疫反应的生物学功能,是应用前景广阔的重要生物制剂之一[1,2]。干扰素分为I型和II型两类。I型干扰素包括IFN-α和IFN-β等,II型干扰素又称免疫干扰素即IFN-γ。80年代中期,人的干扰素基因克隆成功,抗病毒与抑制肿瘤的效果十分显著[3]。随后,犬、猪、猫和鸡的干扰素基因相继克隆成功[4],并正在向临床应用过渡[5~8]。我国于90年代初开始了人干扰素的研究,接着畜、禽干扰素的研究相继展开,而犬科动物干扰素的分子生物学研究报道还很少。
近年来,貂、狐狸、貉等犬科动物作为特种经济动物饲养正在兴起。而犬科动物各种病毒性疾病是造成死亡的最重要原因。干扰素对病毒具有广谱、特效的抗病毒感染作用[9]。所以,为进行犬科动物干扰素制剂的研究,本实验对水貂IFN-α进行克隆、序列分析及遗传进化分析。该实验不仅为重组水貂干扰素的开发奠定了基础,而且分析了针对一种犬科动物的干扰素是否适用于所有犬科动物,为临床治疗及饲养管理提供指导。
1 材料与方法
1.1 主要材料与试剂 水貂脾脏采自诸城某水貂养殖场。质粒和细菌:pEasy-T1载体构于北京全式金生物技术有限公司,大肠杆菌DH5α为本实验室保存。酶及试剂:RT-PCR试剂盒、TaqHiFi DNA聚合酶购于北京全式金生物技术有限公司,TRIzol细胞裂解液购自Invitrogen公司,质粒小提试剂盒、DNA纯化胶回收试剂盒购自康为世纪生物科技有限公司。
1.2 引物设计与合成 根据GenBank上发表的雪貂IFN-α基因的核苷酸序列,设计一对引物:F:5¢-TAGAATTCAT GGCCCTGCCCTGCTC-3¢,R:5¢-GCTCTAGACTTCCTGC TCCGCAATCT-3¢,分别添加ECOR1、Xba1酶切位点,下游引物去掉终止密码子后由生工生物工程(上海)有限公司合成。
1.3 水貂脾脏总RNA的提取 称取0.1g水貂脾脏,碾磨器中按每0.1g组织加入1mlTRIzol细胞裂解液,充分碾磨达匀浆状态,室温静置5min,加入200ml氯仿,剧烈震荡30s,室温孵育3min,12000g/min,4℃离心10min。小心吸取上清,加入500ml异丙醇,室温孵育10min,10000g/mim,4℃离心10min。弃去上清,加入1ml75%乙醇(DRPC处理的水配置),10000g/min,4℃离心5min。弃去上清,室温晾干沉淀(大约5min),沉淀溶于50~100ml RNA溶解液中,55~60℃孵育10min,即获得水貂脾脏总RNA。
1.4 水貂IFN-α基因的扩增与序列分析 采用RT-PCR方法扩增目的基因,操作步骤:AMV Buffer4ml、模板RNA2ml、dNTP8ml、RNase inhibition 0.5ml、3¢-primer 2ml、AMV0.5ml充分混匀后置PCR仪上25℃5min、42℃60min、85℃5min灭活AMV反转录酶,冷却后直接用于PCR反应。PCR反应体系:Buffer2.5ml、dNTP2ml、模板1ml、5¢-primer0.5ml、3¢-primer0.5ml、TaqHiFi0.2ml、无菌水18.3ml,充分混匀后置于PCR仪上,94℃预变性5min,94℃40s,60℃50s,72℃50s,30个循环后72℃延伸7min,扩增完毕后,取5ml于0.8%琼脂糖凝胶电泳中观察结果。用胶回收试剂盒回收与理论值大小相同的基因片段,构建PEasy-T1-IFNα克隆。经PCR及酶切初步鉴定后,送金斯瑞生物科技有限公司测序。测序成功后用DNAstart软件对测序结果进行分析。
2 结果
2.1 水貂IFN-α基因的扩增结果 从水貂脾脏中提总RNA,用RT-PCR方法扩增出一条564bp的条带,其大小与预期的结果相一致(见图1)。

图1 水貂α干扰素RT-PCR产物电泳分析
1:RT-PCR产物 2:PCR Marker
2.2 水貂干扰素基因的克隆与鉴定 将目的基因克隆于PEasy-T1载体,对重组质粒进行PCR、酶切鉴定,得到的结果与预期的结果相一致(见图2、图3)。

图2 PCR鉴定结果
1:PCR Marker 2:PCR产物

图3 酶切鉴定结果
1:PEasy-T1-IFNα酶切鉴定 2:PCR Marker
2.3 序列分析与比较 测序结果显示的目的片段大小为561bp,编码186个氨基酸。将水貂IFN-α基因序列与GenBank上收录的雪貂(EU863613.1)核苷酸同源性为94.3%,氨基酸同源性为89.3%;与雪貂(EU863614.1)核苷酸同源性为95.0%,氨基酸同源性为90.9%;与雪貂(EU863615.1)核苷酸同源性为95.5%,氨基酸同源性为91.4%(见表1)。该质粒被命名为pEasy-T1-MIFNα。

表1 IFN-α基因序列及氨基酸序列的同源性比较
2.4 IFN-α基因的遗传进化分析

表2 IFN-α基因序列同源性比较
注:1~10分别代表雪貂(序列号:EU863613.1、EU863614.1、EU863615.1)、大熊猫(序列号:DQ392973.1)、犬(序列号:M28624.1、HQ680864.1)、貉(EF543192.1)、赤狐(序列号:EF990625.1、EF543191.1)、本实验扩增的基因序列。
由表2可以看出雪貂、大熊猫、犬、、貉、赤狐的IFN-α核苷酸序列同源性在78.1%~99.3%之间。氨基酸同源性在66.3%~98.4%之间。犬和赤狐的IFN-α亲缘关系最近(同源性接近98.0%),犬和貉的IFN-α亲缘关系也比较最近(同源性达98.0%),而水貂和赤狐、貉、犬的亲缘关系相对较远(基因同源性79.1%左右,氨基酸同源性66.3%~67.9%)。
2.5 IFN-α基因的进化树
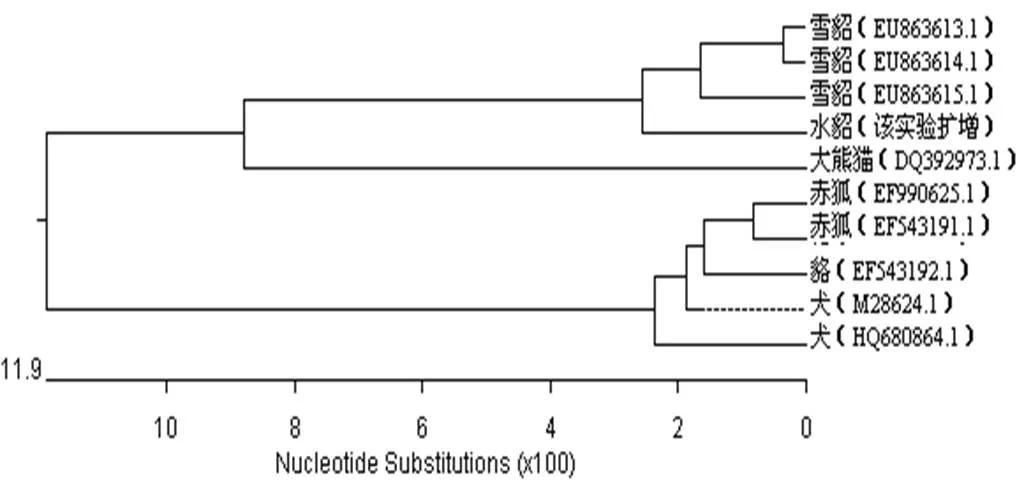
图4 IFN-α基因序列的系统进化树
3 讨论
近年来,犬科动物的饲养已越来越多,而犬细小病毒病、犬瘟热和犬腺病毒等病毒病却严重危害着犬的健康和生存[10],病毒病的预防和治疗显得尤为重要。目前国内主要采用犬五联弱毒疫苗进行免疫预防,由于母源抗体的干扰及毒株的抗原漂移,常导致免疫失败,因此研制安全高效的干扰素抗病毒制剂具有重大意义[11]。为了研究犬科动物α干扰素的生物学活性,对其全基因序列与遗传进化进行分析具有重要意义。
本实验采用RT-PCR方法扩增得到了约564bp目的片段,经T载体克隆和测序分析表明,证实为水貂I型INF-α,生物学信息分析表明水貂IFN-α基因序列与GenBank上收录的雪貂(EU863613.1)核苷酸同源性为94.3%,氨基酸同源性为89.3%;与雪貂(EU863614.1)核苷酸同源性为95.0%,氨基酸同源性为90.9%;与雪貂(EU863615.1)核苷酸同源性为95.5%,氨基酸同源性为91.4%。
通过几种犬科动物的IFN-α基因的核苷酸序列和推导氨基酸序列比对发现,IFN-α的同源性分别为78.1%~ 99.3%之间和66.3%~98.4%之间。从构建进化树的结果来看,狐、貉、犬的遗传距离较近,在进化关系上可能具有密切的亲缘关系。水貂INF-α基因和赤狐、貉、犬的亲缘关系相对较远(基因同源性79.1%左右,氨基酸同源性66.3%~67.9%),与大熊猫的亲缘关系却比较近,因此犬的干扰素可能对水貂不适用。
虽然各犬科动物虽然在生理外形上有很多相近和相似的地方,但从该实验统计的有限数据中,干扰素基因不能体现它们在遗传进化过程中的亲源关系。
有关研究表明,将细胞因子基因与保护性抗原基因共同构建或共表达而研制成的基因工程制剂,是提高机体免疫效力和降低部分病原体毒性的有效手段之一[12]。本研究对几种犬科动物的干扰素基因进行了序列比较、同源性分析和遗传进化分析,下一步将研究用一种犬科动物来源的IFN-α能否防治多种犬科动物的病毒性疾病。
[1] 陆承平. 兽医微生物学[M]. 北京: 中国农业出版社, 2001: 452.
[2] Sun K, MetzgerDW. Inhibition of pulmonary antibacterialdefense by interferon-gamma during recovery from influenza infection[J].NatMed, 2008, 14(5): 558-564.
[3] HolkoM, W illiams B R.Functional annotation of IFN-alpha-stimulated gene expression profiles from sensitive and resistant renal cell carcinoma cell lines[J]. Interferon Cytokine Res, 2006, 26(8): 534-547.
[4] KurataK, IwataA,MasudaK, eta.l Identification ofCpG oligodeoxy-nucleotide sequences that induce IFN-gamma production in canine peripheral bloodmononuclear cells[J].Vet Immunol Immunopatho,l 2004, 102(4): 441-450.
[5] SchijnsV E, WeiningK C,Nuijten P, eta.l Immunoadjuvantactivities ofE. coliand plasmid-expressed recombinantchicken IFN-alpha/beta, IFN-gamma and IL-1beta in 1-day- and 3-week-old chickens[J].Vaccine, 2000, 18(20): 2147-2 154.
[6] NishikawaY, IwataA, NagasawaH, eta.l Comparison of the growth inhibitory effects of canine IFN-alpha, -beta and -gamma on canine cells infected withNeospora caninum tachyzoites[J].VetMed Sc,i 2001, 63(4): 445-448.
[7] NishikawaY, IwataA, KatsumataA, et a.l Expression of canine interferon-gamma by a recombinantvaccinia virus and its antiviral effect[J].VirusRes, 2001, 75(2): 113-121.
[8] Horikawa T, Hikita I, Gray PW, et a.l IFN-gamma-inducible expression of thymus and activation-regulated chemokine[J]. Int Immuno,l 2002, 14(7): 767-773.
[9] 夏春, 汪明, 夏兆飞. 拉布拉多犬和德国牧羊犬干扰alpha基因克隆及测序[J]. 农业生物技术学报, 1999, 7(3): 245-247.
[10] 王艳, 王海震, 曹瑞兵等. 犬α干扰素基因的高效表达及其活性测定[J]. 中国病毒学, 2005, 20(2): 189-192.
[11] 陈红英, 李新生,等. 京巴犬α-干扰素全基因的克隆与分子进化分析[J]. 江西农业大学学报,2009,6(3): 512-516.
[12] 李岩, 邵念鹏, 彭玉麟. IFN-γ的研究与临床应用[J]. 河北科学院, 2001, 18(3): 174-177.
[13] 黄道超, 张志和等. 大熊猫γ-干扰素基因的克隆与序列分析[J]. 中国预防兽医学报, 2008,30(1): 35-38.
(2011–09–15)
S813.3
A
1007-1733(2011)10-0003-03

