一锅法制备聚邻氨基酚-纳米金-酶膜用于葡萄糖安培传感
李鹏昊,傅迎春,王 婷,部丽娟,谢青季,姚守拙
(湖南师范大学化学生物学及中药分析教育部重点实验室,化学化工学院,中国 长沙 410081)
高效固定酶分子是研制安培型酶电极的关键步骤,而采用导电或绝缘聚合膜基质是有效固定酶分子的常用方法[1-6],其中绝缘聚合膜常能更好地抑制抗坏血酸、尿酸等共存电活性物质的干扰[2, 5, 6].化学聚合和电化学聚合法是两种常用的原位固定酶的方法,前者更易实现更高的酶负载量和固定酶活性[5, 6],而后者更易于精确控制膜厚.我们将化学聚合和电化学聚合法相结合,提出了一种原位化学预氧化并电聚合单体的方法,所制酶电极性能优异[7].纳米材料及其在分析化学中的应用近年来备受重视,包括纳米复合材料在研制生物传感器的应用[8, 9].然而,采用简便的一锅法制备生物纳米复合物的工作目前并不多见.
本文中,我们基于HAuCl4和邻氨基酚(oAP)的化学反应及oAP的电聚合反应,在葡萄糖氧化酶(GOx)共存条件下,研制了电合成的聚邻氨基酚(PoAP)-邻氨基酚寡聚物(oAPO)-金纳米颗粒(AuNPs)-GOx复合物酶膜,用于安培传感分析葡萄糖,性能优异.采用电化学石英晶体微天平(EQCM)实时监测了酶电极制备过程.
1 实验部分
1.1 仪器和试剂
所有电化学实验均在CHI660电化学工作站(CH Instrument Co., USA)上进行.EQCM实验采用HP4395A网络/频谱/阻抗分析仪(Agilent, USA).采用直径12.5 mm的AT切9 MHz压电石英晶体(北京晨晶电子有限公司),双面镀金,实验中单面触液.直径6 mm的金电极为工作电极,参比电极为饱和KCl甘汞电极(SCE),对电极为碳棒.采用Pico Scan 5型(Agilent,USA)原子力显微镜.
GOx(EC 1.1.3.4; Ⅱ型,源自黑曲霉菌,活性均为150 kU·g-1)购自Roche公司 (Japan),葡萄糖购自上海化学试剂公司.oAP购自广东台山化工厂.磷酸缓冲溶液 (PBS,pH 7.0) 配比为0.1 mol·L-1K2HPO4/KH2PO4+ 0.1 mol·L-1K2SO4.实验中使用的所有化学试剂均为分析纯或更高纯度.使用的水为Milli-Q超纯水(电阻率≥18 MΩ·cm).
1.2 实验步骤
金工作电极经化学和电化学处理.电极表面先滴加浓硫酸和双氧水的混合液(vH2SO4∶vH2O2=3∶1)清洗,再在0.2 mol·L-1HC1O4水溶液中进行电位环扫(电位区间0 ~ 1.5 V vs.SCE,扫速30 mV·s-1),直至循环伏安曲线重现.
在1 mL含15 mmol·L-1oAP的除氧PBS溶液中,加入1 mg GOx,搅拌溶液,缓慢加入40 μL 10 mmol·L-1HAuCl4(或12 μL 0.1 mmol·L-1K3Fe(CN)6)化学氧化剂,单体氧化后可得到短链寡聚物和少量长链聚合物(以下统称为寡聚物)[7, 10]并包埋AuNPs和GOx,得到oAPO-AuNPs-GOx纳米复合物悬浊液.将处理后的金电极浸入上述悬浊液中,电位环扫(0 ~ 1.2 V,扫速30 mV·s-1),得PoAP-oAPO-AuNPs-GOx(或PoAP-oAPO-GOx-K3Fe(CN)6)酶膜.采用EQCM监测过程.电极水洗后,存于PBS缓冲液中备用.基于常规电聚合方法的酶膜(PoAP-GOx)制备类似,但无HAuCl4或K3Fe(CN)6.所制酶电极储存于PBS中备用(4 ℃冰箱).
酶电极检测采用三电极系统,将酶电极置于10 mL pH 7.0的PBS缓冲液中,在0.7 VvsSCE恒电位下,检测葡萄糖溶液加入前后的稳态阳极电流变化(对应于酶生H2O2的电氧化).所有实验均在室温下进行.
2 结果与讨论
2.1 酶电极的制备及表征
图1为oAPO-AuNPs-GOx悬浊液的电聚合响应图.可见,过量的oAP单体在0.04 V开始氧化,而在0.2 V出现了频率的下降,表明oAPO-AuNPs-GOx和PoAP在电极表面开始共沉积.因为PoAP膜的绝缘性,电流和频率响应逐圈显著下降.三圈后,总频率下降约3800 Hz,而动态电阻上升了约25 Ω,-Δf0/ΔR1=152 Hz·Ω-1,明显大于粘密度效应特征值10 Hz·Ω-1[2, 11-13],表明该聚合膜高度刚性.图2为酶膜的原子力显微镜(AFM)图,可见膜粗糙多孔,颗粒直径约90 nm.
我们对酶电极制备及检测条件进行了优化(图略).当膜厚为3 800 Hz时,酶电极的电流响应最大.因实验条件下oAP的最大可溶解浓度约15 mmol·L-1,故采用此浓度实验.实验中采用0.4 mmol·L-1的HAuCl4浓度,因为HAuCl4浓度过低,不利于化学聚合反应的发生和酶的包埋,过高则易产生纳米金和聚合物沉淀.此时HAuCl4的质量分数为0.016%,而Frens法所用HAuCl4质量分数0.01%基本一致[14].实验中选择GOx浓度为1 g·L-1,过低会影响酶的固定效率,过高则抑制聚合反应.选择酶电极的工作电位为0.7 V和检测溶液pH值为7.0,与文献报道结果[2, 3, 7]一致.
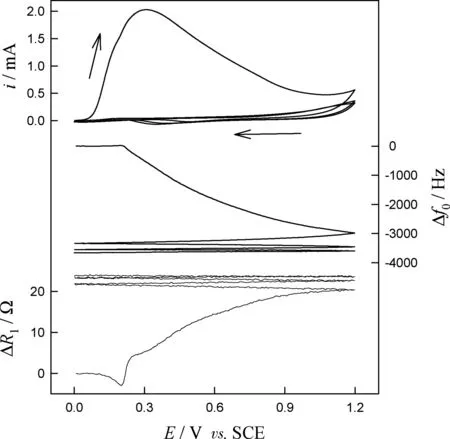
图1 在含15 mmol·L-1 oAP, 1 g·L-1 GOx和0.4 mmol·L-1 HAuCl4的PBS溶液中电流、频率和阻抗随电位环扫的响应曲线,扫速:10 mV·s-1

图2 PoAP-oAPO-AuNPs-GOx修饰电极的AFM图
2.2 酶电极性能
在最优条件下,分别制备了PoAP-GOx、PoAP-oAPO-GOx-K3Fe(CN)6以及PoAP-oAPO-AuNPs-GOx修饰电极并考察了酶电极对葡萄糖的响应性能(图3及表1).可见,PoAP-oAPO-AuNPs-GOx电极的灵敏度最高,分别是PoAP-oAPO-GOx-K3Fe(CN)6和PoAP-GOx电极的1.7倍和4.5倍,优于很多文献报道的第一代GOx生物传感器[1-3, 11, 13].PoAP-oAPO-AuNPs-GOx酶电极的检测下限比其余两酶电极降低了一个数量级.PoAP-oAPO-AuNPs-GOx酶电极的优异性能可归因于:(1)固定酶的高负载量和高活性;(2)纳米金的导电能力和催化特性.
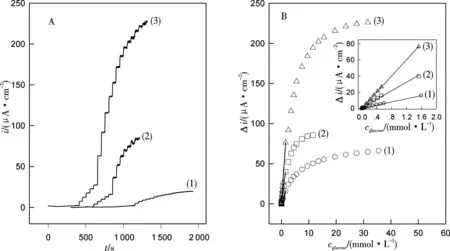
图3 PoAP-GOx (1), PoAP-oAPO-GOx-K3Fe(CN)6 (2)和PoAP-oAPO-AuNPs-GOx (3)修饰电极对浓度递增葡萄糖的电流响应(A)及工作曲线(B).插图为线性响应区间的工作曲线

电 极灵敏度/(μA mmol·L-1·cm-2)线性范围/(mmol·L-1)检测限/(μmol·L-1)PoAP-GOx9.80.002~1.609.4PoAP-oAPO-GOx-K3Fe(CN)626.40.005~1.531.5PoAP-oAPO-AuNPs-GOx44.00.005~1.530.3
考察了上述三种酶电极的抗干扰性能.0.1 mmol·L-1抗坏血酸和尿酸的加入对2 mmol·L-1葡萄糖的电流响应基本上无干扰(低于5%).也考察了所制PoAP-oAPO-AuNPs-GOx酶电极的操作稳定性及储存稳定性.连续10次测试2 mmol·L-1葡萄糖,电流响应的相对标准偏差在5%以内;连续50 d对酶电极进行了检测,2 mmol·L-1葡萄糖的电流响应值保持在其最初响应的80%以上,表明该电极操作和储存稳定性俱佳.
3 结论
本文所提出的纳米复合物制备方法可高负载量和高活性地包埋酶,酶电极制备方法简便、高效,酶电极性能优异,可望在生物传感、生物材料和生物催化等领域进一步应用.
参考文献:
[1] MCMAHON C P, ROCCHITTA G, SERRA P A,etal. Control of the oxygen dependence of an implantable polymer/enzyme composite biosensor for glutamate[J].Anal Chem, 2006, 78(7): 2352-2359.
[2] DENG C Y, LI M R, XIE Q J,etal. New glucose biosensor based on a poly(o-phenylendiamine)/glucose oxidase-glutaraldehyde/prussian blue/Au electrode with QCM monitoring of various electrode-surface modifications[J].Anal Chim Acta, 2006, 557(1-2): 85-94.
[3] PAN D W, CHEN J H, YAO S Z,etal. Amperometric glucose biosensor based on immobilization of glucose oxidase in electropolymerizedo-aminophenol film at copper-modified gold electrode[J].Sens Actuators B, 2005, 104(1): 68-74.
[4] ZHANG Z N, LIU H Y, DENG J Q,etal. A glucose biosensor based on immobilization of glucose oxidase in electropolymerizedo-aminophenol film on platinized glassy carbon electrode[J].Anal Chem, 1996, 68(9): 1632-1638.
[5] NJAGI J, ANDREESCU S. Stable enzyme biosensors based on chemically synthesized Au-polypyrrole nanocomposites[J].Biosens Bioelectron, 2007, 23(2): 168-175.
[6] COSNIER S, GONDRAN C, SENILLOU A,etal. Mesoporous TiO2films: new catalytic electrode materials for fabricating amperometric biosensors based on oxidases[J].Electroanalysis, 1997, 9(18): 1387-1392.
[7] FU Y C, CHEN C, XIE Q J,etal. Immobilization of enzymes through one-pot chemical preoxidation and electropolymerization of dithiols in enzyme-containing aqueous suspensions to develop biosensors with improved performance[J].Anal Chem, 2008, 80(15): 5829-5836.
[8] LIU Y G, FENG X M, SHEN J M,etal. Fabrication of a novel glucose biosensor based on a highly electroactive polystyrene/polyaniline/Au nanocomposite[J].J Phys Chem B, 2008, 112(30): 9237-9242.
[9] LIU Z, WANG J, XIE D,etal. Polyaniline-coated Fe3O4nanoparticle-carbon-nanotube composite and its application in electrochemical biosensing[J].Small, 2008, 4(4): 462-466.
[10] FU Y C, ZOU C, XIE Q J,etal, Highly sensitive glucose biosensor based on one-pot biochemical preoxidation and electropolymerization of 2,5-dimercapto-1,3,4-thiadiazole in glucose oxidase-containing aqueous suspension[J].J Phys Chem B, 2009, 113(5): 1332-1340.
[11] DENG C Y, LI M R, XIE Q J,etal. Construction as well as EQCM and SECM characterizations of a novel Nafion/glucose oxidase glutaraldehyde/poly(thionine)/Au enzyme electrode for glucose sensing[J].Sens Actuators B, 2007, 122(1): 148-157.
[12] FU Y C, XIE Q J, JIA X E,etal. Electrosynthesized poly(1,6-hexanedithiol) as a new immobilization matrix for Au-nanoparticles-enhanced piezoelectric immunosensing[J].J Electroanal Chem, 2007, 603(1): 96-106.
[13] LI M R, DENG C Y, XIE Q J,etal. Electrochemical quartz crystal impedance study on immobilization of glucose oxidase in a polymer grown from dopamine oxidation at an Au electrode for glucose sensing[J].Electrochim Acta, 2006, 51(25): 5478-5486.
[14] PANDEY P, SINGH S P, ARYA S K,etal. Application of thiolated gold nanoparticles for the enhancement of glucose oxidase activity[J].Langmuir, 2007, 23(6): 3333-3337.

