单次或重复曲普瑞林兴奋试验对特发性低促性腺激素性性腺功能减退症和体质性青春发育延迟鉴别诊断的作用
茅江峰,伍学焱,卢双玉,聂 敏
中国医学科学院 北京协和医学院 北京协和医院内分泌科 卫生部内分泌重点实验室,北京 100730
·论著·
单次或重复曲普瑞林兴奋试验对特发性低促性腺激素性性腺功能减退症和体质性青春发育延迟鉴别诊断的作用
茅江峰,伍学焱,卢双玉,聂 敏
中国医学科学院 北京协和医学院 北京协和医院内分泌科 卫生部内分泌重点实验室,北京 100730
目的探讨单次和两次黄体生成素释放激素(LHRH)类似物(曲普瑞林)兴奋试验在鉴别诊断特发性低促性腺激素性性腺功能减退症(IHH)和体质性青春发育延迟(CDP)中的作用。方法对133例(IHH 86例、CDP 47例)14岁后仍无青春发育表现的男性患者,进行曲普瑞林兴奋试验,并随访24~48个月直至确诊。其中,有9例IHH患者和13例CDP患者在初诊1年后再次进行曲普瑞林兴奋试验,以评价下丘脑-垂体-睾丸轴功能的动态变化。通过分析曲普瑞林兴奋试验黄体生成素(LH)峰值和诊断的相关性,以及两次兴奋试验中LH峰值的变化,评价单次和两次曲普瑞林兴奋试验在鉴别诊断IHH和CDP中的作用。结果单次曲普瑞林兴奋试验中,IHH患者LH峰值(1.9±1.2)U/L显著低于CDP患者LH峰值(13.7±8.3)U/L(P<0.01)。有75例(87.2%)IHH患者,LH峰值<4 U/L,而CDP患者只有2例(4.3%)LH峰值<4 U/L。以曲普瑞林兴奋试验LH峰值<4 U/L为IHH的标准,敏感性为87.2%、特异性为95.7%、阳性预测值为97.4%。随诊1年后第2次曲普瑞林兴奋试验中,9例IHH患者的LH峰值从(4.7±2.5)U/L升高到(5.1±3.3)U/L(P=0.78),而13例CDP患者的LH峰值从(10.7±3.3)U/L增加到(24.5±5.7)U/L(P<0.05)。结论单次曲普瑞林兴奋试验可对90.2%的IHH和CDP患者作出有效鉴别诊断。对部分诊断困难的青春发育延迟患者,间隔1年后行第2次曲普瑞林兴奋试验,有助于评价下丘脑-垂体-睾丸轴功能的动态变化,为IHH和CDP的确诊提供更多依据。
曲普瑞林兴奋试验;特发性低促性腺激素性性腺功能减退症;体质性青春发育延迟;下丘脑-垂体-性腺轴功能
多种因素包括基因、营养状态、运动、慢性疾病、类固醇性药物治疗等,都可能导致男性青春发育延迟。其中最常见的两类疾病为特发性低促性腺激素性性腺功能减退症(idiopathic hypogonadotropic hypogonadism, IHH)和体质性青春发育延迟(constitutional delayed puberty, CDP)。对于IHH患者,需终身睾酮替代治疗。当患者有生育需求时,可予促精子生成治疗。对于CDP患者,随诊观察或短时期睾酮补充治疗均为合理的可选方案。两者均可表现为小阴茎、小睾丸以及青春发育延迟,给临床鉴别诊断和治疗方案的选择带来一定困难。曲普瑞林是黄体生成素释放激素(luteinizing hormone releasing hormone, LHRH)类似物,可与垂体LHRH受体结合促进黄体生成素(luteinizing hormone,LH)和卵泡刺激素(follicular stimulating hormone,FSH)的分泌。目前国内难以通过合法途径获得LHRH,因此常选用曲普瑞林100 μg替代传统的LHRH兴奋试验,定量评价下丘脑-垂体-睾丸轴功能,为青春发育异常疾病的诊断提供依据[1]。本研究对133例14岁后仍无青春发育的男性患者行曲普瑞林兴奋试验,结合患者最后的诊断和随诊(24~48个月)资料,评价单次和两次曲普瑞林兴奋试验在鉴别诊断IHH和CDP中的作用。
对象和方法
对象选取2006年1月至2009年1月因青春不发育到北京协和医院内分泌科就诊的男性患者133例,年龄14~28岁,平均(17.9±5.7)岁; 根据病史、体格检查和辅助检查,完成初步诊断,并通过2~4年随访以确诊;CDP的诊断标准:14岁后始出现青春发育,随诊过程中总睾酮水平可逐渐升高到>3.5 nmol/L[1],共47例;IHH的诊断标准:患者在18岁仍无青春发育,且骨龄≥12岁,总睾酮水平<3.5 nmol/L,FSH、LH水平正常或降低[1],共86例。所有患者在接受曲谱瑞林兴奋试验的时候,骨龄均不小于10岁。
曲普瑞林兴奋试验空腹状态8 am进行,肌注曲普瑞林100 μg,在0和60 min静脉取血2 ml,测定血浆FSH和LH水平。所有患者在初诊时完成曲普瑞林兴奋试验。间隔3~6个月随访1次。已确诊为IHH的患者,开始口服睾酮补充治疗。未确诊患者,暂不用药物治疗,仅随诊观察性激素水平和睾丸体积变化。其中有最终已确诊为IHH的9例和CDP的13例患者,在随访1年时重复了曲普瑞林兴奋试验。本研究采用的曲谱瑞林,由辉凌制药公司生产,剂量为每支100 μg。
青春发育的评价方法和激素测定方法用Prader睾丸计测定患者睾丸的体积。选用Gruelich-Pyle法评价患者骨龄。由同一位经过培训的内分泌科医生,以Tanner分期标准对整个研究过程中患者的外生殖器和阴毛发育程度进行半定量分级。采用第3代化学发光法,测定患者的FSH、LH、E2和T水平(均重复测定2次以上,取其均值)。LH和FSH最小测定值为0.01 uIU/ml。测定FSH、LH和T的批内和批间变异系数分别为3.5%和3.6%,3.5%和3.7%以及2.8%和3.2%。
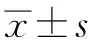
结 果
IHH和CDP患者的临床特点初诊时,CDP组患者的睾丸体积、基线状态LH和T水平,均显著高于IHH组(P均<0.05),但两组数据存在较大范围重叠,多数患者难以据此作出诊断和鉴别诊断(表1)。

表 1 IHH、CDP患者的临床特点及曲普瑞林兴奋试验LH峰值的差异
IHH:特发性低促性腺激素性性腺功能减退症;CDP:体质性青春发育延迟;LH:黄体生成素;FSH:卵泡刺激素;和IHH比较,aP<0.05,bP<0.01
IHH: idiopathic hypogonadotropic hypogonadism; CDP: constitutional delayed puberty;LH: luteinizing hormone; FSH: follicular stimulating hormone;aP<0.05,bP<0.01 compared with IHH group
单次曲普瑞林兴奋试验LH峰值87.2%的IHH患者LH峰值小于4 U/L,而96%的CDP患者LH峰值大于4 U/L(图1)。如以LH峰值<4 U/L作为IHH的诊断标准,敏感性为87.2%、特异性为95.7%、准确性为90.2%、阳性预测值为97.4%、阴性预测值为80.4%。即90.2%的青春发育延迟患者,可通过单次曲普瑞林兴奋试验得到确诊。
重复曲普瑞林兴奋试验LH峰值在初诊1年后,对部分诊断尚不明确患者,重复曲普瑞林兴奋试验(表2)。IHH患者(n=9)的LH峰值较初诊时差异无统计学意义(P=0.78),而CDP患者(n=13)的LH峰值较1年前明显升高(P<0.05)。

LHmax:曲普瑞林兴奋试验中60 min时刻的LH水平LHmax:the level of LH at 60 minutes in triptorelin stimulating test

表 2 部分IHH和CDP患者在1年后复查曲普瑞林兴奋试验LH峰值的变化
和IHH组比较,aP<0.05;和初诊比较,bP<0.05
aP<0.05 compared with IHH group;bP<0.05 compared with first triptorelin stimulating test
讨 论
流行病学调查显示,95%的中国男童在9~12岁出现青春发育[2]。考虑到基因、社会经济、营养、慢性疾病等众多因素对青春发育的影响,目前把14岁后才开始自发出现青春发育者定义为CDP。18岁后仍无青春发育,促性腺激素和睾酮水平明显降低,并且无明确病因者,诊断为IHH。上述两种疾病的治疗方案和预后完全不同,前者可不经治疗就能自发地完成青春发育,且达到正常成年男性的第二性征程度和具有正常的生精能力;后者则需要终生接受性激素替代治疗。尽管理论上来说只要经过足够长时间的随诊,最终就能准确地将二者区分开来;但实际临床工作中,长时间得不到确诊并获得合理有效地治疗,患者及其家属均会经历心理压力和不安。因此,尽早确诊具有重要的临床价值。
经典的LHRH兴奋试验,有助于CDP和IHH的鉴别诊断[3]。在经典LHRH兴奋试验中,如患者同时达到血清LH峰值≥8 IU/L,血清LH增加值(LH峰值-LH基线值)≥5 IU/L两项标准,则灵敏度和特异度分别为93.7%和93.3%[3]。但因国内缺少合法途径获得LHRH,因此常用曲普瑞林替代LHRH兴奋试验[4-5]。和LHRH相比,曲普瑞林和LHRH受体的结合力更强,抗酶分解能力更强,半衰期延长到约12 h[6]。本研究早期的研究结果显示,曲普瑞林兴奋试验可靠性高,肌肉注射后血FSH和LH稳定升高,LH峰值在60 min出现。此兴奋试验可有效量化评价不同疾病患者下丘脑-垂体-性腺轴功能,对鉴别诊断不同原因导致的性早熟和青春发育延迟疾病具有重要意义[7]。
本研究显示,总体上,IHH和CDP人群的基线LH水平、睾酮水平和睾丸体积差异具有统计学意义,但两组数据之间存在较大重叠,不能为两种疾病的鉴别诊断提供充分证据。而在曲普瑞林兴奋试验后,两组患者的LH峰值水平发生明显分离。87.2%的IHH患者,LHmax水平<4 U/L,而95.7%的CDP患者,LHmax水平>4 U/L。以LH<4 U/L为IHH的诊断标准,试验的阳性预测值为97.4%。
一直以来,CDP的诊断依赖于长期的随访观察,其青春发育时间存在很大变异,个别患者在20~24岁才出现青春发育。总体上,他们的下丘脑-垂体-睾丸轴功能,处于一个动态变化并且逐渐成熟的过程中。因此,单次曲普瑞林兴奋试验、LH峰值仅反映了某时刻的性腺轴功能状态,并不能全面反映性腺轴功能的动态变化。另一方面,个别下丘脑-垂体-性腺轴功能尚有残存的IHH患者(又称为部分性IHH),可分泌低于正常成年男性水平的LH和FSH,其睾丸体积也会增大到3~4 ml,但其第二性征发育始终不能达到正常水平。对此类患者,单次曲普瑞林兴奋试验的LH峰值,可能会高于典型的IHH患者。因此,笔者尝试在随访中进行第2次曲普瑞林兴奋试验,以期量化评价下丘脑-垂体-性腺轴功能的动态变化。结果显示,CDP患者,第2次曲普瑞林兴奋试验LH峰值较初诊时明显升高,而绝大多数IHH患者,LH峰值较前无升高。所以能较容易地将此两类患者区分开来。
但有个别IHH患者,在睾酮替代治疗3~20年后,下丘脑-垂体-睾丸轴功能可恢复正常,称之为“IHH逆转(reversal)”[1]。目前对逆转的机制尚不明确,可能和长期睾酮替代治疗对下丘脑促性腺激素释放激素神经元的功能重塑或不同基因病变导致的IHH有关。目前已发现12个基因突变可导致IHH,其中6个基因在最近4年才得到证实,如PROKR2、Kisspeptin/Kiss1R系统和TAC3/TACR3系统的基因[8]。约70%的IHH患者,至今仍未能找到突变基因[8],提示有更多基因参与了IHH发病机制。这也解释了IHH临床表现的多样性及发生逆转的复杂性。鉴于此,也可将体质性青春发育延迟,看成是IHH人群临床表现的一种特例[1,8]。考虑到CDP和IHH在发病机制上可能存在密切联系,笔者认为,无论从理论上还是实践中,曲普瑞林兴奋试验并不能把两者截然分开。但另一方面,通过定量评价下丘脑-垂体-性腺轴功能,曲普瑞林兴奋试验为两者的鉴别诊断和治疗方向选择提供了十分有价值的帮助。例如,LH峰值较高的IHH患者,睾丸体积可增大到3~4 ml,这是将来促精子生成治疗成功的重要预测指标之一[9]。
综上,本研究显示,90.2%的青春发育延迟患者可通过单次曲普瑞林兴奋试验明确诊断。LH峰值<4 U/L对确诊IHH的意义更大。对暂时明确诊断存在困难的患者,需在随访中重复曲普瑞林兴奋试验,动态评价下丘脑-垂体-性腺轴功能的变化。如LH峰值较前有明显升高,则提示体质性青春发育延迟的诊断。
[1] Raivio T, Falardeau J, Dwyer A, et al. Reversal of idiopathic hypogonadotropic hypogonadism[J]. New Engl J Med, 2007, 357(9):863-873.
[2] 伍学焱,史轶蘩, 邓洁,等. 大庆市健康男性青少年正常青春发育时间调查[J]. 中华医学杂志, 2007, 87(16):1117-1119.
[3] 潘慧,史轶蘩,邓洁英,等. LHRH兴奋试验早期鉴别诊断青少年的体质性青春发育延迟和男性低促性腺激素性功能低减的价值[J]. 中华内分泌代谢杂志, 2003, 19(2):110-114.
[4] 马华梅,杜敏联,陈红珊,等. 促性腺激素释放激素类似物简易激发试验对性早熟诊断的评价[J]. 中华内分泌代谢杂志,2002,18(4):300-304.
[5] Kanika G, Cara F, Robert L, et al. Gonadotropin releasing hormone agonist (nafarelin) test to differentiate gonadotropin deficiency from constitutionally delayed puberty in teen-age boys-a clinical research center study[J]. Clin Endocrinol Metab, 1995, 80(10):2980-2986.
[6] 曲普瑞林:药物临床信息参考[M]. 成都:四川科学技术出版社,2004:869-690.
[7] 伍学焱,聂敏,卢双玉,等. 曲普瑞林兴奋试验在评价男性下丘脑-垂体-性腺轴功能中的价值[J]. 中华医学杂志,2011,91(10):679-683.
[8] Semple RK, Topaloglu AK. The recent genetics of hypogonadotrophic hypogonadism-novel insights and new questions[J]. Clin Endocrinol (Oxf), 2010, 72(4):427-435.
[9] David W, Genevieve D, Pharm D, et al. A combined analysis of data to identify predictive factors for spermatogenesis in men with hypogonadotropic hypogonadism treated with recombinant human follicle-stimulating hormone and human chorionic gonadotropin[J]. Fertil Steril, 2009, 92(2):594-604.
ClinicalValuesofSingleorRepeatedTriptorelinStimulatingTestintheDifferentialDiagnosisbetweenIdiopathicHypogonadotropicHypogonadismandConstitutionalDelayedPuberty
MAO Jiang-feng,WU Xue-yan, LU Shuang-yu, NIE Min
Department of Endocrinology,Key Laboratory of Ministry of Health,PUMC Hospital, CAMS and PUMC,Beijing 100730,China
WU Xue-yan Tel:010-65295073,E-mail: wsheyan@vip.sina.com
ObjectiveTo investigate the values of single or repeated luteinizing hormone (LH) releasing hormone analogue (triptorelin) stimulating test in the differential diagnosis between idiopathic hypogonadotropic hypogonadism (IHH) and constitutional delayed puberty(CDP).MethodsMale patients (n=133) without puberty onset after the age of 14 were recruited for triptorelin stimulating test and were followed up for 24 - 48 months until the diagnosis were confirmed: 86 were IHH and the other 47 were CDP. Repeated triptorelin stimulating tests were conducted in 9 IHH patients and 13 CDP patients one year after the first stimulating tests with an attempt to evaluate the dynamic change of hypothalamus-pituitary-testis axis function. The relationship between the final diagnosis and the peak LH value (LHmax), and the changes of repeated LHmax were investigated.ResultsIn the single triptorelin stimulating test, LHmax was (1.9±1.2)U/L in IHH group, which was significantly lower than that in CDP group [(13.7±8.3)U/L] (P<0.01); 75 IHH patients (87.2%) had a LHmax lower than 4 U/L, while only 2 CDP patients (4.3%) had a LHmax lower than 4 U/L. When LHmax<4U/L was used as a criteria for the diagnosis of IHH, the single triptorelin stimulating test had a sensitivity of 87.2%, a specificity of 95.7%, and a positive predictive value of 97.4%. The repeated triptorelin stimulating tests performed one year later showed that the LHmax in the 9 IHH patients increased from (4.7±2.5) U/L to (5.1±3.3)U/L (P=0.78), while that in the 13 CDP patients increased from (10.7±3.3) U/L to (24.5±5.7) U/L (P<0.05).ConclusionsA single triptorelin stimulating test is highly effective in differentiating IHH from CDP. For some patients without definitive diagnosis, a repeated triptorelin stimulating test performed one year later may provide more valuable information on the dynamic change of the hypothalamus-pituitary-testis axis function.
triptorelin stimulating test; idiopathic hypogonadotropic hypogonadism; constitutional delayed puberty; hypothala- mus-pituitary-gonad axis function
ActaAcadMedSin, 2011,33(5):566-570
伍学焱 电话:010-65295073,电子邮件:wsheyan@vip.sina.com
R584.2
A
1000-503X(2011)05-0566-05
10.3881/j.issn.1000-503X.2011.05.017
2011-02-21)

