N-二异丙氧磷酰化壳寡糖的合成与表征
马 力, 李广华, 李克让, 李利民, 刘 蒲
(郑州大学 化学系 河南 郑州 450001)
N-二异丙氧磷酰化壳寡糖的合成与表征
马 力, 李广华, 李克让, 李利民, 刘 蒲
(郑州大学 化学系 河南 郑州 450001)
通过壳寡糖和二异丙基亚磷酸酯在一种温和条件下发生Atherton-Todd反应,成功制备出了一种新型的壳寡糖含磷衍生物N-二异丙氧磷酰化壳寡糖.探讨了水与无水乙醇的体积比、壳寡糖与三乙胺的摩尔比、壳寡糖与二异丙基亚磷酸酯的摩尔比以及反应时间等因素对产品含磷量的影响.最后,对最优条件下合成的产品进行IR、1H-NMR、13C-NMR 以及31P-NMR的表征,证明二异丙氧磷酰基已经成功嫁接到了壳寡糖的氨基上.这种简单而有效的方法为N-磷酰化壳聚糖衍生物的制备提供了一条新的途径.
壳寡糖; N-二异丙氧磷酰化壳寡糖; Atherton-Todd反应; 表征
0 引言
壳聚糖是一种天然的阳离子生物材料,是聚-β-(1-4)-D-氨基葡萄糖衍生物,可以通过甲壳素的全部或部分的脱乙酰作用得到,它是自然界中数量仅次于纤维素的天然产物,也是迄今所发现的自然界中唯一的碱性多糖[1].由于其具有多样的生物活性、良好的生物相容性、可降解性以及无毒性,使壳聚糖逐渐成为一种使用越来越广泛的新型生物功能材料[2].近年来,随着材料与生物医药科学的快速发展,壳聚糖及其衍生物在废水处理、化妆品、药物运输、重金属螯合[2-3]、电化学DNA生物传感器[4]等领域中的应用受到了广泛的重视.
通过对壳聚糖进行化学修饰来得到新的功能材料是壳聚糖研究领域中最为引人瞩目的.因为对壳聚糖进行化学修饰并不会改变其本身的基本结构.因此,在保留原有物理化学和生物化学性质的基础上,根据需要可以在壳聚糖分子链上引入其他基团,从而合成出新的壳聚糖衍生物并产生相应的物理化学及生物化学方面的性质与功能[5].
对壳聚糖进行磷酰化或磷酸化修饰是对壳聚糖修饰改性的途径之一.制备壳聚糖含磷衍生物的方法有许多种,大致可分为两大类,即壳聚糖与无机磷或有机磷试剂进行反应[6].大部分壳聚糖含磷衍生物是通过壳聚糖的羟基和(或)氨基与无机磷试剂反应[7-9],只有少数是通过与有机磷试剂反应得到的[10-11].
作者通过Atherton-Todd反应成功将二异丙氧磷酰基嫁接到了壳寡糖分子链的氨基上,生成了N-二异丙氧磷酰化壳寡糖,并对该产品进行了IR,ICP,NMR和TG等分析,最后对其结果进行了讨论.
1 实验部分
1.1试剂
壳寡糖(CS,5 000 Da)由金壳生物化学公司提供.异丙醇从北京化工厂购置.三氯化磷、三乙胺和四氯化碳从天津化学试剂一厂购置.其他试剂均为分析纯.
1.2二异丙基亚磷酸酯(DIPPH)的制备
将115 mL异丙醇加入到250 mL三口烧瓶中,当异丙醇的温度降低并维持在-5 ℃时,通过恒压滴液漏斗将44 mL的三氯化磷慢慢地逐滴加入到异丙醇中,并不断搅拌,约3 h滴完.保持该温度,继续反应2~3 h.反应结束后,粗产品通过减压蒸馏,在80~84 ℃(1.35 kPa) 收集馏分即得到纯的DIPPH,产率为69.1%.DIPPH的表征结果如下:1H-NMR (DCCl3,δ):1.06~1.08 (d,3H,CH3in (CH3)2CH—),4.43~4.49 (m,1H,CH in (CH3)2CH—),5.38~5.48,7.67~7.71 (s,1H,P—H);31P-NMR (δ):4.4.
1.3N-二异丙氧磷酰化壳寡糖(DIPPCS)的合成
首先,在氮气保护下将2 g壳寡糖溶解在40 mL的蒸馏水中.然后将20 mL无水乙醇和一定量的三乙胺(TEA)在不断搅拌的情况下分别加到上述壳寡糖溶液中.当体系温度降到并保持在-5 ℃时,通过恒压滴液漏斗慢慢地将一定摩尔比的DIPPH和CCl4的混合液滴加到体系中,约2 h滴完.保持该温度,继续反应4 h,然后温度升高到室温再继续反应8~24 h.最后,将反应后混合物倾入到350 mL丙酮中沉淀,静置数小时后,将沉淀过滤,再将其装入索氏提取器中用无水乙醇提取24 h.最后,产品在真空干燥箱中40 ℃时干燥24 h.DIPPCS的合成路线如图1所示.
制备DIPPCS的最佳反应条件通过正交试验确定,其磷含量由ICP测得.

图1 N-二异丙氧磷酰化壳寡糖的合成Fig.1 Synthesis of DIPPCS
1.4样品的表征
1.4.1溶解性测试 将60 mg的样品和2 mL的溶剂装入试管中,在室温下保存10 d左右.
1.4.2红外 样品的红外光谱在室温下通过KBr压片法在Nicolet 380红外光谱仪上测得.
1.4.3ICP 样品中磷含量由ICP在Thermo Fisher IRIS上测得.
1.4.4核磁 样品的1H,13C 和31P-NMR谱图由Bruker-DTX-400 MHz光谱仪测得.将DIPPCS溶解在0.1 mol/L的DCl/D2O(30 g/L)中.1H 和13C-NMR谱的化学位移以TMS为标准,31P-NMR 谱的化学位移以85%的H3PO4为标准.
1.4.5热力学性质 热重分析在氮气气氛中进行,由STA409PC热重分析仪测得,其加热速率为10 ℃/min.
2 结果和讨论
2.1DIPPCS的合成
研究发现,反应体系中水和无水乙醇的体积比会对产品中磷的含量产生影响.从表1可以看出,当V(H2O)∶V(CH3CH2OH)= 1∶0时w(P)最大,但是此时31P-NMR图谱出现三个峰,这可能是由于有副产物生成所致.因此,水和无水乙醇的最佳体积比应为2∶1.

表1 不同V(H2O)∶V(CH3CH2OH)时产品的磷含量*
*反应条件:将4 g壳寡糖溶于蒸馏水中,水和乙醇的总体积为120 mL,n(CS)∶n(TEA)=1∶2,n(CS)∶n(DIPPH)=1∶2.
最优反应条件由正交试验[L9(33)]确定.其中三个变量分别为壳寡糖与三乙胺的摩尔比、壳寡糖与DIPPH的摩尔比以及室温下的反应时间.每个变量都有三组值,其取值见表2,实验结果见表3.从表3可以看出,三个变量对磷含量影响的大小顺序为:壳寡糖与三乙胺的摩尔比>室温下的反应时间>壳寡糖与DIPPH的摩尔比.因此,反应的最优条件确定如下:n(CS)∶n(TEA)=(1∶4)~(1∶6);n(CS)∶n(DIPPH)=(1∶2)~(1∶4);室温下的反应时间为8~16 h.在最优条件下得到的产品的最大含磷量为0.84%.
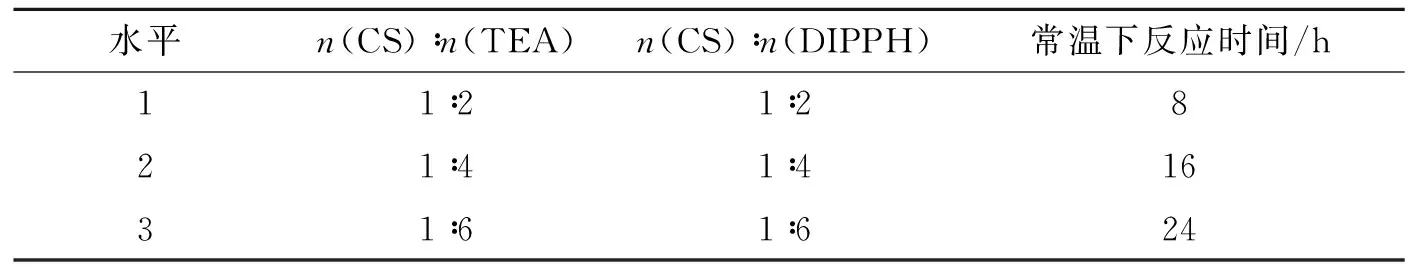
表2 L9 (33)正交试验设计表

表3 L9 (33)正交试验的数据
注:K1,K2,K3是每个量取3个值时磷含量的加和,k1,k2,k3分别是K1,K2,K3平均值,R是平均差.
2.2产品表征
以实验8(在最优条件下)得到的产品为例,对其进行溶解性、IR、 ICP、1H,13C,31P-NMR、TG等表征.
表4是壳寡糖和DIPPCS分别在水、酸、碱和一些有机溶剂中的溶解性情况.由表4可以看出,DIPPCS可以溶于水和DMSO,但这个过程需要10 d左右.

表4 壳寡糖和DIPPCS的溶解性
注: 60 mg样品和2 mL溶剂.++,可溶;+,部分溶解;±,溶胀;-,不溶.

DIPPCS的1H-NMR图谱如图3所示.峰的归属及化学位移如下所示:δ=4.76 (1—H);δ= 3.49~3.80(3—H,4—H,5—H,6—H);δ= 3.04~3.08(2—H)[12];δ=1.94 (COCH3),该峰出现表明壳寡糖原料并没有完全脱乙酰化,或者是由于壳寡糖链上的氨基被醋酸酸化了.8—H峰对应于二异丙氧磷酰基中的甲基,化学位移为1.19 (单峰).但是,二异丙氧磷酰基中的7—H(CH)的峰将不能识别出来,因为它和吡喃葡萄糖的H(CH)处于同一出峰区域.化学位移为1.03~1.07 处的三重峰对应于乙醇的甲基,这可能是由于纯化过程中的溶剂残留所致.

图2 壳寡糖 (a) 和DIPPCS (b)的红外光谱图Fig.2 IR spectrum of chitosan (a) and DIPPCS (b)

图3 DIPPCS的1H-NMR 图谱Fig.3 1H-NMR spectrum of DIPPCS
图4是DIPPCS的13C-NMR 图谱.图谱中共出现9组信号峰,位于55.8,60.2,69.0,76.2,75.0 和 97.5处,它们分别对应于壳寡糖单元吡喃糖环的2—C,6—C,3—C,5—C,4—C和1—C[12].化学位移为22.9处的峰对应于—COCH3中的—CH3,这也表明了壳寡糖原料并没有完全脱乙酰化,或者是由于壳寡糖链上的氨基被醋酸酸化了.除了壳寡糖链上这些固有的峰以外,在化学位移为22.2和71.7处出现两个新的峰,这两个峰分别代表—OCH(CH3)2中的CH3和CH.以上结果表明,壳寡糖链上的氨基和二异丙氧磷酰基发生了磷酰化反应.
化学位移为14.6和57.4的峰分别代表乙醇中的伯碳和仲碳,这也可能是因为在纯化的过程中有无水乙醇的残留所致.
在DIPPCS的31P-NMR(图5)中只在化学位移为8.1处出现一个单峰,这表明磷酰化反应只发生在了壳寡糖链的氨基上[13].
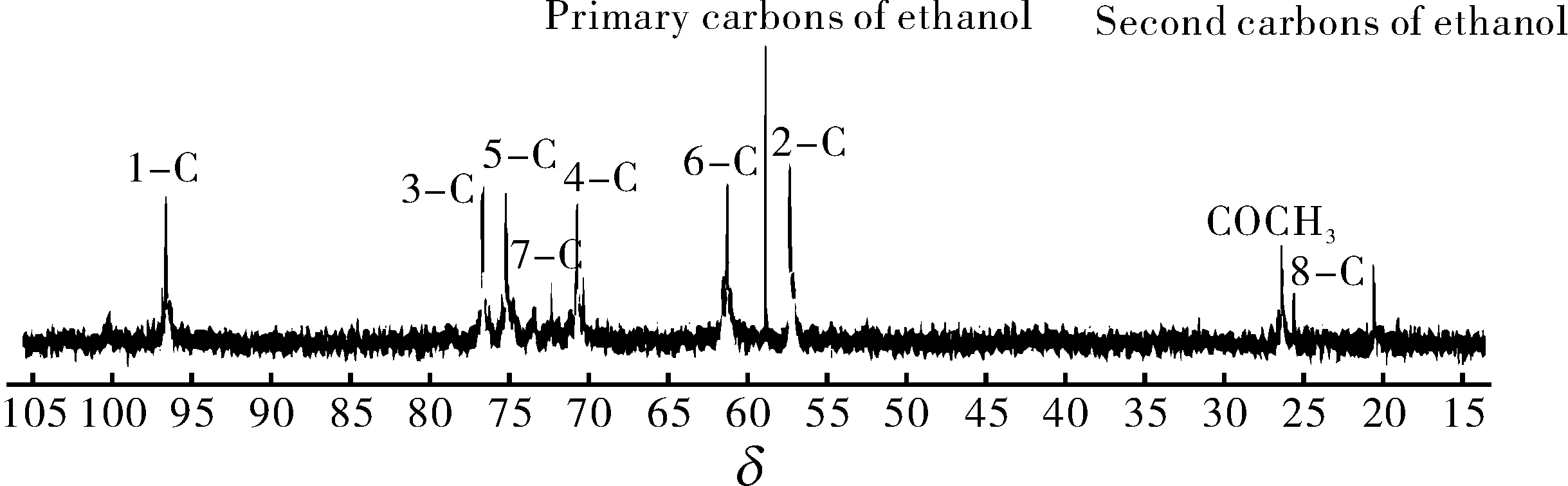
图4 DIPPCS的13C-NMR图谱Fig.4 13C-NMR spectrum of DIPPCS

图5 DIPPCS的31P-NMR 图谱Fig.5 31P-NMR spectrum of DIPPCS

图6 壳寡糖(a)和DIPPCS(b)的热重分析Fig.6 TG of chitosan (a) and DIPPCS (b)
图6为壳寡糖(a)和DIPPCS(b)的热重分析图.DIPPCS仅在207 ℃时表现出了比较明显的热降解过程.而壳寡糖在143 ℃和285 ℃时都表现出了比较明显的热降解.在230 ℃和310 ℃之间,壳寡糖的失重率低于DIPPCS的失重率,说明了在该温度区间壳寡糖稳定性好于修饰后的壳寡糖;在其他温度区间,壳寡糖的稳定性较修饰后的壳寡糖差.
3 结论
通过一步且简单有效的Atherton-Todd 反应成功地在壳寡糖的氨基上嫁接了二异丙氧磷酰基,合成出了DIPPCS. 经实验确定的最优反应条件为:水和无水乙醇的体积比为2∶1,n(CS)∶n(TEA)=(1∶4)~(1∶6),n(CS)∶n(DIPPH)= (1∶2)~(1∶4),室温下的反应时间为8~16 h.最优条件下得到产品的最大含磷量为0.84%.
简单高效的Atherton-Todd反应又为合成壳聚糖含磷衍生物提供了一条可行的路线,通过该法合成出的衍生物可能在抗菌或生物医药领域内具有潜在应用价值,在后续的工作中将会继续探讨.
[1] Foster A B,Webber J M. Chitin [J]. Adv Carbohydr Chem,1961,15: 371-393.
[2] Jayakumar R,Selvamurugan N,Nair S V,et al. Preparative methods of phosphorylated chitin and chitosan: an overview [J]. Int J Biol Macromol,2008,43 (3): 221-225.
[3] Jayakumar R,Reis R L,Mano J F. Chemistry and applications of phosphorylated chitin and chitosan [J]. E-Polymers,2006,35(3): 1-6.
[4] Sun Wei,Qin Peng,Gao Hongwei,et al. Electrochemical DNA biosensor based on chitosan/nano-V2O5/MWCNTs composite film modified carbon ionic liquid electrode and its application to the LAMP product of Yersinia enterocolitica gene sequence [J]. Biosens Bioelectron,2010,25 (6): 1264-1270.
[5] Lebouc F,Dez I,Madec P J. NMR study of the phosphonomethylation reaction on chitosan [J]. Polymer,2005,46(2): 319-325.
[6] 马力,郭静,刘蒲.壳聚糖含磷衍生物的合成、表征及其应用研究 [J]. 化学进展,2010,22(5):938-947.
[7] Sakaguchi T,Hirokoshi T,Nakajima A. Adsorption of uranium by chitin phosphate and chitosan phosphate [J]. Agric Biol Chem,1981,45 (10): 2191-2195.
[8] Heras A,Rodríguez N M,Ramos V M,et al. N-methylene phosphonic chitosan: a novel soluble derivative [J]. Carbohydr Polym,2001,44(1): 1-8.
[9] Jayakumar R,Nagahama H,Furuike T,et al. Synthesis of phosphorylated chitosan by novel method and its characterization [J]. Int J Biol Macromol,2008,42 (4): 335-339.
[10] Palma G,Casals P,Cardenas G. Synthesis and characterization of new chitosan-O-ethyl phosphonate [J]. J Chile Chem Soc,2005,50(4): 719-724.
[11] Meng Sheng,Liu Zongjun,Zhong Wei,et al. Phosphorylcholine modified chitosan: appetent and safe material for cells[J]. Carbohydr Polym,2007,70(1): 82-88.
[12] Ramos V M,Rodríguez N M,Rodríguez M S,et al. Modified chitosan carrying phosphonic and alkyl groups[J]. Carbohydr Polym,2003,51(4): 425-429.
[13] Yin Y W,Zhang B Z,Xue C B,et al. N-phosphoryl amino acids and peptides. part IV: N-alkyl substitution effects on the31P-NMR spectra of phosphoramidates[J]. Phosphorus,Sulfur Silicon Relat Elem,1991,57(1): 5-9.
SynthesisandCharacterizationofDiisopropylPhosphorylChitosan
MA Li, LI Guang-hua, LI Ke-rang, LI Li-min, LIU Pu
(DepartmentofChemistry,ZhengzhouUniversity,Zhengzhou450001,China)
A novel diisopropyl phosphoryl chitosan was successfully synthesized by Atherton-Todd reaction of chitosan with diisopropyl phosphite. The effects of reaction conditions including volume ratio of water to ethanol,molar ratio of chitosan to triethylamine,molar ratio of chitosan to diisopropyl phosphite,and reaction time at the room temperature on the phosphorus content were investigated. IR,1H-NMR,13C-NMR and31P-NMR showed that diisopropyl phosphoryl group was grafted on the amino group of chitosan. The results of TG were also investigated.By this simple and efficient synthetic method a new approach to the preparation of N-phosphoryl chitosan derivatives was provided.
chitosan;diisopropyl phosphoryl chitosan;Atherton-Todd reaction;characterization
TQ 316.6+5
A
1671-6841(2011)04-0084-05
2010-11-10
国家自然科学基金资助项目,编号20872134.
马力(1984-),男,硕士,主要从事高分子功能材料研究;通讯作者:刘蒲(1965-),女,教授,博士,主要从事功能材料研究.

