河蚬扰动沉积物界面效应及其在水中代谢速率
张 雷,商景阁,王兆德,申秋实,范成新 (中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏南京 210008)
河蚬扰动沉积物界面效应及其在水中代谢速率
张 雷,商景阁,王兆德,申秋实,范成新*(中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏南京 210008)
采用室内培养实验,研究了河蚬扰动对沉积物耗氧速率与营养盐通量的影响及河蚬在水中的呼吸与排泄速率.结果表明,河蚬增大了沉积物耗氧速率与溶解活性磷(SRP)、NH4+、NO3-向上覆水释放通量.河蚬在沉积物-水系统中产生NO3
-速率与其在水中产生NO3
-速率不存在显著差异.而河蚬在水中呼吸速率是其在沉积物-水中所产生净耗氧速率的4.3倍,河蚬在水中排泄SRP、NH4+速率分别为其在沉积物-水中所产生净SRP、NH4+释放速率的7.3倍与20倍.这些显著差异可能是由于河蚬在水中与沉积物中的活动形态不同.
河蚬;沉积物-水界面;氧气;溶解活性磷;氨氮;硝酸根
底栖动物通过摄食、构筑洞穴、通风、排泄等活动,影响 O2在沉积物中的分布[1-2]与消耗速率[3-4]、以及营养盐、重金属在沉积物-水界面的迁移、转化过程[5-8].河蚬(Corbicula fluminea)是一种穴居于淡水、咸淡水底沉积物表层的双壳类软体动物[9-10],可以在水底高密度聚集,成为底栖生物群落的优势种,控制水底生物分布等[11-13].河蚬扰动对O2、溶解态营养盐在沉积物-水界面迁移过程的影响[14-17],以及河蚬在水中的呼吸与排泄速率等方面的研究,受到一些学者的关注
[12,18-19],而这两者之间又存有怎样的关系尚不清楚.
本研究基于这一出发点,通过室内培养实验,研究河蚬在沉积物-水系统中对沉积物耗氧速率、营养盐在界面通量的影响,以及河蚬在水中的呼吸与排泄速率,旨在揭示2种不同环境下氧消耗速率与营养盐释放速率的差异.
1 材料与方法
1.1 野外采样
河蚬在太湖分布广泛,其中贡湖湾和西部湖区密度最高[20-21].2008年11月12日利用大口径
* 责任作者, 研究员, cxfan@niglas.ac.cn重力采样器(直径110mm,长500mm)在太湖马山南(31°21′45.4″N, 120°8′18.7″E)采集沉积物柱样,同时采集湖水用于室内培养.利用彼得森采样器采集表层沉积物、收集河蚬,并取一些沉积物与湖水将收集的河蚬暂养.所有样品在采集后立即运回实验室处理、培养.
1.2 实验设计
将所采集沉积物柱样从表层至层深12cm切分成6层,每层2cm.把相同层位的沉积物收集在一起,然后过 30目筛以去除其中河蚬等底栖生物、大颗粒物.将过筛后的各层沉积物分别混匀,按其原顺序装填到下端密封的有机玻璃管(直径110mm×长170mm)中,每层深2cm.然后利用医用输液器把所采集湖水轻轻地引到沉积物上.共制得 6根沉积物柱样,每根沉积物深 12cm,上覆水深5cm.将制得柱样放在40 L培养水槽内,加湖水淹没培养,每 3d更换一次湖水,并用微型曝气头充气预培养 16d,以使沉积物性质稳定.将所采集河蚬放在铺有沉积物的水槽中暂养.同时取0~2cm沉积物分析其基本理化性质.
在17d,将6根柱样随机分成2组,每组3根.其中一组为对照组(C);另外一组为河蚬扰动组(B).在17d测定沉积物耗氧速率;第18d,测定氨氮(NH4+)、硝酸根(NO3-)与溶解活性磷(SRP)在沉积物-水界面通量.根据前期调查所得太湖最高河蚬密度(1072ind./m2)与生物量(2918g/m2)[17],在实验第19d,向河蚬组各柱样表面轻轻引入10只个体中等大小(2.48~3.22g/只,体长 1.82~2.19cm)河蚬,每组10只河蚬总湿重为(29.0±0.1)g.柱样继续放在水槽中淹没充气培养20d,每3d更换一次湖水.在第37,38d分别测定耗氧速率与界面营养盐通量.实验第39d,将河蚬从各柱样中分别挑出,依然保持3组,测定其在水中呼吸速率与排泄速率(在后文图中用R表示).在整个实验过程中,实验室温度保持在(15±1)℃,与采样时沉积物-水界面处温度一致.
测定沉积物耗氧速率、沉积物-水界面营养盐通量时,首先将水槽水位调至低于培养管上端.测耗氧速率时,利用虹吸法从上覆水中下部吸取上覆水进入微碘量瓶(50mL),让水溢流50mL以排除空气干扰,然后迅速固定水中溶解氧(DO).同时向柱样中补充100mL水槽中的培养水,用一具O型密封圈塞子将上覆水端密封.2h后再次取样分析 DO.界面营养盐通量通过测定上覆水中NH4+、NO3
-、SRP随时间的变化实现.每次用注射器在沉积物-水界面上方0.5cm处抽取15mL上覆水,并用15mL培养水补充被抽掉的上覆水.迅速将水样用0.45μm醋酸纤维滤膜过滤,4℃冷藏待分析.测定通量时,每 0.5h取样一次,每测定一次通量取样5次.为减小浮游生物等干扰,耗氧速率及营养盐通量测定在黑暗环境中进行.河蚬在水中呼吸、排泄速率的测定方法为:将河蚬冲洗干净,3组河蚬分别放入3只500mL三角瓶中,加入湖水密塞;同时另取3只500mL三角瓶加满湖水作为空白对照样,黑暗处放置 2h,测定密封前后湖水中O2、NH4+、NO3-、SRP的浓度.
1.3 样品分析
将新鲜沉积物在60℃条件下烘至恒重,根据前后质量差计算沉积物含水率.将烘干的沉积物磨碎、过100目筛后放550℃马弗炉中灼烧5h,通过质量差计算烧失重(LOI).沉积物中总氮与总磷分别采用碱性过硫酸钾消解法与SMT法[22].水中DO测定采用微碘量法[23].水中SRP、NH4+、NO3
-分别采用钼锑抗光度法、纳氏试剂分光光度法与紫外分光光度法测定[24].
1.4 数据处理与统计分析
测定通量过程中不断用培养水补充被抽掉的上覆水,则需对所测定上覆水浓度根据式(1)进行校正:

式中:Ci′是第 i(≥2)次校正后的上覆水浓度, μmol/L;Ci是第 i(≥1) 次测定出来的上覆水浓度, μmol/L; C0是培养水浓度,μmol/L;V与V0分别是柱样上覆水体积(L)与每次所抽取水样体积(L).将所获得校正数据对时间作图,得浓度对时间的回归斜率;然后利用式(2)计算通量:

式中: F表示溶解物质在沉积物-水界面通量, μmol/(h⋅m2); k为该溶解物质在上覆水中浓度对时间的回归斜率,μmol/(L·h); V为上覆水体积,L; A为沉积物柱样表面积,m2.在沉积物耗氧速率与河蚬在水中代谢速率计算中略去浓度校正步骤,直接利用式(2)计算.
沉积物耗氧速率、界面通量与呼吸、代谢速率结果均表示为:平均值 ± 标准偏差 (n=3)的形式.河蚬在沉积物-水界面所产生的扰动效应(耗氧速率,SRP、NH4+与NO3-通量)、及其在水中呼吸、排泄速率均表示为μmol/(h⋅g)的形式,其中河蚬重量为去壳干重,根据所添加河蚬湿重、及河蚬去壳干重与湿重比为 0.024[17]换算得出.采用单因子方差分析(one-way ANOVA)检验C组与B组、B-C与R之间的差异,统计分析利用软件SPSS(13.0)完成.P>0.05表示差异不显著, P<0.05
表示差异显著,P<0.01表示差异高度显著,
P<0.001表示差异极显著.
2 结果
表层 0~2cm沉积物含水率 49.3%,LOI为4.72%,总氮、总磷含量分别为 12.8,51.2μmol/g.被引入到沉积物表面上后,河蚬开始挖穴.其活动破坏了沉积物表层原有结构,使得一些厌氧沉积物被上覆水所氧化.随着其对环境的适应,河蚬逐渐稳定下来,开始穴居生活,偶尔可以观察到其运动或伸出虹吸管.在实验后期测定河蚬在水中呼吸与排泄速率时,发现河蚬瓣膜经常处于张开状态.
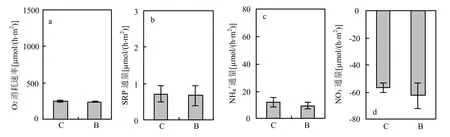
图1 引入河蚬前沉积物耗氧速率与营养盐通量Fig.1 Sediment oxygen uptake rates and nutrient fluxes before the introduction of C. fluminea
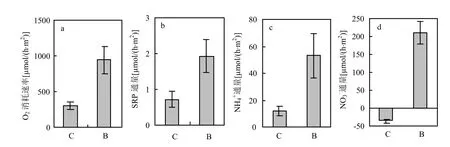
图2 引入河蚬后沉积物耗氧速率与营养盐通量Fig.2 Sediment oxygen uptake rates and nutrient fluxes after the introduction of C. fluminea
在引入河蚬前(图1),对照组与河蚬扰动组沉积物耗氧速率不存在显著差异(P>0.05). SRP、NH4+在沉积物-水界面通量向上,呈释放状态,两组之间差异不显著(P>0.05).与SRP、NH4+呈向上释放不同, NO3-通量向下,表现为沉积物吸收上覆水中NO3-,对照组与河蚬扰动组差异也不显著(P >0.05).
河蚬显著改变了沉积物耗氧速率及营养盐在沉积物-水界面通量(图 2).河蚬扰动组沉积物耗氧速率是对照组的 3.1倍,两者差异显著(P<0.01).河蚬显著促进了 SRP、NH4+向上覆水的释放,河蚬组SRP、NH4+通量分别是对照组的2.6倍(P<0.05)与 4.4倍(P<0.05).同时,河蚬改变了NO3-在沉积物-水界面通量方向,促进 NO3-向上覆水释放(P<0.001).
河蚬在沉积物中所增大 O2消耗速率为9.2μmol/(h⋅g),仅为其在水中呼吸速率[39.9μmol/ (h⋅g)]的0.23倍(P<0.001)(图3).河蚬在沉积物-水系统中所产生净 SRP释放速率为 0.017μmol/ (h⋅g),而其在水中排泄SRP速率则为此速率的20倍(P<0.01).河蚬在水中排泄 NH4+速率为4.3μmol/(h⋅g),为其在沉积物-水界面所产生净NH4+释放速率[0.59μmol/(h⋅g)]的 7.3倍(P<0.01).河蚬在沉积物-水界面所产生净NO3-释放速率为(3.5±0.45)μmol/(h⋅g),其在水中所产生硝酸根速率为(3.0±0.65)μmol/(h⋅g),两者差异不显著(P >0.05).
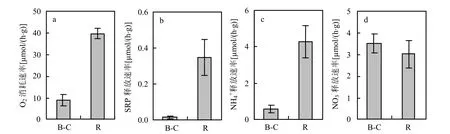
图3 河蚬在沉积物-水系统、水中分别产生的耗氧速率、营养盐释放速率Fig.3 Sediment oxygen uptake and nutrient release rates caused by C. fluminea in sediment-water system and water separately
3 讨论
实验结果表明,15℃时河蚬在水中呼吸速率为39.9μmol/(h⋅g),与Hakenkamp等[16]在18℃时所得49.4μmol/(h⋅g)在同一数量级内,两者之间的差异可能是因为实验温度不同.随着温度升高,河蚬呼吸速率增大,例如:温度由 20°C 升高到28°C,一只湿重 1.7g河蚬的呼吸速率增大了40%[18].河蚬增大了沉积物耗氧速率(图 2a),这与关于其他双壳动物的研究结果一致[3,25].底栖动物增大沉积物耗氧速率的原因包括以下 2个方面:一是底栖动物自身的呼吸作用,二是生物扰动所引起的厌氧沉积物氧化、沉积物中微生物活性增强等[4].底栖动物的呼吸速率常常通过与本实验类似的方法测定,然后将有扰动的沉积物耗氧速率减去对照样耗氧速率与底栖动物呼吸速率,即得生物扰动本身所引起沉积物耗氧速率的增加量[4,8,26].因此,底栖生物的呼吸速率应该小于其在沉积物中所引起的耗氧速率增大量.但本实验结果却表明河蚬在水中的呼吸速率远大于河蚬所引起沉积物耗氧速率的增加量(图 3a).产生这一结果的原因可能是因为河蚬在沉积物-水系统与其在水中的生活、摄食方式不同.
河蚬是一种双食性底栖动物,在沉积物-水系统中,它们既可以通过虹吸管从水中滤食有机颗粒,也可以通过斧足从沉积物中摄食有机质,而在水中,它只能通过滤食维持生命[14,16].既能够通过斧足摄食又能滤食的河蚬,比仅能滤食的河蚬长的快[16],同时有研究表明单独滤食所提供能量不超过河蚬总能量需求的51%[27].为保持其身体代谢的高能量需求,在水中的河蚬必须张开瓣膜加大其摄食力度.在沉积物中,河蚬通过间歇新陈代谢维持生命,它们通常持续闭合瓣膜 5~10h,闭合时间长达几天的情况也有发生[28].但在水中,河蚬闭合瓣膜的时间不会超过7min[29].这与实验中观察河蚬在沉积物中与水中的活动情况一致.而河蚬张开瓣膜时其呼吸、代谢速率是瓣膜闭合时的 10倍[28].因此,河蚬在水中的呼吸速率要比其在沉积物中高出许多.从图 3a的数据分析,河蚬在水中呼吸速率至少为其在沉积物中呼吸速率的4.3倍.
Wittmann等[19]研究结果表明,1只长 2.0cm (本研究使用河蚬平均体长)河蚬排泄 SRP与NH4+速率分别为 1.1,14.9μmol/d.基于上述数据,假设相同体长河蚬的重量、排泄量相同,那么河蚬排泄 SRP与 NH4+的速率可以转换为 0.69, 9.48μmol/(h⋅g).本研究所得河蚬在水中排泄SRP、NH4+速率分别为 0.34,4.3μmol/(h⋅g)(图3b,c),相对偏小.这可能是因为本研究实验温度15℃,Wittmann等研究温度为 19℃,与其呼吸速率随温度的变化一样,温度升高河蚬排泄SRP与NH4+速率也会显著增大[12,18-19].
NH4+、SRP在沉积物-水界面释放通量不仅受河蚬排泄速率的影响,同时受河蚬扰动过程的影响.生物扰动能促进有机质矿化,产生的SRP、NH4+富集在间隙水中或释放到上覆水中[8].河蚬扰动增大沉积物-水界面面积,有利于间隙水中SRP、NH4+向上覆水扩散;同时扰动可以在间隙水与上覆水之间产生平流作用,这一过程也有利于两者的释放[30].虽然河蚬扰动能够增加氧化沉积物体积,伴随加强的硝化、二价铁氧化等过程存在减小间隙水中NH4+、SRP浓度的可能,但由于机质矿化产生SRP、NH4+过程的存在,减小程度往往不显著[17].因此,总体而言河蚬自身代谢及其扰动本身对沉积物所产生的影响均是有利于SRP、NH4+向上覆水释放.由于河蚬在水中代谢速率约为其在沉积物中的 10倍[28],其在水中排泄速率也得到加强.这正是河蚬在水中排泄NH4+、SRP速率为其在沉积物中所产生净NH4+、SRP释放速率7.3倍与20倍的原因.
河蚬在水中的活动增大了NO3-浓度(图3d),这在前人研究中未被关注.其他一些双壳类动物在排泄过程中产生NO3-[31],这可能是因为它们壳与内部组织上繁殖有大量的硝化细菌[32].河蚬改变了NO3-在沉积物-水界面通量方向,促进NO3-向上覆水释放(图 2d).这主要是因为河蚬的扰动及排泄为硝化反应提供了充足的氨氮,同时河蚬扰动加深了O2在沉积物中的渗透,扩展了硝化细菌活动范围并改善硝化活动进行的环境条件[15].结果还表明,河蚬在沉积物-水系统中产生的净NO3-释放速率与其在水中产生 NO3-的速率不存在显著差异(图 3d).这可能是因为河蚬在水中升高NO3-浓度是因为其壳与内部组织上附着硝化细菌,即通过强化硝化反应实现水中NO3-浓度升高,与河蚬自身排泄关系不大.
本实验结果表明,不可用在水中测得河蚬呼吸、排泄速率代替其在沉积物中所产生的耗氧速率与营养盐通量;在研究河蚬对沉积物-水界面氧消耗速率及营养盐通量的影响时,也不可用在水中测定的呼吸、排泄速率来代替其在沉积物中的呼吸、排泄速率.如何确定河蚬及类似底栖动物在沉积物中呼吸、排泄速率,及其活动本身对沉积物耗氧速率及界面营养盐循环过程的贡献,需在后续研究中加强.
4 结论
4.1 河蚬增大了沉积物耗氧速率、增大了沉积物中SRP、NH4+、NO3-向上覆水释放通量.
4.2 与河蚬在沉积物-水系统中所产生的净耗氧速率、净SRP、NH4+释放速率相比,河蚬在水中呼吸速率、SRP与 NH4+排泄速率分别为其4.3、20与7.3倍,差异显著.而河蚬在沉积物-水系统中所产生的净 NO3-释放速率与其在水中产生NO3-的速率不存在显著差异.
[1] Wang F, Tessier A, Hars L. Oxygen measurements in the burrows of freshwater insects [J]. Freshwater Biology, 2001,46(2):317-327.
[2] Polerecky L, Volkenborn N, Stief P. High temporal resolution oxygen imaging in bioirrigated sediments [J]. Environmental Science and Technology, 2006,40(18):5763-5769.
[3] Michaud E, Desrosiers G, Mermillod-Blondin F, et al. The functional group approach to bioturbation: The effects of biodiffusers and gallery-diffusers of the Macoma balthica community on sediment oxygen uptake [J]. Journal of Experimental Marine Biology and Ecology, 2005,326:77-88.
[4] Glud R N. Oxygen dynamics of marine sediments [J]. Marine Biology Research, 2008,4:243-289.
[5] Andersson G, Granéli W, Stenson J. The influence of animals on phosphorus cycling in lake ecosystems [J]. Hydrobiologia, 1988,170:267-284.
[6] 路永正,阎百兴.颤蚓扰动作用对铅镉在沉积物-水相中迁移的影响 [J]. 中国环境科学, 2010,30(2):251-255.
[7] Vanni M J. Nutrient cycling by animals in freshwater ecosystems [J]. Annual Review of Ecology and Systematics, 2002,33:341-370.
[8] Welsh D T. It’s a dirty job but someone has to do it: the role of marine benthic macrofauna in organic matter turnover and nutrient recycling to the water column [J]. Chemistry and Ecology, 2003,19:321-342.
[9] 张虎才,陈 玥,樊红芳,等.河蚬分布的气候环境及壳体稳定同位素 [J]. 海洋地质与第四纪地质, 2007,27(3):77-84.
[10] 刘 敏,熊邦喜.河蚬的生态习性及其对重金属的富集作用 [J].安徽农业科学, 2008,36(1):221-224.
[11] Cherry D L, Roy R L, Lechleitner R A, et al. Corbicula fouling and control measures at the Celco Plant, Virginia [J]. American Malacological Bulletin, 1986,2:69-81.
[12] Lauritsen D D, Mozley S C. Nutrient excretion by the Asiatic clam Corbicula fluminea [J]. Journal of North American Benthological Society, 1989,8:134-139.
[13] Poff N, Palmer M, Angermeier P, et al. Size structure of the metazoan community in a Piedmont stream [J]. Oecologia, 1993, 95(2): 202-209.
[14] Vaughn C C, Hakenkamp C C. The functional role of burrowing bivalves in freshwater ecosystems [J]. Freshwater Biology, 2001,46:1431-1446.
[15] 陈振楼,刘 杰,许世远,等.大型底栖动物对长江口潮滩沉积物-水界面无机氮交换的影响 [J]. 环境科学, 2005,26(6):43-50.
[16] Hakenkamp C C, Palmer M A. Introduced bivalves in freshwater ecosystems: the impact of Corbicula on organic matter dynamics in a sandy stream [J]. Oecologia, 1999,119:445-451.
[17] 张 雷.生物扰动下湖泊沉积物-水界面特征变化与磷的迁移转化 [D]. 南京:中国科学院南京地理与湖泊研究所, 2010.
[18] 刘其根,沈和定,周洪琪,等.河蚬的耗氧率与排氨率 [J]. 上海水产大学学报, 1999,8(4):298-303.
[19] Wittmann M, Reuter J, Schladow G, et al. Asian clam (Corbicula fluminea) of Lake Tahoe: Preliminary scientific findings in support of a management [EB/OL]. http://169.237.166.248/ research/AsianClam2009.pdf.
[20] 蔡永久,龚志军,秦伯强.太湖大型底栖动物群落结构及多样性[J]. 生物多样性, 2010,18(1):50-59.
[21] 蔡 炜,蔡永久,龚志军,等.太湖河蚬时空格局 [J]. 湖泊科学, 2010,22(5):714-722.
[22] Ruban V, López-Sánchez J F, Pardo P, et al. Selection and evaluation of sequential extraction procedures for the determination of phosphorus forms in lake sediment [J]. Journal of Environmental Monitoring, 1999,1(1):51-56.
[23] USEPA-LG501-2007 Standard operating procedure for dissolved oxygen micro method, Winkler titration [S].
[24] 国家环境保护总局水和废水检测分析方法编委会. 水和废水检测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002: 243-285.
[25] Karlson K, Hulth S, Ringdahl K, et al. Experimental recolonisation of Baltic Sea reduced sediments: survival of benthic macrofauna and effects on nutrient cycling [J]. Marine Ecology Progress Series, 2005,294:35-49.
[26] Svensson J M, Leonardson L. Effects of bioturbation by tube-dwelling chironomid larvae on oxygen uptake and denitrification in eutrophic lake sediments [J]. Freshwater Biology, 1996,35(2):289-300.
[27] Boltovskoy D, Izaguirre I, Correa N. Feeding selectivity of Corbicula fluminea (Bivalvia) on natural phytoplankton [J]. Hydrobiologia, 1995,312:171-182.
[28] Ortmann C, Grieshaber M K. Energy metabolism and valve closure behaviour in the Asian clam Corbicula fluminea [J]. The Journal of Experimental Biology, 2003,206:4167-4178.
[29] Saloom M E, Duncan R S. Low dissolved oxygen levels reduce anti-predation behaviours of the freshwater clam Corbicula fluminea [J]. Freshwater Biology, 2005,50:1233-1238.
[30] Kristensen E. Organic matter diagenesis at the oxic/anoxic interface in coastal marine sediments, with emphasis on the role of burrowing animals [J]. Hydrobiologia, 2000,426(1):1-24.
[31] Magni P, Montani S, Takada C, et al. Temporal scaling and relevance of bivalve nutrient excretion on a tidal flat of the Seto Inland Sea, Japan [J]. Marine Ecology Progress Series, 2000,198: 139-155.
[32] Welsh D T, Castadelli G. Bacterial nitrification activity directly associated with isolated benthic marine animals [J]. Marine Biology, 2004,144:1029-1037.
Bioturbation effects of Corbicula fluminea on sediment-water interface progresses and its metabolic rate in water.
ZHANG Lei, SHANG Jing-ge, WANG Zhao-de, SHEN Qiu-shi, FAN Cheng-xin*(State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China). China Environmental Science, 2011,31(6):1001~1006
A laboratory incubation experiment was carried out to investigate the effects of Corbicula fluminea bioturbation on sediment oxygen uptake and nutrient fluxes across the sediment-water interface, and the respiratory rate and excretion rate of C. fluminea in water. Sediment oxygen uptake rate and SRP, NH4+and NO3-fluxes from sediment to the overlying water were promoted by C. fluminea bioturbation. The producing rate of NO3-from C. fluminea activities in water was not significantly different from that in the sediment-water system. The respiratory rate of C. fluminea in water was 4.3 times as much as the net oxygen uptake caused by C. fluminea in the sediment-water system. Furthermore, the excretion rates of SRP and NH4+in water were 7.3 and 20 times as much as their net release rates caused by C. fluminea in the sediment-water system, respectively. The above differences between in water and the sediment-water system may be likely due to different living styles of C. fluminea in the two environments.
Corbicula fluminea;sediment-water interface;oxygen;soluble reactive phosphorus;ammonium;nitrate
X174
A
1000-6923(2011)06-1001-06
2010-10-08
国家自然科学基金资助项目(40730528,50979102);江苏省社会发展项目(BE2009603);江苏省自然科学基金项目(BK2009332)
张 雷(1982-),男,安徽宿州人,中国科学院南京地理与湖泊研究所博士研究生,主要从事湖泊沉积物-水界面环境地球化学研究.发表论文10篇.

