辽河口芦苇湿地土壤氨氧化菌的时空变化
白 洁,董 晓,赵阳国* (.中国海洋大学环境科学与工程学院,山东 青岛 26600;2.海洋环境与生态教育部重点实验室,山东 青岛 26600)
辽河口芦苇湿地土壤氨氧化菌的时空变化
白 洁1,2,董 晓1,赵阳国1,2*(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.海洋环境与生态教育部重点实验室,山东 青岛 266100)
采用传统的最大或然数法(MPN)和不依赖于培养的变性梯度凝胶电泳技术(DGGE),对辽河口芦苇湿地土壤中AOB的丰度、多样性进行了解析,并试图探究AOB同土壤可溶性盐分等环境因素之间的关系.结果表明:芦苇湿地土壤中AOB多样性指数时空分布存在较大差异,同一月份中不同站点之间群落结构相似性较大,AOB细菌数量与土壤可溶性盐分之间存在显著负相关关系(P<0.05),与土壤总氮和有机
质含量之间存在极显著性正相关关系(P<0.01),表明盐分、总氮和有机质含量是辽河口湿地AOB数量时空分布的重要影响因素.
辽河口湿地;氨氧化菌(AOB);可溶性盐分;有机质;总氮
硝化作用是氮素生物地球化学过程的重要环节,是生态系统中氮素损失的潜在途径[1],深入理解该过程对于探讨湿地氮源污染的去除、湿地生态系统生产力以及氮素界面过程具有重要意义[2].氨氧化菌(AOB)参与氨氮到亚硝酸盐的好氧氧化过程,是硝化作用的起始阶段,也是硝化作用的限速步骤.因此,在湿地土壤环境中,氨氧化菌生产的亚硝酸盐将会立即被亚硝酸盐氧化菌氧化,使这些区域的亚硝酸盐浓度保持较低水平
[3].运用分子生物学变性梯度凝胶电泳技术(DGGE)不仅能对可培养的微生物进行分析,还可以对不可培养的微生物进行研究,能更真实地反映系统中微生物种群的构成和分布[4-5].
辽河三角洲湿地是我国最大的滨海河口湿地,具有丰富的生物多样性.目前,对辽河河口湿地的相关研究主要集中在植物、动物特别是鸟类研究方面,但对该地区土壤微生物方面的研究工作很少[6],尤其是硝化细菌群落结构方面目前尚未见报道.本研究采用 PCR-DGGE法研究了辽河口湿地土壤中AOB在不同月份和不同.地理区域的分布特征和变化规律,并分析了 AOB数量和土壤总氮等环境因素之间的关系,以期为进一步合理开发辽河口湿地的微生物资源,保障河口湿地的生态健康提供理论依据.
1 材料与方法
1.1 样品采集
2009年6月、8月和10月,在辽河河口芦苇湿地分别选取芦苇长势良好的未退化区(W1,121°47¢30.5²E,41°09¢34.7²N)、完全退化后进行人工恢复且芦苇生长较好区(W2, 121°36¢32.7²E, 40°52¢06.7²N)、完全退化后进行人工恢复但芦苇长势较差区(W3,121°36¢22.4²E, 40°52¢11.9²N)、退化严重但无人为恢复区(W4, 121°36¢12.4²E,40°52¢10.2²N)、已完全退化为无植被生长区(W5,121°36¢08.0²E,40°51¢53.4²N)为采样站点.采集各站位表层(0~10cm)土壤,混匀后装入灭菌封口袋中,低温保存带回实验室,部分样品用于AOB计数,部分样品在室内风干用于土壤理化因子的测定,其余样品在-20℃下冷冻保存,用于细菌群落结构分析.
1.2 样品测定
1.2.1 AOB计数 采用最大或然数法(MPN)[7]对土壤AOB进行计数.
1.2.2 土壤理化性质测定 土壤总氮的测定采用凯氏定氮法[8];可溶性盐分测定采用重量法[9];有机质含量采用重铬酸钾容量法-外加热方法[8];石油类含量测定采用紫外分光光度方法[10]进行测定.
1.2.3 土壤 AOB的群落结构分析 采用PCR-DGGE对土壤AOB的群落结构进行分析.土壤总基因组使用快速提取试剂盒(土壤基因组DNA提取试剂盒,北京百泰克生物技术有限公司),为了提高扩增的专一性,采用巢式PCR进行扩增.第一轮采用细菌16S rDNA基因通用引物BSF8/20:5'-AGAGTTTGATCCTGGCTCAG-3',和BSR1541/20:5'-AAGGAGGTGATCCAGCC GCA-3'[11]进行扩增,获得约1.5kb的目的条带;第二轮采用 AOB特异性引物进行扩增,上游为带GC夹的CTO189f:5'-CGCCCGCCGCGCGGCG GGCGGGGCGGGGGCACGGGGGGAGGAAA GTAGGGGATCG-3',下游引物为 CTO654r:5'-CTAGCYTTGTAGTTTCAAACGC-3'[12].PCR 25µL反应体系:10×Buffer2.5µL,2.5mmol/LdNTP 4µL,5U/µLTaqDNA聚合酶0.25µL,0.05-1µg/µL模板 0.25µL,ddH2O补足 1到 25µL.扩增条件为:94℃预变性 5min,94℃变性 40s,54℃退火40s,72℃延伸2 min,30个循环;72℃延伸10min.采用1.0%(质量分数)琼脂糖凝胶电泳对PCR扩增产物进行检验 .采用Bio-rad公司的突变检测系统对PCR扩增产物进行DGGE分析.聚丙烯酰胺变性梯度胶质量分数为 6%,变性梯度为30%~50%,温度6O℃,电压150V,1×TAE缓冲液中电泳210min后,用EB染色液染色30min,水洗10min,然后立即在紫外照射仪上摄相.
1.3 数据处理
使用Gel-PRO ANALYZER软件对DGGE指纹图谱进行定量分析,绘制 AOB数量分布特征图;统计及聚类分析采用SPSS13.0软件.
2 结果与分析
2.1 AOB数量的分布特征
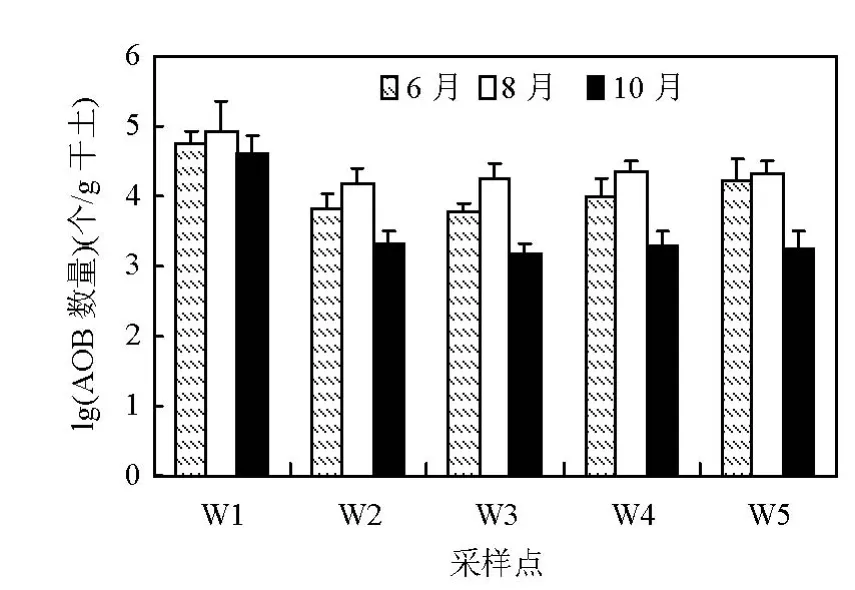
图1 芦苇湿地土壤AOB数量分布Fig.1 Distribution of quantitiy of AOB in reed wetland
由图1可见,6月AOB的数量在6.80×103~5.61×104个/g干土之间,平均(1.92±2.10)×104个/ g干土;8月1.44×104~8.37×104个/g干土之间,平均值为(3.20±2.92)×104个/g干土;10月1.47×103~4.04×104个/g干土之间,平均值为(9.52±1.72)× 103个/g干土.AOB数量的季节变化较大,主要表现为8月较高、6月次之、10月较低(图 1).8月其平均值分别比6月和10月高出几倍和一个数量级,主要与气温和其他环境因素有关.8月环境温度较高,且降雨量较大致使土壤含水率较高,有利于AOB的生长和繁殖[13].
芦苇长势良好的未退化区AOB数量明显多于其他区域,主要与芦苇的根际效应有关[14];严重退化区、无植被区与人工恢复区之间没有明显差异,可能与人工恢复时间较短,生态功能还未趋于稳定或完全恢复有关,也表明河口湿地生态功能的完全恢复滞后于生态结构的恢复.
2.2 土壤AOB数量与环境因子之间的关系
由表 1可见,土壤总氮含量平均值为(1.117± 0.015)g/kg,各月平均值分布中,8月最低,10月最高,6月次之,与AOB数量的分布相反;这可能因为8月较高的温度增强了硝化反硝化微生物的活性
[15],土壤硝化反硝化速率较高,总氮去除率增大;并且 8月降雨增加,一部分总氮随径流流失,相关性分析结果显示土壤总氮与AOB数量呈极显著相关性(r=0.745,P<0.01).有机质通过对总氮的影响间接影响 AOB分布,对二者进行相关性分析,两者呈极显著相关性(r=0.848,P<0.01),这与吕国红等
[16]、袁可能[17]对湿地土壤的研究结果一致.
本研究区域各站位土壤可溶性盐分平均值在8.9g/kg左右,属于盐土.相关性分析结果显示, AOB 数量与可溶性盐分呈显著负相关(r= -0.637),说明盐分能够影响微生物的活性.退化湿地土壤盐分高、植被稀少、土壤容重较大、孔隙度小,可能导致微生物活性受到抑制,数量较少
[18].高盐环境造成土壤渗透压较高,细胞酶活性以及生命活动受到抑制,也会导致其数量较低.

表1 辽河口湿地各站位主要环境因子Table 1 Main environmental factors in the sampling sites of Liaohe estuary weland
石油是辽河口湿地一种典型的污染物质,对于 AOB的数量分布有一定影响,但相关性不很显著(r=0.552,P>0.05).
2.3 土壤AOB群落结构及时空变化

图2 土壤样品DNA巢式扩增后获得的目的条带Fig.2 Positive bands obtained from total soil DNA by nested PCR
将辽河口湿地不同区域土壤样品提取的DNA经过巢式 PCR扩增后,获得约 500bp的AOB目的条带,结果见图2,土壤DGGE图谱见图3,聚类分析结果见图4.样性,条带信号的强弱反映菌群的相对数量,因此可以根据指纹信息确定不同样品所含有的菌群分类单元(OTU)和数量关系,即细菌的多样性信息[19].由图3结果可见,随着采样时间和地点的不同,AOB数量呈现明显的差异.
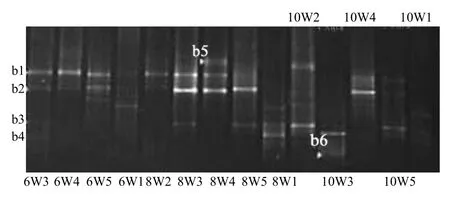
图3 16S rDNA片段DGGE指纹图谱Fig.3 DGGE profiles of 16S rDNA fragments
AOB群落结构和种类数表现出明显的时间和空间差异.不同站位在同一季节细菌种类数表现出差异,并且条带信号强弱明显,说明 AOB的相对数量也不相同;同一站位不同月份的种数也不相同,既有某些种群的消失,也有新种群的出现.b1、b2为本区域的优势菌群,除10月W3、W1站点外,其他皆有b1、b2的分布;10月除W2站点外,其余条带数明显少于8月,这可能与气温降低、土壤湿度减小及营养物质氨氮的减少等因素有关;8月各站位条带亮度明显较强,显示AOB相对数量较6月和10月多,与MPN法测得的AOB数量分布基本一致,主要与夏季气温升高等因素有关;在 8月份 W4站点出现了新的种群b5,W1站点的b3、b4条带亮度明显大于其他月份,表明辽河口湿地的硝化细菌群落结构随时间和空间的不同存在明显差异(图3).
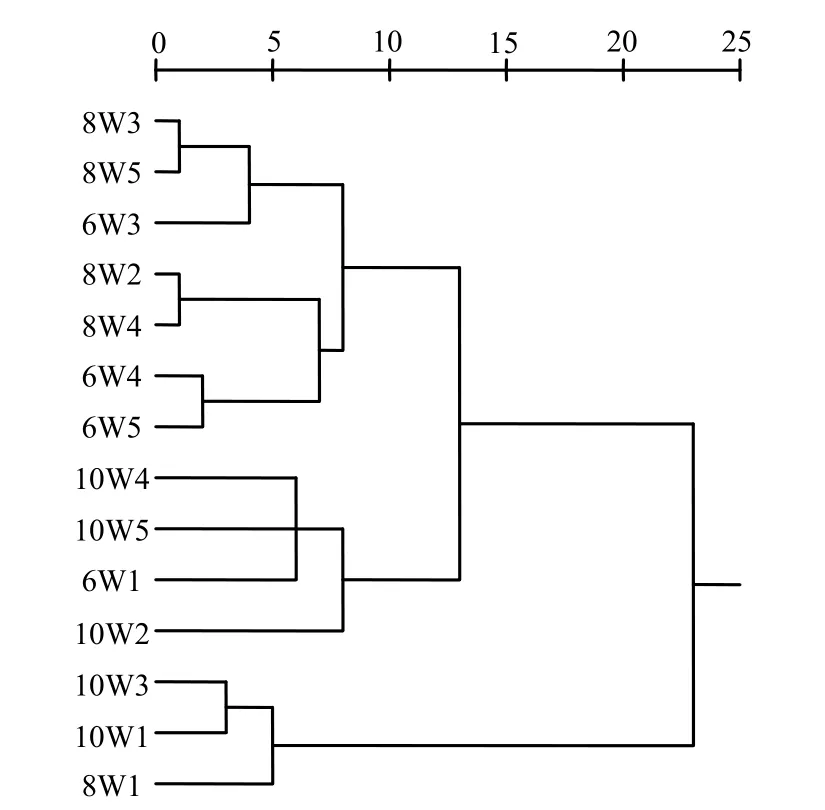
图4 AOB菌群的DGGE图谱UPGMA聚类分析Fig.4 UPGMA cluster analysis of DGGE profiles
不同站位不同月份的AOB种群相似性有所不同,总体分为3大族,同一地理区域不同时间的AOB菌群的相似性值较低,而同一月份不同地理空间的菌群的相似性较高,其中,8月的W3和W5站位,W2和W4站点之间具有很高的相似性,相似度接近98%;6月的W4和W5站位之间也几乎达到95%(图4),这与Cébron等[20]的研究结果不同,Cébron对塞纳河的水体进行研究,指出即使温度在不同的季节间变化剧烈,AOB群落结构仍保持时间的稳定性;Roey等[21]对一个沙漠中季节性河流研究也发现,以时间为尺度,AOB种群多样性类型在大部分情况下是稳定的,只是在不同季节间检测到很小的变化;这说明不同纬度带不同介质中 AOB种群变化规律不同.辽河口湿地不仅气温变化剧烈,而且土壤含水率、营养状况等土壤理化性质随季节也在剧烈地变化,导致同一区域AOB种群相似性随季节发生较大变化;可见,不同生态环境土壤中 AOB相似性有较大差别,在含盐量较高的辽河口湿地,其植被的不同生长期环境条件变化很大,对 AOB群落结构的影响也较大,表明 AOB在不同季节的生态作用有所不同.
图 5为各站位 DGGE图谱的 Shannon-Weiner指数H′,由下式计算:
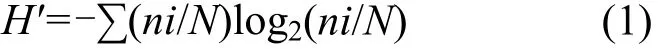
式中:H′为多样性指数;ni为第 i个 OTU的个数;ni/N第i个OTU的个数占文库序列的百分数.
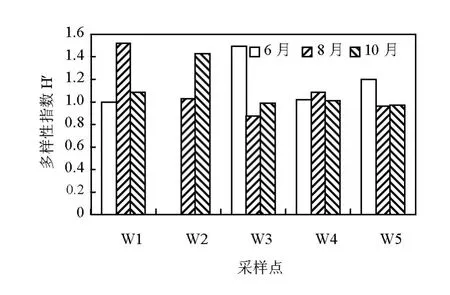
图5 6、8和10三个月份各个站点AOB菌群的多样性指数分布Fig.5 Diversity index of AOB at sampling sites in June,August and October
从图5中可以看出,其多样性指数在不同月份存在明显变化,可见植被生长状态对 AOB种群的多样性有明显影响.8月,芦苇未退化区以及人工恢复较好区的AOB多样性指数均大于其他区域,原因能与植物根际分泌物对微生物种群多样性产生的影响有关.有研究发现,根际微生物种群多样性减少是普遍现象,植物根系分泌物的不同成分控制了微生物种群数量[22].此外可能跟土
壤中氧气受限有关,实地调查发现,8月芦苇湿地处于淹水状态,上覆水阻断了空气中氧向沉积物的扩散,致使无植被生长区和植被生长较差区域的好氧性 AOB种群多样性和数量都大大下降,而植被生长较好区域则通过植被的光合作用泌氧并传导到土壤中,而8月中旬以后,此区域降雨量减少,芦苇湿地上覆水逐渐退去,土壤通气状况的改善及总氮含量的恢复,为 AOB种群多样性的增加提供可能.芦苇生长较好的W1样点,6月AOB种群多样均小于8月,与硝化菌群最适宜在25~30℃生长繁殖有关[23],且 6月总氮含量普遍高于8月,不同月份土壤含水率也有较大差别,这对于AOB种群多样性都有一定影响.
3 结论
3.1 河口湿地生态功能的完全恢复滞后于生态结构的恢复,影响 AOB数量的主要因素是植被状态、土壤可溶性盐分、有机质和总氮含量.
3.2 AOB群落多样性指数在时间和空间上存在明显差异,植被状态和环境条件是影响 AOB群落多样性的主要因素.
3.3 植被的生长期环境条件对 AOB群落结构的影响较大.
[1] Vitousek P M, Howarth R W. Nitrogen limitation on land and in the sea: how can it occur? [J] Biogeochemistry, 1991,13:87-115.
[2] 孙志高,刘景双.三江平原典型小叶章湿地土壤氮素净矿化与硝化作用 [J]. 应用生态学报, 2007,18(8):1771-1777.
[3] Bock E, Wagner M. Oxidation of inorganic nitrogen compounds as an energy source [M]//. The prokaryotes. New York: Springer., 2006:457-495.
[4] Regan J M, Harrington G W, Noguera D R. Ammonia-and nitrite-oxidizing bacterial communities in a pilot-scale chloraminated drinking water distribution system [J]. Appl. Envrion. Microbiol., 2002,68(1):73-81.
[5] 马鸣超,姜 昕,李 俊,等.人工快速渗滤系统中硝化菌群脱氮作用解析 [J]. 中国环境科学,2008,28(4):350-354.
[6] 王 凌,李秀珍,郭笃发.辽河三角洲土地利用变化及其影响 [J].山东师范大学学报(自然科学版), 2003,18(3):43-173.
[7] Meynell G G, Meynell E. Theory and practice of experimental bacteriology [M]. Cambridge: Cambridge University Press,1965, 204-209.
[8] 鲍士旦.土壤农化分析 [M]. 北京:中国农业出版社, 2000.
[9] 土壤理化分析.中国科学院南京土壤研究所 [M]. 上海:上海科学技术出版社, 1978.
[10] GB17387.5-1998 海洋监测规范 第5部分沉积物分析 [S].
[11] Wllmotte A, Vanderauwera G D E, Wachter R. Structure of the 16S ribos-omal RNA of the thermophilic cynobacterium Chlorogloeopsis HTF('Mastigocladus la-minosus HTF') strain PCC7518, and phylogenetic analysis [J]. FEBS Letters, 1993,317: 96-100.
[12] Song Y N, Mrschner.P, Li L, et a1. Community composition of ammonia-oxidizing bacteria in the rhizosphere of in tercropped wheat (Triticum aestivum L), maize(Zea mays L) and faba bean (Viciafaba L) [J]. Biol. Feril.Soils, 2007,44(2):307-314.
[13] Lutz B, Ralf K, Klaus B B. Temperature and moisture effects on nitrification rates in tropical rain-forest soils [J]. Soil Science Society of America Journal, 2002,66(3):824-844.
[14] 张虎成,俞穆清,田 卫,等.人工湿地生态系统中氮的净化机理及其影响因素研究进展 [J]. 干旱区资源与环境, 2004,18(4): 163-168.
[15] 赵化德,姚子伟,关道明.河口区域反硝化作用研究进展 [J]. 海洋环境科学, 2007,26(3):296-300.
[16] 吕国红,周广胜,周 莉,等.盘锦湿地芦苇群落土壤碱解氮及溶解性有机碳季节动态 [J]. 气象与环境学报, 2006,22(4):59-63. [17] 袁可能.植物营养元素的土壤化学 [M]. 北京:科学出版社, 1983.
[18] 黄明勇,杨剑芳,王怀锋.天津滨海盐碱土地区城市绿地土壤微生物特性研究 [J]. 土壤通报, 2007,38(6):1131-1135.
[19] 赵兴青,杨柳燕, 陈 灿,等. PCR-DGGE技术用于湖泊沉积物中微生物群落结构的多样性研究 [J]. 生态学报, 2006,26(11): 1316-1322.
[20] Cébron A, Oci M, Garnier J, et a1. Denaturing gradient gel electrophoretic analysis of ammonia-oxidizing bacterial community structure in the lower Seine River: impact of Paris wastewater effluents [J]. Appl. Environ. Microbiol., 2004,70: 6726-6737.
[21] Roey A, Lior A, Zeev R, et al. Nitrogen Transformations and diversity of ammonia-oxidizing bacteria in a desert ephemeral stream receiving untreated wastewater [J]. Microb. Ecol., 2010, 59:46-58.
[22] 贺永华,沈东升,朱荫湄.根系分泌物及其根际效应 [J]. 科技通报, 2006,22(6):761-766.
[23] 马 俊,张永祥,刘 亮,等. A2/O脱氮工艺效果研究 [J]. 哈尔滨商业大学报, 2006,22(1):28-31.
Characteristics of temporal and spatial distribution of ammonia-oxidizing bacteria in Liaohe Estuary wetland soil.
BAI Jie1,2, DONG Xiao1, ZHAO Yang-Guo1,2*(1.College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100, China;2.Key Laboratory of Marine Environmental Science and Ecology,Ministry of Education, Qingdao 266100, China). China Environmental Science, 2011,31(11):1870~1874
The nitrification from ammonia to nitrate is a rate-limiting step mediated by ammonia-oxidizing bacteria (AOB). The abundances and diversity of AOB in the soil of reed wetland of Liaohe Estuary were investigated by the most probable number (MPN) method and the denaturing gradient gel electrophoresis (DGGE) technique,and the relationship between AOB abundances and environmental factors, such as soluble salt, was further explored. The results indicated that the temporal and spatial distribution of the AOB diversity was different, and the bacterial community on the different sites was more similar in same month. The quantity of AOB and the concentration of soluble salt presented notable negative correlation(P<0.05), while the quantity of AOB and soil total nitrogen and organ matter presented a significant positive correlation (P<0.01). It concluded that the soluble salt, soil total nitrogen and orgaic matter had an important influence on the quantity of AOB in Liaohe Estuary wetland.
Liaohe Estuary wetland;ammonia-oxidizing bacteria (AOB);soluble salt;organic matter;total nitrogen
X172
A
1000-6923(2011)11-1870-05
2011-01-30
国家水体污染控制与治理科技重大专项(2008ZX07208-009)
* 责任作者, 教授, baijie@ouc.edu.cn
作者简价:白 洁(1962-),女,陕西神木人,教授,硕士,主要从事微生物生态学研究.发表论文50余篇.

