尼罗罗非鱼Orexin前体基因的克隆、组织分布及其在摄食调控中的表达
陈文波 , 王 鑫, 周雅璐 董海燕 , 林浩然 李文笙*
(1. 中山大学 有害生物控制与资源利用国家重点实验室 水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室, 广东 广州 510275;2. 河南理工大学 资源环境学院生物系, 河南 焦作 454000)
尼罗罗非鱼Orexin前体基因的克隆、组织分布及其在摄食调控中的表达
陈文波1,2,#, 王 鑫1,#, 周雅璐1, 董海燕1, 林浩然1, 李文笙1,*
(1. 中山大学 有害生物控制与资源利用国家重点实验室 水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室, 广东 广州 510275;2. 河南理工大学 资源环境学院生物系, 河南 焦作 454000)
该文采用RT-PCR和cDNA末端快速扩增技术(rapid-amplification of cDNA ends, RACE)的方法, 从尼罗罗非鱼(Oreochromis niloticus)下丘脑总RNA中获得了尼罗罗非鱼Orexin前体基因的cDNA全长序列。该 cDNA全长648 bp, 其中开放阅读框的长423 bp,编码Orexin前体蛋白为140个氨基酸, 包括37个氨基酸的信号肽、43个氨基酸的Orexin-A、28个氨基酸的Orexin-B和末尾32个氨基酸组成的功能不详的多肽。采用Real-time PCR 技术对尼罗罗非鱼Orexin前体基因的组织表达模式以及在摄食前后、饥饿和再投喂状态下的表达量变化进行了研究。 结果显示, 在脑部和外周等18个组织中都检测到了Orexin前体基因的表达, 其中在下丘脑中表达量最高; 在摄食前后, 尼罗罗非鱼Orexin前体基因的表达量显著低于在摄食状态中; 饥饿2、4、6和8 d后,Orexin前体基因在下丘脑中的表达量与正常投喂组相比均显著升高, 饥饿4 d再投喂后,表达量又恢复至正常水平。这些结果表明, Orexin在尼罗罗非鱼摄食中可能有着重要的调节作用。
尼罗罗非鱼;Orexin; 克隆; 表达; 摄食
鱼类摄食和食欲的调节与其他脊椎动物类似,也有一个极其复杂的机制, 包含脑和外周组织信号的精细互作(Volkoff et al, 2005)。Orexin由Sakurai等在1998年发现,是与G蛋白偶联的重要神经肽,包括 Orexin-A 和 Orexin-B(也称为 hypocretin-I和hypocretin-II) 两种。它们是同一种蛋白前体的水解产物, 以其有促进摄食作用而得名。Orexin被认为是G蛋白偶联的细胞表面受体的配体, 也有人认为具有促进摄食的功能(de Lecea et al, 1998; Sakurai et al, 1998)。Orexin-A和 Orexin-B均来自同一前体-Orexin原, 经蛋白水解而成(Sakurai et al, 1998)。最初用放免法分析发现, Orexin大量分布在下丘脑、延髓、脑桥和中脑, 大脑皮层中也含有, 而内脏器官和脂肪组织则无。随着研究的不断深入, 发现Orexin的分布更为广泛, 生理功能也多种多样。Orexin通过其受体发挥作用, 参与机体摄食、能量稳态、体温、睡眠、觉醒周期、生殖、内脏活动和内分泌等方面的调节(Adamantidis & de Lecea, 2008;Matsuki & Sakurai, 2008)。Sakurai et al(1998)也克隆到两种 Orexin受体:Orexin-1 受体(OX1R)和Orexin-2 受体(OX2R)。前者特异性地与 Orexin-A结合; 后者则对Orexin-A和Orexin-B没有选择性。
目前对 Orexin的研究还主要集中在小鼠等哺乳动物, 近几年来才开始对鱼类进行研究。目前只在斜带石斑鱼(Epinephelus coioides) (Zhang, 2006)、金鱼(Carassius auratus)(Miura et al, 2007)、大西洋鳕鱼(Gadus morhus)(Xu & Volkoff, 2007)和冬鲽(Pleuronectes americanus)(Buckley et al, 2010)中成功克隆出来Orexin前体基因。斑马鱼(Danio rerio)(Kaslin et al, 2004; Faraco et al, 2006)、青锵(Oryzias latipes) (Faraco et al, 2006)、河豚(Takifugu rubripes) (Faraco et al, 2006)等几种模式生物凭借其全基因组序列已被测定的优势,也已被预测出了Orexin序列。同时, 对Orexin摄食调控的研究也仅仅集中于金鱼(Volkoff et al, 1999; Volkoff et al, 2003;Miura et al, 2007)。截至目前, 对养殖经济鱼类摄食调控的研究还鲜有报道。
鉴于 Orexin在摄食调控中的重要作用以及尼罗罗非鱼的重要经济价值, 本文从尼罗罗非鱼下丘脑中成功克隆出Orexin前体基因的cDNA序列, 并对其组织分布模式以及在摄食调控中的表达情况进行了研究。这将对进一步阐明鱼类摄食调控的分子机理提供理论依据, 为研制可应用于生产的促进鱼类摄食和生长的新产品打下基础。
1 材料与方法
1.1 材料与试剂
试验用尼罗罗非鱼, 均来自广东省国家级罗非鱼良种场(广州番禺)。克隆和组织表达所用罗非鱼体重约500 g, 带回实验室, 冰上麻醉, 迅速分离出各脑分区及外周等18个组织, 用DEPC水快速洗去残留血液, 立即装入1.5 mL离心管中, 液氮速冻,然后转入−80 ℃保存备用。
各生理实验中所用罗非鱼平均体重为(73.32±3.54) g, 平均体长为(15.65±1.45) cm, 实验鱼以18~20 ℃循环过滤水饲养, 正常日光。每天中午12:00准时投喂1.5% BW的饲料, 饲料购自中山统一企业有限公司, 实验前至少驯养2周。
Trizol Reagent 、DNase I、SuperScript IIITMRT-PCR 试剂盒、Real-time PCR试剂盒Platinum®SYBR®Green qPCR SuperMix-UDG购自Invitrogen(USA)公司; E.Z.N.A 质粒提取和胶回收试剂盒为Omega 公司产品; Ins/AcloneTMPCR Product Cloning Kit 载体连接试剂盒、Taq DNA Polymerase、RevertAidTMH Minus M-MuLV reverse transcriptase kit 购自 Fermentas(USA)公司; PCR所用引物由上海英俊生物技术有限公司合成; 其余均为国产分析纯试剂。大肠杆菌(Escherichia coli) DH5α 由本实验室保存。
1.2 方法
1.2.1 引物 根据 NCBI GenBank 中已登录的哺乳动物、鸡、大西洋鳕鱼、斑马鱼等物种的Orexin前体基因的cDNA序列保守区域, 设计一套用于扩增中间片段的简并引物, 共有两条上游引物(P1和P2)和一条下游引物(P3)。引物序列见表1。
1.2.2 尼罗罗非鱼Orexin前体基因的 cDNA克隆用Trizol法提取尼罗罗非鱼下丘脑总RNA, 260 nm下的吸光值衡量RNA的浓度, 然后用0.8%琼脂糖凝胶, 通过28S和18S条带的亮度来确定总RNA完整性。按照Invitrogen SuperScript III RT-PCR试剂盒说明书合成cDNA第一链。扩增中间片段时, 第一轮以P1和P2为引物。 PCR 反应程序为94℃预变性3 min , 然后94 ℃变性30 s, 55 ℃退火30 s , 72 ℃延伸 30 s, 40个循环后 72 ℃延伸 10 min。第一轮PCR产物稀释100倍作为模板, 进行第二轮巢式PCR(Nested PCR), 引物为P2和P3, 反应程序同上。

表1 用于尼罗罗非鱼Orexin前体基因cDNA克隆和定量PCR所需引物序列Tab. 1 Nucleotide sequences of the primers used for the cDNA of tilapia prepro-orexin and real-time PCR
根据所获得中间片段序列设计特异引物(F1、F2、R1和 R2), 结合RACE试剂盒接头引物 AAP和 AUAP, 进行 3′-RACE 和 5′-RACE 扩增。将扩增得到的 PCR产物在 1.5%琼脂糖凝胶上电泳分离DNA片段, 并在紫外光下回收目的条带。用E.Z.N.A胶回收试剂盒纯化目的产物, 然后亚克隆到PTZ57R/T载体上, 挑选阳性克隆并进行测序。
1.2.3 序列分析 将所获得的3个片段用DNAssist 2.0软件进行拼接。用DNAtools 6.0对开放阅读框进行分析并翻译成蛋白质。运用 SignalP3.0 Server(http://www.cbs.dtu.dk/service/SignalP)进行信号肽的预测。运用 Clustalx1.83软件对多个物种Orexin前体氨基酸序列进行比对, 并用DNAstar软件对各序列的同源性进行计算。运用Mega3.1软件,采用Neighbor-Joining法构建脊椎动物Orexin前体蛋白的系统进化树。
1.2.4 尼罗罗非鱼Orexin前体基因的组织表达分析 提取下丘脑(hypothalamus)、垂体(pituitary)、嗅球(olfactory bulb)、脊髓(spinal cord)、端脑(telencephalon)、小脑(cerebellum)、中脑(optic tectum)、延脑(medulla oblongate)、肝脏(liver)、肾脏(kindey)、脾脏(spleen)、脂肪(fat)、头肾(head kindey)、肌肉(muscle)、胃(stomach)、肠(gut)、心脏(heart)和鳃(gill)等 18个组织总 RNA, 经 DNase I处理后, 按照《RevertAidTMH Minus M-MuLV reverse transcriptase kit》说明书, 用1 μg RNA 进行反转录。将反转录产物稀释10倍作为Real-time PCR反应的cDNA模板, 参照《Platinum® SYBR® Green qPCR SuperMix-UDG试剂盒》说明书准备反应体系。Real-time PCR所涉及的引物设计、质粒的浓度梯度制备以及具体测定方法参照Chen et al (2009)进行, 具体反应程序如下:首先50 ℃反应2 min, 紧接着95 ℃ 预变性3 min, 然后95 ℃预变性30 s, 55 ℃ 退火30 s, 72 ℃延伸30 s, 共进行40个循环, 最后进行溶解曲线分析, 以确定PCR扩增产物特异性。为保证结果的可信性, 进行定量PCR反应时每个样品设置三个平行。
1.2.5 尼罗罗非鱼Orexin前体基因在摄食前后的表达分析 实验开始前, 所有实验鱼在实验条件下驯养2周。按照下列时间点对正常喂养下的罗非鱼进行下丘脑取样:摄食前2 h (-2 h)、摄食前1 h (-1 h)、摄食中 (0 h)、摄食后1 h (+1 h)和摄食后2 h (+2 h), 每个时间点取8~10条鱼, 取样、RNA提取及定量PCR操作参照前面1.2.4节方法。
1.2.6 饥饿和再投喂对尼罗罗非鱼Orexin前体基因的表达影响 大约100条实验鱼分成3组:第一组正常投喂组; 第二组饥饿组; 第三组先饥饿 4 d,从第四天开始投喂。实验鱼经过2周的驯养后进行实验饥饿处理, 分别在处理后第2、4、6和8天取样, 取样时间为投喂后4 h。下丘脑取样、RNA提取及定量PCR操作参照前面1.2.4节方法。
1.2.7 数据分析 分别以含有Orexin和18SrRNA基因片段的质粒浓度梯度所对应的 CT值和质粒浓度的负对数值为坐标, 做出标准曲线。将不同样品中Orexin和18SrRNA基因的表达量所对应的CT值与标准曲线相对照, 即可得到该样品所测基因表达量的相对浓度值, 最后以目的基因同内参基因的比值来表示目的基因的相对表达量(target gene/18SrRNA)。
所有数据用平均值±标准差(Means±SEM)来表示。采用SPSS13.0 (SPSS, Chicago, IL, USA)软件来分析数据, 用Duncan's multiple range test来检测统计差异, 当P<0.05认为差异显著。
2 结 果
2.1 尼罗罗非鱼Orexin的cDNA序列及特征
以尼罗罗非鱼下丘脑总 RNA为模板, 采用RT-PCR和RACE方法成功克隆出Orexin前体基因cDNA (此序列在 GenBank 数据库的登录号为:FJ871159)。该cDNA全长648 bp, 其中 5′ 非编码区长29 bp, 开放读码框423 bp, 3' 非编码区长196 bp (图1)。计算出:尼罗罗非鱼Orexin 前体蛋白为140 个氨基酸, 其中包括 37 个氨基酸的信号肽、43 个氨基酸的Orexin-A、28 个氨基酸的 Orexin-B和末尾 32个氨基酸组成的功能不详的多肽。
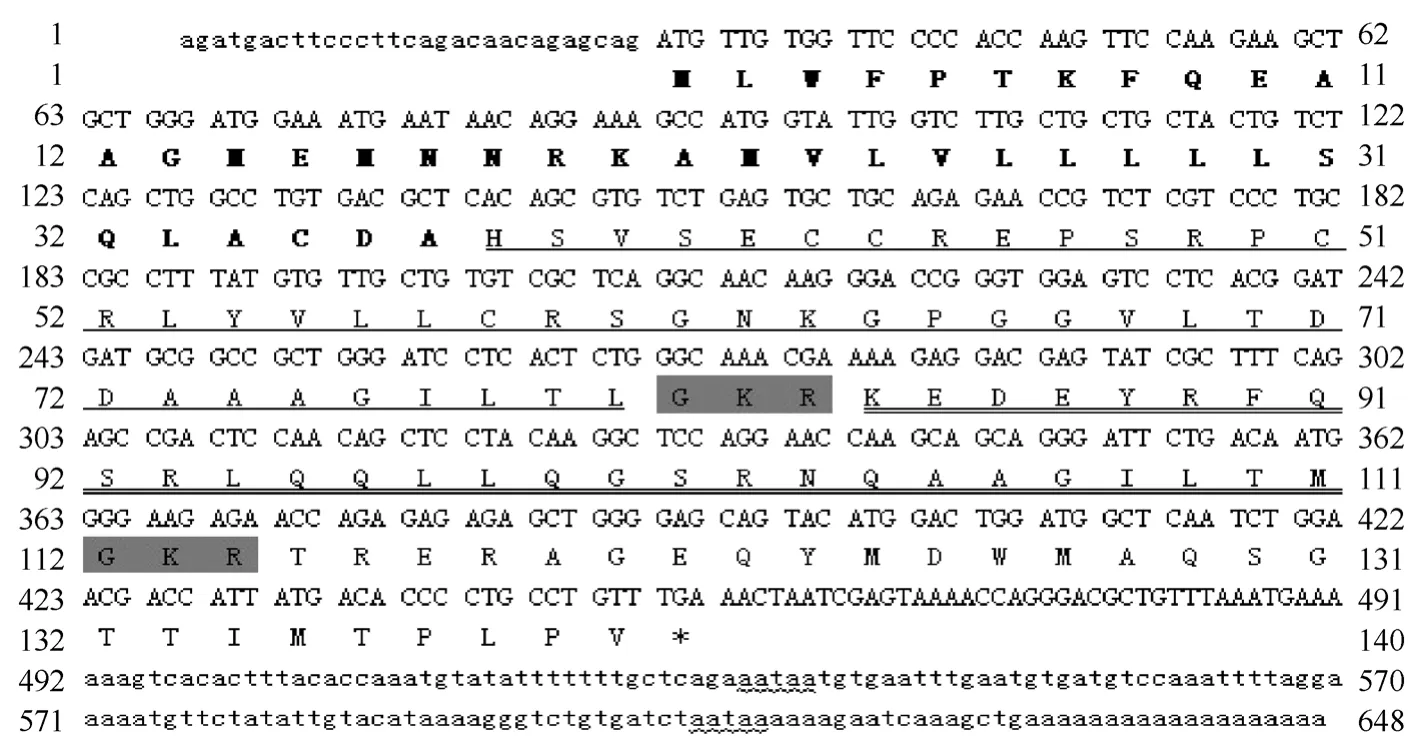
图1 尼罗罗非鱼Orexin前体的全长cDNA序列和推导的氨基酸序列Fig. 1 The full-length cDNA sequence and deduced amino acid sequence of the tilapia prepro-orexin
为了分析 Orexin前体蛋白的结构特征, 运用Clustalx1.83软件对尼罗罗非鱼Orexin前体蛋白与其他物种进行了比对(图2)。结果显示, 分别存在于Orexin-A和 Orexin-B末端的两个保守切割位点GKR 和GRR在罗非鱼中同样保守。与其他脊椎动物一样, 尼罗罗非鱼Orexin-A中同样存在四个半胱氨酸(Cys), 但是与哺乳动物不同的是它们所处的位置略有差异。在罗非鱼中四个半胱氨酸的位置分别是Cys6、Cys7 、Cys14和Cys21, 而在哺乳动物中则分别是 Cys6、Cys7 、Cys12 和 Cys14。另外, 罗非鱼Orexin前体蛋白与其他物种一样, OrexinB的保守度要高于Orexin-A的保守度。同时, Orexin-B后的多肽部分氨基酸变异则较大。

图2 尼罗罗非鱼与其他物种Orexin 前体蛋白的序列比对Fig. 2 Alignment of the amino acid sequences of prepro-orexin among tilapia and other vertebrates
运用DNAStar软件包中的MegAlign子软件计算尼罗罗非鱼 Orexin前体蛋白与其他物种的同源百分比, 结果显示尼罗罗非鱼Orexin-A与fugu同源性最高为 81.1%, 而与其他物种则较低, 均在36.4%~69.8%之间; Orexin-B的同源性也是与fugu的同源性最高为 78.6%, 与其他物种的同源性则在53.6%~75%之间。进一步应用Mega 3.1 软件构建Orexin 前体蛋白系统进化树(图3)。由进化树可见,Orexin前体蛋白共分为两大支, 尼罗罗非鱼Orexin前体蛋白位于硬骨鱼类这一分支上, 且与青锵、河豚、大西洋鳕鱼的关系较近; 与鲤形目(斑马鱼和金鱼)关系次之; 与哺乳动物的关系最远。这与同源性分析的结果相一致。
2.2 尼罗罗非鱼Orexin前体基因的组织表达
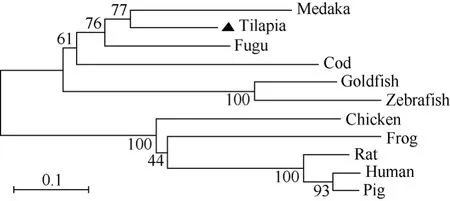
图3 脊椎动物Orexin前体蛋白的进化树分析Fig. 3 Phylogenetic tree based upon the alignment of amino acid sequences of vertebrates prepro-orexins
运用 Real-time PCR分别检测尼罗罗非鱼Orexin前体基因在18个组织中的表达量, 结果显示,尼罗罗非鱼Orexin前体基因分布广泛, 在18种组织中均不同程度的检测到其表达(图4)。Orexin前体基因在脑中的表达量较高, 其中在下丘脑有最高表达量, 远远高于在其他组织中的表达水平。在外周组织中Orexin前体基因的表达量则相对较低, 其中以肝脏和肌肉中为最高; 其次是胃和心脏; 而在肠中的表达量为最低。

图4 尼罗罗非鱼Orexin 前体基因在不同组织中的表达Fig. 4 Expression of tilapia prepro-orexin mRNA in a variety of tissues
2.3 摄食前后的尼罗罗非鱼 Orexin前体基因在下丘脑中的表达影响
运用Real-time PCR对尼罗罗非鱼摄食前后5个时间点Orexin前体基因的表达量分别进行检测,结果显示与摄食中的Orexin前体基因表达量相比,摄食前2 h和1 h与摄食后1 h和2 h,Orexin前体基因表达量均显著降低(P<0.05), 表达量均为摄食状态下的50%~70%(图5)。同时, 从图中可以看出随着摄食时间点的临近,Orexin前体基因的表达量逐渐升高, 在摄食中达到最大值。
2.4 饥饿和再投喂对尼罗罗非鱼 Orexin前体基因的表达影响
在饥饿和再投喂实验中, 把正常组的表达量设为1, 其余组均与正常组相比较, 结果如图6。尼罗罗非鱼分别饥饿2、4、6和8 d后,Orexin前体基因在下丘脑的表达量与正常投喂组相比均显著升高(P<0.05), 其中饥饿4 d后的表达量达到最高, 为正常投喂的2.2倍左右; 同时, 饥饿恢复组在饥饿4 d重新恢复投喂4 h后,Orexin前体mRNA 表达量又恢复至正常水平。

图5 尼罗罗非鱼Orexin前体基因在下丘脑中随摄食时间的表达量变化Fig. 5 Peri-prandial changes in tilapia prepro-orexin mRNA expression in hypothalamus

图6 饥饿和再投喂对尼罗罗非鱼Orexin前体基因的表达的效应Fig. 6 Effects of fed and refeeding on the expression of tilapia prepro-orexin mRNA in hypothalamus
3 讨 论
本研究运用RT-PCR和RACE技术, 从尼罗罗非鱼下丘脑反转录产物克隆得到了全长为 648 bp的Orexin前体cDNA序列。开放读码框为423 bp,编码140 个氨基酸组成的Orexin 前体蛋白, 含有43个氨基酸的Orexin-A和28 个氨基酸的Orexin-B。同源性分析表明, 在哺乳类和鸡中Orexin-A之间的同源性高于 Orexin-B, 而在硬骨鱼类中这一结果则相反。Xu & Volkoff (2007)认为在硬骨鱼类中Orexin-A的同源性降低与插入的十几个氨基酸变异程度较大有关。我们的氨基酸序列比对结果也证实了这一解释(见图2), 与哺乳类和鸡相比, 硬骨鱼类Orexin-A插入了12~16个氨基酸(位于哺乳动物Orexin-A的第24与第25个氨基酸之间), 且这些氨基酸序列上没有同源性。Kane et al (2000)研究发现, 人Orexin-A和Orexin-B的结构类似, 都能够结合其受体。尽管Alvarez & Sutcliffe(2002)认为这一间隔序列对于 Orexin-A的活性来说可能并不是必要的, 但这些氨基酸的存在对其结构是否有一定的改变, 它们的存在有何意义, 还需要进一步研究。
在哺乳类和鸡Orexin-A中存在4个位置保守的半胱氨酸(Cys6、Cys7、Cys12和Cys14), 形成两个内部二硫键(Cys6-Cys12 和 Cys7-Cys14)维持Orexin-A的稳定性和生理功能(Ohno & Sakurai,2008)。然而, 包含尼罗罗非鱼在内的硬骨鱼类中这4个半胱氨酸的位置只有3个是保守的(Cys6、Cys7和 Cys14), 另外一个半胱氨酸(Cys12)位于罗非鱼Orexin-A的第21位氨基酸。尽管位置不保守, 但仍可能形成两个二硫键。与Orexin-A相比, Orexin-B不含半胱氨酸, 无法形成二硫键, 这可能是Orexin-A促进摄食的作用持续时间长于 Orexin-B的原因之一(Tan et al, 2004)。
本文通过定量PCR发现,Orexin前体基因在尼罗罗非鱼脑部特别是下丘脑有较高的表达量, 这与其他物种的研究结果相一致。下丘脑外侧区是经典的摄食中枢,Orexin前体mRNA在下丘脑中的表达,说明Orexin有可能参与摄食和能量平衡的调节, 同时也说明Orexin在种系发生上具有一定保守性。在被检测的尼罗罗非鱼 10种外周组织中也有不同程度Orexin前体基因的表达, 这一结果与在其他物种中的表达模式略有不同。在大西洋鳕鱼鳃、皮肤、肾、脾、小肠中检测到少量Orexin前体基因的表达,但在心脏、肝脏里未见表达(Xu & Volkoff, 2007)。在斑马鱼心脏、鳃中检测到Orexin前体基因的表达,而在肝脏、肠及肌肉中均未发现(Kaslin et al, 2004)。在啮齿动物中目前仅在脑和心脏中有报道(Johren et al, 2001; Caillol et al, 2003), 但通过放免方法在猪肠和胰腺中检测到 Orexin-A的分布(Dyer et al,1999; Kirchgessner & Liu, 1999; Kirchgessner,2002)。这些结果表明,Orexin前体基因在物种间的表达可能存在一定的差异, 同时,Orexin前体基因在尼罗罗非鱼各组织中的广泛表达表明其在体内可能扮演着多种生理功能, 但具体功能模式和作用机制还需要进一步研究。
我们的结果还显示在摄食状态中尼罗罗非鱼Orexin前体基因的表达量较之摄食前和摄食后均有显著性提高, 并且随着摄食时间的临近表达量逐渐升高, 这和在大西洋鳕鱼中的研究结果相一致(Xu& Volkoff, 2007)。之前的研究报道也发现其他调节食欲的多肽, 如NPY(Kehoe & Volkoff, 2007)、ghrelin(Unniappan et al, 2004)、CART (Volkoff & Peter,2001)等的表达量也随着摄食状态的变化而变化。这些结果预示着 Orexin可能作为一个摄食信号参与到了尼罗罗非鱼的摄食调控。另外, 摄食1 h和2 h后Orexin的表达量随之又显著降低, 这也表明Orexin可能并不参与摄食后的消化过程, 仅仅是食欲的刺激者。饥饿实验中, 饥饿不同时间后Orexin的表达量与正常投喂组相比均显著升高, 这进一步证实了Orexin与罗非鱼的摄食调控密切相关。同时,饥饿恢复组在饥饿4 d重新投喂4 h后,Orexin前体mRNA 表达量又恢复至正常水平, 这预示着Orexin对摄食的调控可能属于一种短期的的机制。尽管目前在鱼类中还没有有关饥饿对Orexin基因表达影响的报道, 但是Orexin基因表达对饥饿这一生理状态的响应与其他摄食刺激因子是一致的, 例如NPY (Kehoe & Volkoff, 2007)和ghrelin (Unniappan et al, 2004); 相反, 相关抑制摄食的因子则在饥饿状态下表达量下降(Volkoff et al, 2005; Kehoe &Volkoff, 2007)。这些结果表明, Orexin在尼罗罗非鱼摄食调控中可能有着重要的促进作用。
总之, 本文首次克隆了尼罗罗非鱼的Orexin前体基因序列并对其结构和表达模式进行了研究。尼罗罗非鱼在下丘脑有最大表达量, 这与其他脊椎动物类似; 同时, 在被检测的10种外周组织中也有不同程度Orexin前体基因的表达, 这一结果与在其他物种中的表达模式略有不同。随后, 摄食和饥饿实验表明,Orexin前体基因mRNA表达量在摄食后显著降低, 同时饥饿处理后其表达量显著升高, 这些结果预示着 Orexin可能是以食欲的刺激者的角色参与到鱼类的摄食调控之中。但是, Orexin刺激鱼类摄食的具体调控机制还需要进一步深入研究。
Adamantidis A, de Lecea L. 2008. Physiological arousal: A role for hypothalamic systems[J].Cell Mol Life Sci,65(10): 1475-1488.
Alvarez CE, Sutcliffe JG. 2002. Hypocretin is an early member of the incretin gene family[J].Neurosci Lett,324(3): 169-172.
Buckley C, MacDonalda EE, Tuziaka SM, Volkoff H. 2010. Molecular cloning and characterization of two putative appetite regulators in winter flounder (Pleuronectes americanus): Preprothyrotropin-releasing hormone (TRH) and prepro-orexin (OX)[J].Peptides, 2010, 31(9):1737-1747.
Caillol M, Aioun J, Baly C, Persuy MA, Salesse R. 2003. Localization of orexins and their receptors in the rat olfactory system: Possible modulation of olfactory perception by a neuropeptide synthetized centrally or locally[J].Brain Res,960(1-2): 48-61.
Chen WB, Li WS, Lin HR. 2009. Common carp (Cyprinus carpio)insulin-like growth factor binding protein-2 (IGFBP-2): molecular cloning, expression profiles, and hormonal regulation in hepatocytes[J].Gen Comp Endocrinol,161(3): 390-399.
Dyer CJ, Touchette KJ, Carroll JA, Allee GL, Matteri RL. 1999. Cloning of porcine prepro-orexin cDNA and effects of an intramuscular injection of synthetic porcine Orexin-B on feed intake in young pigs[J].Domest Anim Endocrinol,16(3): 145-148.
de Lecea L, Kilduff TS, Peyron C, Gao X, Foye PE, Danielson PE,Fukuhara C, Battenberg EL, Gautvik VT, Bartlett FS, 2nd, Frankel WN,van den Pol AN, Bloom FE, Gautvik KM, Sutcliffe JG. 1998. The hypocretins:hypothalamus-specific peptides with neuroexcitatory activity[J].Proc Natl Acad Sci USA,95(1): 322-327.
Faraco JH, Appelbaum L, Marin W, Gaus SE, Mourrain P, Mignot E. 2006.Regulation of hypocretin (Orexin) expression in embryonic zebrafish[J].J Biol Chem,281(40): 29753-29761.
Johren O, Neidert SJ, Kummer M, Dendorfer A, Dominiak P. 2001.Prepro-orexin and orexin receptor mRNAs are differentially expressed in peripheral tissues of male and female rats[J].Endocrinology,142(8):3324-3331.
Kane JK, Parker SL, Matta SG, Fu Y, Sharp BM, Li MD. 2000. Nicotine up-regulates expression of orexin and its receptors in rat brain[J].Endocrinology,141(10): 3623-3629.
Kaslin J, Nystedt JM, Ostergard M, Peitsaro N, Panula P. 2004. The orexin/hypocretin system in zebrafish is connected to the aminergic and cholinergic systems[J].J Neurosci,24(11): 2678-2689.
Kirchgessner AL. 2002. Orexins in the brain-gut axis[J].Endocr Rev,23(1):1-15.
Kirchgessner AL, Liu M. 1999. Orexin synthesis and response in the gut[J].Neuron,24(4): 941-951.
Kehoe AS, Volkoff H. 2007. Cloning and characterization of neuropeptide Y(NPY) and cocaine and amphetamine regulated transcript (CART) in Atlantic cod (Gadus morhua)[J].Comp Biochem Physiol A:Mol Integr Physiol,146(3): 451-461.
Matsuki T, Sakurai T. 2008. Orexins and orexin receptors: From molecules to integrative physiology[J].Results Probl Cell Differ,46: 27-55.
Miura T, Maruyama K, Shimakura S, Kaiya H, Uchiyama M, Kangawa K,Shioda S, Matsuda K. 2007. Regulation of food intake in the goldfish by interaction between ghrelin and orexin[J].Peptides,28(6): 1207-1213.
Ohno K, Sakurai T. 2008. Orexin neuronal circuitry: role in the regulation of sleep and wakefulness[J].Front Neuroendocrinol,29(1): 70-87.
Sakurai T, Amemiya A, Ishii M, Matsuzaki I, Chemelli RM, Tanaka H,Williams SC, Richardson JA, Kozlowski GP, Wilson S, Arch JR,Buckingham RE, Haynes AC, Carr SA, Annan RS, McNulty DE, Liu WS, Terrett JA, Elshourbagy NA, Bergsma DJ, Yanagisawa M. 1998.Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J].Cell,92(4): 573-585.
Tan XM, Chen DW, Yang YF. 2004. Orexin and its physiological functions[J].Chn Feed, 14: 2-7 [谭雪梅, 陈代文, 羊云飞. 增食欲素及其生理功能. 中国饲料, 2004, 14: 2-7]
Xu M, Volkoff H. 2007. Molecular characterization of prepro-orexin in Atlantic cod (Gadus morhua): cloning, localization, developmental profile and role in food intake regulation[J].Mol Cell Endocrinol,271(1-2): 28-37.
Unniappan S, Canosa LF, Peter RE. 2004. Orexigenic actions of ghrelin in goldfish: Feeding-induced changes in brain and gut mRNA expression and serum levels, and responses to central and peripheral injections[J].Neuroendocrinology,79(2): 100-108.
Volkoff H, Canosa LF, Unniappan S, Cerda-Reverter JM, Bernier NJ, Kelly SP, Peter RE. 2005. Neuropeptides and the control of food intake in fish[J].Gen Comp Endocrinol, 142(1-2): 3-19.
Volkoff H, Peter RE. 2001. Characterization of two forms of cocaine- and amphetamine-regulated transcript (CART) peptide precursors in g488 oldfish: molecular cloning and distribution, modulation of expression by nutritional status, and interactions with leptin[J].Endocrinology,142(12): 5076-5088.
Volkoff H, Eykelbosh AJ, Peter RE. 2003. Role of leptin in the control of feeding of goldfishCarassius auratus: Interactions with cholecystokinin,neuropeptide Y and Orexin A, and modulation by fasting[J].Brain Res,972(1-2): 90-109.
Volkoff H, Bjorklund JM, Peter RE. 1999. Stimulation of feeding behavior and food consumption in the goldfish,Carassius auratus, by Orexin-A and Orexin-B[J].Brain Res,846(2): 204-209.
Zhang LJ.2006.Prepro-orexin of Orange-spotted Grouper,Epinephelus coioides: Molecular Cloning and Characteristics of mRNA Expression[D]. Guanzhou: Sun Yet-sen University.
Molecular cloning, tissue distribution and the expression in the regulation of food intake of prepro-orexin in Nile tilapia (Oreochromis niloticus)
CHEN Wen-Bo1,2,#,WANG Xin1,#,ZHOU Ya-Lu1,DONG Hai-Yan1, LIN Hao-Ran1, LI Wen-Sheng1,*
(1.State Key Laboratory of Biocontrol, Institute of Aquatic Economic Animals and Guangdong Provincial Key Laboratory for Aquatic Economic Animals,School of Life Sciences,Sun Yat-Sen University,Guangzhou510275,China; 2.Department of Biology, School of Resources and Environment,Henan Polytechnic University,Jiaozuo454000,China)
We cloned the full length of tilapia prepro-orexin cDNA using RT-PCR and rapid-amplification of cDNA ends (RACE). The full-length of prepro-orexin cDNA was 648 bp containing an open reading frame of 423 bp. The 140 amino acid prepro-orexin protein included a 37 AA signal peptide, a 43 AA Orexin-A and, and 28 AA Orexin-B and the end of the 32 AA peptide of unknown function. The expression of prepro-orexin on tissue distribution, peri-prandial changes, starvation and re-feeding were quantified by real-time PCR. We found that prepro-orexin mRNA was present in all tissues tested and that the highest level was observed in hypothalamus. Expression levels were significantly higher at mealtime (0 h) than before (−2 h, −1 h) and after (+1 h, +2 h) mealtime. Fasting for 2, 4, 6 and 8 d caused significant increases in prepro-orexin mRNA expression in the hypothalamus, and after re-feeding, expression levels of prepro-o rexin mRNA returned to the same level compared to that in the fed group.
Nile tilapia (Oreochromis niloticus);Orexin; Cloning; Expression; Food intake
Q78; Q959.483
A
0254-5853-(2011)03-0285-08
10.3724/SP.J.1141.2011.03285
2010-09-13;接受日期:2011-02-21
现代农业产业技术体系建设专项资金项目(CARS-49); 2007年公益性行业(农业)科研专项经费项目(3-49-10);“863”专题项目(2007AA10Z165)
∗通讯作者(Corresponding author),李文笙(1967—), 女, 汉族, 博士, 教授, 主要从事鱼类生理和分子生物学、神经内分泌学研究。E-mail:lsslws@mail.sysu.edu.cn
#共同第一作者, 陈文波(1982—), 男, 博士, 讲师, 从事鱼类生理学和分子生物学研究, E-mail:chenwenbo@hpu.edu.cn; 王鑫(1987—), 男, 硕士研究生
- Zoological Research的其它文章
- 白介素1β对大鼠皮层神经元钠电流的急性作用
- 中国蝴蝶鱼科一新记录种—— 多棘马夫鱼
- Effects of urethane on the response properties of visual cortical neurons in young adult and old cats
- Phylogenetic evaluation of the taxonomic status of Papilio maackii and P. syfanius (Lepidoptera: Papilionidae)
- Genetic differentiations between randomly and selectively bred pig populations in Yunnan, China
- 阿魏酸对脂多糖诱导的小鼠小胶质细胞炎性反应的抑制作用

