定性走向定量 理论付诸实践——“酸碱中和滴定”教学设计
邹晨光
(江苏省石庄高级中学 江苏 如皋 226531)
一、教材分析和设计思路
酸碱中和滴定操作简便、快捷、精确度高,具有很大的实用价值,在生产生活和科学研究中应用广泛。 是《化学反应原理》(选修四)模块中的重要内容,与必修模块中的“一定物质的量浓度溶液的配制”和选修模块的“中和反应反应热的测定” 等实验一起承载着课程标准中“体会定量研究的方法对研究和学习化学的作用” 的功能。 三种现行的不同版本的教材对其编排有所不同:人教版将其安排在第三章中 “水的电离和溶液的酸碱性”这一节,作为pH 的一个重要应用;苏教版则在专题3 的第二单元中单独设立栏目介绍酸碱中和滴定,着眼于研究测定和控制溶液的酸碱性在实践中的应用;鲁教版则将这部分内容安排在第三章第四节“离子反应”之中。 不同的编排次序, 显示了教材编写者不同的思路和意图,但仔细研究可以发现一些共同之处,编写者不约而同地将其设置在实用的背景之下, 让学生感受到知识的价值,且都安排了“活动与探究”环节,以凸显化学学科特点,发挥定量实验的教育功能。
定性分析到定量研究是人类认识上的一大飞跃,从模糊到清晰、从表象到本质。 定量实验的核心要求是高精确度,而提高酸碱中和滴定实验中精确度的关键有两点:准确测量所需溶液的体积,准确判断滴定的终点,前者需要精确的仪器和规范的操作。 滴定管是一种具有精确刻度、内径均匀的细长玻璃管,取液方便,用它代替量筒,学生容易接受,而规范操作可在实践中慢慢培养。 但对于通常没有外观变化的中和反应, 如何判断滴定终点,对学生来说是个难点。
本节课设计了三个环节。 第一个环节是定性分析,贴近学生实际,便于自主研习。 既揭示研究课题,复习旧知,又为下一环节创设情景,留下伏笔;第二个环节是定量研究,引导学生通过观察实验、记录数据、绘制图像等方式发现酸碱中和过程中pH 变化规律及表征滴定终点的方法,直观与抽象结合、定性与定量对比,层层递进,将学生的思维渐渐引入新的高度;第三个环节将理论付诸实践,以测定未知盐酸的浓度为任务驱动,教师提供仪器和药品,学生分组讨论交流,形成实验方案,最后小组协作完成实验。 整个过程关注学生的主动参与,在实验过程中感悟和提升,培养合作精神和反思意识。
二、教学目标
(1)认识酸碱中和滴定的原理,知道酸碱中和过程中pH 突变的存在,能绘制简单的pH 变化曲线,初步学会使用滴定管。 (知识与技能)
(2)通过用已知浓度的NaOH 溶液测定未知盐酸的浓度的实践活动,提高实验设计和反思的能力。 (过程与方法)
(3) 通过分析酸碱中和过程中pH 的变化规律,感受定量研究的重要性。 (过程与方法)
(4) 能进一步感受到定量实验的严谨之美和化学的实用价值,能在思考分析过程中倾听他人意见,相互启发,体会合作交流的重要性。 (情感态度与价值观)
三、教学过程与评析
1.定性认识酸碱中和过程中pH 的变化
创设情景:室温下,向装有20.00mL、0.100mol·L-1稀HCl 的 锥 形 瓶 中 逐 滴 加 入0.100mol·L-1NaOH 溶 液30.00mL。
提问: 描述整个过程中溶液的pH 如何变化? 以NaOH 溶液的体积为横坐标,pH 为纵坐标,画出pH 变化的图像(标出起点和终点坐标,已知lg5=0.7)。
交流: 学生展示的图像均能体现溶液的pH 由小变大的趋势,起点坐标为(0,1),终点坐标为(30.00,12.3)但细节上却不尽相同,如图1。
过渡:图像的正确性教师暂不做评价,请学生先看下面的问题。
投影:常见的酸碱指示剂主要有三种,它们的颜色变化是在一定pH 范围内发生的,变色范围如下表:

图1
?
提问:在上述实验中,如果预先在稀盐酸中分别加入2-3 滴以上指示剂,实验过程中可能会有哪些颜色变化?
交流:甲基橙 红色——橙色——黄色
石 蕊 红色——紫色——蓝色
酚 酞 无色——粉红色——红色评析:本段教学立足于学生的已有经验,以一个非常简单的实验问题为先行组织者,提示学生用图像研究变化过程。 当学生展示的答案有争议时,教师并没有急于公布正确答案,而是留下悬念,为下一步的探究预留可对比的素材;接着介绍酸碱指示剂,引导学生用直观形象的方式说明溶液酸碱性的变化,使学生从不同的角度思考问题,同时为中和滴定实验中指示剂的选择留下伏笔。
2.定量探究酸碱中和过程中pH 的变化
过渡:测定溶液pH 的方法很多,可以用pH 试纸测量,也可以用一种叫pH 计(也叫酸度计)的仪器来测量,根据不同精确度要求可以选择不同的测量方法。
投影:pH 计及使用说明。
演示实验: 用pH 计定量测定酸碱中和过程中pH的变化。
用酸式滴定管准确量取20.00mL0.100mol·L-1稀HCl,注入锥形瓶中,在碱式滴定管中装入0.100mol·L-1NaOH 溶液。 每加入5-10mL 碱液,用pH 计测量和记录一次溶液的pH,终点附近,测试和记录的间隔变小,每加一滴测一次,一滴大约为0.04mL。
展示:记录的数据如下表:

?
提问:按照上表数据,请以NaOH 溶液的体积为横坐标,pH 为纵坐标,重新画出pH 值变化的图像。 与对比第一次画出的图像有何区别。
交流:学生展示的图像如图2:
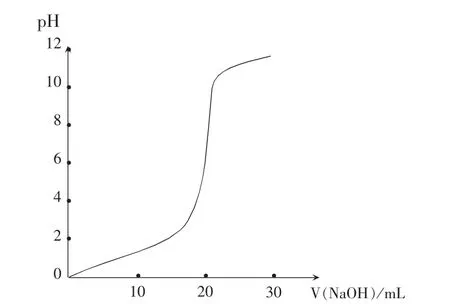
图2
酸碱中和过程中溶液pH 的变化并不是均匀的,刚开始变化比较小,终点附近pH 发生了突然变化,碱过量以后,pH 增大得也较慢。 (学生)
追问:从实验可以看出,很少量(0.04mL,约一滴)的碱就会引起溶液pH 的突变,从4.00 变化为10.30。 请思考pH 突变能否用来判断中和反应的终点?
交流:可以的。
再问:能否设计一个简单的实验(可以观察到明显的现象)来帮助我们判断加入的碱液正好与20.00mL 的稀盐酸完全反应。
提示:实验允许的误差范围一般为±0.1%,对本实验而言,即一滴或半滴的问题。
交流:
(1)将指示剂的变色范围标在pH-V(NaOH)曲线上,指示剂的变色范围正好在pH 的突变范围内。
(2)指示剂的变色范围很窄(甲基橙1.3、石蕊3、酚酞2),对溶液的酸碱性变化很灵敏,终点附近少量的酸或碱就会引起指示剂的突然变色。 (学生)
(3)预先在稀盐酸中加入几滴甲基橙,当观察到红色恰好变成橙色即可。
预先在稀盐酸中加入几滴石蕊,当观察到红色恰好变成紫色即可。
预先在稀盐酸中加入几滴酚酞,当观察到无色恰好变成粉红色即可。 (学生)
补充实验:向滴有石蕊试剂的稀盐酸中加入氢氧化钠溶液(让学生亲自感受到红紫蓝三色变化不明显这一事实)。
小结:在强酸和强碱反应时,通常可以选用甲基橙或酚酞试液来帮助我们判断反应的终点。
引申:如果上述实验反过来进行,向NaOH 溶液中逐渐加入稀盐酸, 所得到中和滴定的曲线会有什么不同?
交流:(略)
评析: 在学生定性分析酸碱中和过程中pH 变化的问题出现困惑时, 适时引入测定pH 的精确仪器——pH计。 通过课堂演示实验,定量测定pH,揭示变化的规律,解决心中的疑惑。 从定性研究走向定量分析,体现了思维应有的轨迹,同时让学生领悟到定量分析在学科中的价值。 前后两次作图的对比,提供了一个很好的感性平台,教师没有过多的讲解,学生却可真实感受到pH 突变的存在。 紧接着几个环环相扣的问题,很自然地引导学生去关注指示剂的变色范围和pH 的突变范围, 进而突破指示剂选择这一难点问题,层次分明,水到渠成。
3.体验酸碱中和滴定实验
过渡问题:中和反应一般没有明显现象,但我们学会了判断中和反应的终点之后,能否用已知物质的量浓度的酸(或碱)溶液来测定未知浓度的碱(或酸)的物质的量浓度呢?
交流:用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),通过测定反应完全时消耗已知浓度的酸(或碱)的体积,从而推算出未知碱(或酸)的浓度。
创设情景:同学们实验台上摆放的药品中就有一瓶0.100mol·L-1的标准NaOH 溶液, 但盐酸是未知浓度的,现在就请你们利用提供的实验仪器和药品,亲手测定它的浓度。
交流:
(1)实验需要的数据有三个:NaOH 溶液的浓度(已知),盐酸的体积(事先预设,一般取20.00mL),滴定到终点时所用的NaOH 溶液体积(待测)。
(2)实验步骤可分五步:用酸式滴定管量取20.00mL的稀盐酸注入锥形瓶内;用碱式滴定管量取标准氢氧化钠溶液,调节和记录起始读数;向锥形瓶内滴加2 滴酚酞试液;中和滴定,记录终点读数;重复以上实验并计算。(学生)
学生实验,教师巡视。
交流和反思:本实验采用的可以提高实验的精确度措施。
(1)精确取液仪器——滴定管(取代量筒),盛液防溅仪器——锥形瓶(取代烧杯)。
(2)准确使用滴定管(查漏、洗涤、润洗、注液、赶气、调液、读数)。
(3)滴加速率先快后慢,边加边振荡。
(4)准确选择指示剂,仔细观察锥形瓶中颜色变化。
(5)多次重复,取平均值。
评析:经过上面两个环节的教学,学生已经认识到酸碱中和滴定的原理,产生付诸实践的冲动和激情。 加之前面已经观看了教师使用滴定管的规范过程,大多学生具备了设计和操作“测定未知盐酸的浓度”这一实验的能力。 因此,教师没有过多的干预,只是在行间不间断地巡视,对操作有困难的学生及时地提供帮助。 在实验后的反思教学中,突出定量实验精确度的要求,通过交流探讨,让学生对实验中的注意事项了然于胸,同时有利于培养细心、严谨的学科素养。
四、教学体会
此节课的教学过程中, 力求体现新课程的基本理念:面向全体学生,注重知识的构建过程,提高化学科学素养。
新课程认为,把知识结论告诉学生,不如设计活动让学生在探索中获得;把技能要点告诉学生,不如设计活动让学生在实践中获得;把感受体会告诉学生,不如设计活动让学生在体验中获得。 在本堂课设计的三个活动中有绘图对比、讨论交流、实验观察、动手操作、反思提升,要求每个学生参与,让学生在解决问题的过程中获得不同程度的成就感,避免了上课热闹、课后糊涂,提高了课堂效率。
——以“NaOH标准溶液的标定”微课教学为例

