剑叶龙血树叶DNA三种不同提取方法的比较分析
徐 婧,杨光忠
(中南民族大学 药学院,武汉 430074)
剑叶龙血树Dracaenacochinchinenis(Lour.) S.C.Chen系龙舌兰科(Agavaceae)龙血树属(Dracaena),分布于云南、广西、海南等地[1],是药材龙血竭的基源植物[2,3].龙血竭具有行瘀止痛、止血敛疮等功效,有“活血圣药”之称[4].随着龙血竭需求的不断扩大及对龙血树资源的掠夺性采伐,龙血树野生资源日趋枯竭,濒危灭绝[5].目前对剑叶龙血树的研究主要在其药用[6,7]和有效成分[8,9]等方面,有关其种质鉴定、遗传多样性尚未见报道.对剑叶龙血树开展种质鉴定及遗传多样性分析对于其种质资源保护具有重要的理论指导意义.
DNA提取是植物分子生物学研究的基础技术.运用高效快速的提取技术获得高质量的DNA产物,是利用分子标记进行植物种质鉴定、遗传图谱构建、遗传多样性分析的前提[10].本文通过比较3种常用的DNA提取方法——CTAB法、SDS法和高盐低PH法对剑叶龙血树叶的DNA的提取效果,探讨影响DNA提取的主要因素,优选适合龙血树叶片DNA提取的技术路线,为后续的龙血树遗传多样性研究及遗传育种工作提供理论依据.
1 材料与方法
1.1 材料、试剂和仪器
剑叶龙血树叶采自广西左江石景林公园.三氯甲烷、无水乙醇、EDTA、NaCl、乙酸钠、异戊醇、异丙醇、Tris为国产分析纯,CTAB、PVP(Biosharp Company),琼脂糖(Biowest公司),β-羟基乙醇(AMRESCO Biotechnology).
CTAB法分离缓冲液:2% CTAB,100 mmol/L Tris-HCl(pH 8.0),20 mmol/L EDTA,1.4 mol/L NaCl,2% 巯基乙醇;洗涤缓冲液:76% 无水乙醇,10 mmol/L乙酸铵.
SDS法预冷提取液:50 mmol/L Tris-HCl(pH 8.0),3% PVP,2% β-巯基乙醇,50 mmol/L EDTA;裂解缓冲液:100 mmol/L Tris-HCl(pH 8.0),20 mmol/L EDTA,500 mmol/L NaCl,1.5% SDS.
高盐低PH法预热提取液:100 mmol/L NaAc,3% PVP,2% β-巯基乙醇,25 mmol/L EDTA,1.5% SDS;TE缓冲液:10 mmol/L Tris-HCl(pH 8.0),1 mmol/L EDTA.
冷冻离心机(Eppendorf 5417R台式,德国),高压双稳电泳仪(DYY-4C型,北京六一),水平电泳槽(DYCP-31D型,北京六一),自动凝胶图像分析仪(JS 380,上海培清科技有限公司),核酸蛋白紫外测定仪(Amersham Biosciences).
1.2 CTAB法提取DNA
取研磨后的叶片0.1 g于1.5 mL 离心管中,加入500 μL 65℃水浴预热的CTAB分离缓冲液,轻轻转动使之混匀,65℃水浴保温30 min,隔10 min震摇1次.稍冷后,加500 μL氯仿/异戊醇(V(氯仿)∶V(异戊醇)=24∶1),颠倒混匀,7000 rpm离心10 min,吸上层水相加2倍体积的乙醇,轻混,10000 rpm离心10 min.弃上清,加1 mL洗涤缓冲液洗涤20 min,5000 rpm离心5 min,重复洗涤1次,将干燥透明状DNA沉淀溶于100 μl TE缓冲液中,于-20℃保存备用.
1.3 SDS法提取DNA
取研磨后的叶片0.1 g于1.5 mL离心管中,加入500 μL预冷提取液,充分混匀后冰上放置10 min,6000 g离心5 min,弃上清,加入预冷提取液重悬,离心后弃上清,沉淀加入500 μL 65℃预热的裂解缓冲液,65℃水浴30 min,不时轻轻颠倒.稍冷后加入500 μL氯仿/异戊醇(V(氯仿)∶V(异戊醇)=24∶1),颠倒成乳浊状,10000 g 4℃离心10 min,重复2次,上清加入125 μL乙醇和55 μL 5 mol/L KAC(pH4.8),立即10000 g 离心10 min.上清加入等体积-20℃预冷的乙醇,-20℃静置30 min,10000 g 4℃离心20 min,用70%乙醇洗涤沉淀2次,风干后溶于100 mL TE,-20℃保存备用.
1.4 高盐低PH法提取DNA
取研磨后的叶片0.1 g于1.5 mL离心管中,加入500 μL 65℃预热提取液充分混匀后65℃中保温30 min,不时轻轻颠倒,4℃ 10000 g离心10 min,取上清液加335 μL 2.5 mol/L KAC(pH4.8),4℃放置15 min.10000 g 4℃离心10 min,上清液加等体积氯仿/异戊醇(V(氯仿)V(异戊醇)=24∶1),振荡至乳浊状,静置分层.10,000 g 4℃离心10 min,上清液加等体积的-20℃预冷乙醇,-20℃静置30 min,10000 g 4℃离心20 min,70%乙醇洗涤2次,风干后溶于100 mL TE,-20℃保存备用.
1.5 琼脂糖凝胶电泳检测
配0.7%的琼脂糖凝胶,将5 μL DNA样品与1 μL溴酚蓝混匀,5 μL上样,120V,电泳30~40min,将凝胶移至0.5 μg/mL溴化乙啶溶液中浸泡约10 min后,紫外凝胶成像系统中拍照检测DNA.
1.6 DNA纯度、含量以及蛋白质含量检测
用TE缓冲液稀释DNA样品100倍,测定A280和A260.由A260/A280判断DNA的纯度,并根据A260计算DNA浓度、得率和蛋白质含量[10,11].
DNA浓度(μg/μL)=50×A260×N.DNA得率(μg/g)=C×V/M.蛋白质浓度(μg/μL)=1.45 A280-0.74 A260.(50为在标准厚度为1cm的比色皿中A260=1,相当于50μg/μL的双链DNA,N为稀释倍数,C为DNA浓度,V为DNA体积,M为叶片质量).
2 结果与分析
2.1 DNA提取结果比较
对龙血树叶片采用CTAB法、SDS法、高盐低pH法提取DNA,凝胶电泳检测结果见图1.由图1可见,3种方法的DNA均无明显的拖尾,说明DNA完整性好;DNA在点样孔处均无高亮出现,说明蛋白质、多糖等杂质去除较为彻底,未受蛋白质和多糖杂质的污染.其中,CTAB法的DNA条带最亮,浓度最高;高盐低PH法的条带较亮,浓度次之;SDS法条带亮度最弱,浓度最低.图1中1~3为3份不同随机样品,因为植物在不同器官、不同发育时期,组织中许多代谢物质如酚类、多糖类、萜类等含量和成分各有不同,CTAB法中样品2的浓度显著高于样品1和3,与样品2所处的生长发育时期DNA含量较高相关,这是由基因表达产物等差异引起的,通常认为 DNA提取效果以愈伤组织和幼嫩叶片为佳.
2.2 DNA浓度、纯度和产率的比较
用紫外分光光度计检测3种不同方法的DNA,得A280、A260、A260/A280、DNA浓度、得率和蛋白质浓度,计算样品1-3的平均值,结果见表1.由表1可见,CTAB法的DNA浓度和得率最高,蛋白质浓度最低,提取效果最佳;SDS法提取的DNA浓度和得率低于其他2种方法,蛋白质浓度高于其他2种方法,提取效果最差;高盐低PH法提取的DNA和蛋白质浓度居于其他2者之间.
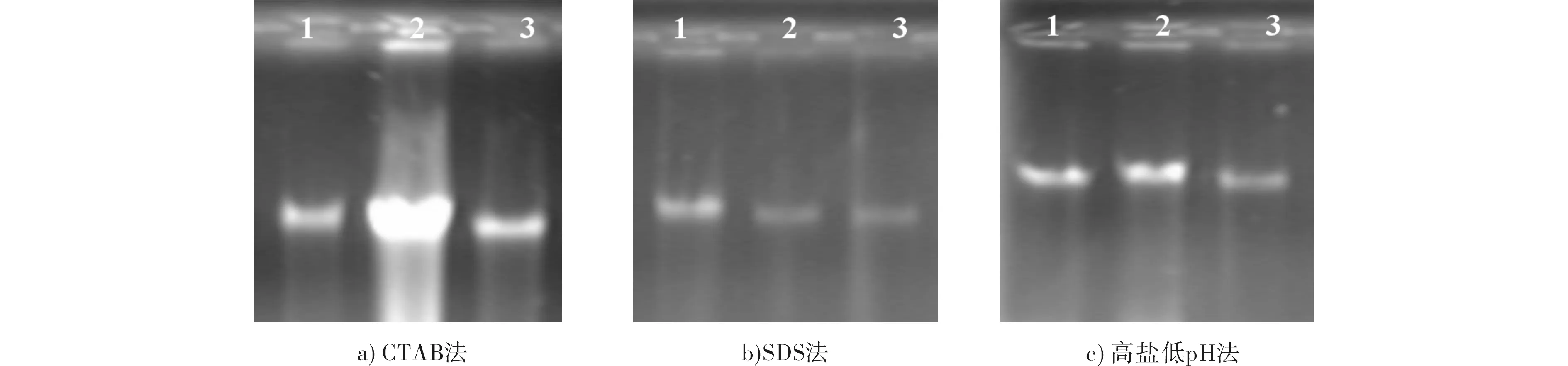
1~3:随机采集的不同龙血树叶片样本 a) CTAB法; b) SDS法; c) 高盐低pH法
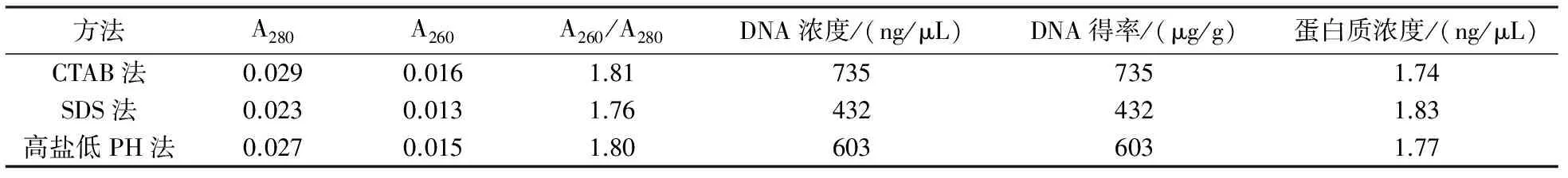
表1 3种提取方法所得DNA浓度和纯度比较
3 讨论
目前,关于植物总DNA的提取方法报道较多,最常见是CTAB法、高盐低pH法和SDS法,3种方法各有其优缺点.CTAB法中CTAB是一种去污剂,它既能裂解细胞,又可与DNA形成复合物而溶于高盐溶液中,当盐浓度降低时此复合物析出,能较好地去除酚类及糖类等高分子杂质,在提取前期获得高含量的DNA.在对龙血树叶片的DNA的提取中,该法DNA得率高,蛋白质污染小,降解程度轻,可满足后续分子检测如PCR的要求,且实验流程简单、步骤少、操作简便.高盐低pH法中,低pH可有效防止组织破碎和沉淀大量材料时的电离化作用和酚类化合物的褐变,高盐是有效的蛋白质沉淀剂,该法简便、经济,但所得DNA浓度和得率低于CTAB法.SDS法中SDS作为去污剂直接裂解细胞,使细胞释放DNA,但该法因反应条件温和不能有效地去除糖类和蛋白质等杂质,故提取的DNA浓度与A260/A280值最低,蛋白质污染最严重.
为提高DNA的浓度,降低杂质含量,在本实验中适当加大了离心力和离心时间;使用幼嫩的植物叶片,因随着植物的生长发育,多糖、多酚等次生代谢产物的含量提高,严重影响DNA的提取质量;在提取液中加入β-巯基乙醇去除酚类,β-巯基乙醇有“-SH”能打断多酚氧化酶的二硫键,使多酚氧化酶失活,防止酚类物质被氧化,有效地防止了褐变[12],故本实验中3种方法所得到DNA均能较好地去除酚类化合物,所得DNA溶液均无色.
综上所述,CTAB法提取的剑叶龙血树叶片DNA的纯度、浓度和得率等均优于SDS法和高盐低PH法,且实验方法简单、易于操作,故CTAB法是最适合于龙血树叶片DNA的提取方法,为龙血树后续的遗传多样性研究提供一定的参考理论依据.
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京: 科学出版社,1996.
[2]蓝鸣生.龙血竭研究进展[J].医学文选,2005,24(6): 1053-1055.
[3]谢宗万.血竭植物的基原的本草考证[J].中药材,1989,12(7): 40-43.
[4]郭 敏,陈 素,刘向明.龙血竭抑制大鼠脊髓背角广动力范围神经元诱发放电的药效物质[J].中国科学C辑: 生命科学,2008,38(12): 1130-1142.
[5]赵 婷,杨玲玲,刘 姮,等.血竭诱导及形成机制的研究进展[J].中草药,2010,41(4): 5-8.
[6]赵 远,王曙光,郭世民,等.龙血竭胶囊的大鼠长期毒性研究[J].中国中药杂志,2007,28(4): 33-35.
[7]曹广军,张静泽,胡迎庆,等.不同工艺提取龙血竭的抗炎镇痛止血作用的比较[J].天津药学,2005,17(3): 3-4.
[8]王 洋,肖宇晴,袁盛磊,等.人工诱导龙血竭与野生龙血竭化学成分的比较研究[J].云南大学学报: 自然科学版,2011,33(3): 366-369.
[9]刘 芳,戴荣继,邓玉林,等.龙血竭化学成分研究进展[J].中国药房,2010,15(3): 1437-1439.
[10]胡晓倩,陈 虎,吕顺清.黄山市几种资源植物基因组总DNA提取方法的初探[J].中国农学通报,2012,28(12): 169-176.
[11]常楚瑞,王永林,王爱民,等.荭草DNA提取方法实验研究[J].时珍国医国药,2012,23(2): 392-393.
[12]党 尉,尉亚辉,张华平,等.葡萄总DNA提取方法的比较研究[J].西北大学学报: 自然科学版,2003,33(5): 572-574.

